Материалы по теме выпускной работы: Реферат | Библиотека | Ссылки | Отчет о поиске | Индивидуальное задание
Актуальность темы
С тех пор, когда человек существует на Земле, он непрерывно взаимодействует с окружающей средой. Практически к середине ХХ ст. деятельность человечества не приводила к значительному вреду в глобальном масштабе.
В результате повышения темпов научно–технического прогресса влияние людей на окружающую их среду становиться все более мощным, почти приравненным к действию природных факторов. В таких условиях ресурсы природы по ликвидации результатов атропогенной деятельности оказываются исчерпанными и наблюдается накопление промышленных отходов, внедрение в природу новых веществ, которые являются токсичными для организмов, что предопределяет повышенный уровень загрязнения атмосферы, гидросферы, литосферы. В свою очередь любые загрязнения окружающей среды (тяжелыми металлами, ядохимикатами, гербицидами, радиоактивными отходами и т. д.) вызывают не только разнообразные заболевания, но и способствуют также нарушению процессов размножения, потому что большинство из загрязняющих веществ обладают эмбриотоксическим, мутагенным, канцерогенным эффектами.
В связи с этим актуальным является поиск новых лекарственных средств, которые будут способствовать более быстрому выздоровлению населения и использование которых поможет предотвратить появление других неизвестных заболеваний.
Цели и задачи
Целью магистрской работы является изучение синтеза нового соединения - [4-(3,4-диметоксифенил)-2,5-дигидробензо[d]-2,3-диазепин-1-илиден]-гидразина, которое может выступать в качестве прекурсора лекарственных препаратов и биологически активных добавок.
Основными задачами при выполнениии магистрской работы являются следующие: проанализировать состояние здоровья населения Украины (на примере Донецкой области) с использованием статистических данных за 2003, 2004 и 2006 года; дать характеристику Донецкой области с точки зрения ее промышленного потенциала; пронаблюдать изменения по выбросам в окружающую природную среду (качественно и количественно); изучить методы получения бензодиазепинов; составить схему постадийного синтеза [4-(3,4-диметоксифенил)-2,5-дигидробензо[d]-2,3-диазепин-1-илиден]-гидразина.
Анализ состояния населения и промышленности в Донецкой области
Статистика утверждает, что на территории Донеччины, занимающей лишь 4,4% всей площади Украины,сосредоточена пятая часть всего промышленного потенциала нашей державы. Поэтому каждому понятны масштабы техногенной нагрузки на окружающую природную среду. Она, по данным экологов, из-за разных опасных факторов, в 5-7 раз выше усредненного показателя по всей Украине. Очевидно, что в рейтинге регионов Украины по индексу экологической безопасности Донецкая область занимает самое последнее место [1].
Донецкая область является одной из наиболее промышленно развитых территорий Украины – около 90% народного хозяйства области приходится на промышленность. С этим связан высокий уровень урбанизованности региона – 91% населения – жители городов. Несмотря на ощутимый упадок в промышленности предприятия продолжают загрязнять окружающую природную среду, нанося при этом вред здоровью людей (рисунок 1, рисунок 2) [2].

Рисунок 1 – Процентное соотношение выбросов вредных веществ по разным городам области
Анализ данных загрязняющих веществ за последние 5 лет (2003 – 2007 гг.) показывает незначительную тенденцию роста уровня загрязнения атмосферного воздуха по диоксиду азота, оксида азота, фенола и формальдегида.
Высокий уровень загрязнения атмосферного воздуха диоксидом азота наблюдался все годы и достигал 2,3 – 2,5 ПДК. За последний год содержание диоксида азота выросло до 3,5 ПДК, что связано с интенсивной работой предприятий металлургической и топливной промышленности, расположенных в пределах города.

Рисунок 2 – Среднегодовые концентрации загрязняющиз веществ за 2003-2007 гг. по г.Донецк
По пыли среднегодовая концентрация с 2003 по 2004 год превышала ПДК почти в 2 раза и незначительно уменьшалась за последние 3 года до 1,7 ПДК, что вызвано уменьшением объема валового продукта горно-добывающей промышленности.
Содержание формальдегида в 2003 - 2006 году колебалось от 2 ПДК до 2,7 ПДК и значительно выросло в 2007 году до 4,3 ПДК, что связано с интенсивной работой предприятий химической и топливной промышленности, расположенных в пределах города и увеличением автотранспорта на дорогах города.
Содержание фенола в течение 2003-2006 гг. не превышало ПДК, но в 2007 г. отмечен значительный рост концентрации этой примеси до 1,7 ПДК, что связано с увеличением количества мелких предприятий черной и цветной металлургии и химической промышленности, а также с увеличением объема производства действующих больших предприятий [3].
Под влиянием кризисных явлений в экономике демографическое состояние в Донецкой области продолжает ухудшаться. В результате высокого уровня смертности, низкой рождаемости и активных миграционных процессов отмечается незначительный прирост населения – за 2003, 2004 и 2006 гг. общая численность населения уменьшилась на 29,4 тыс. чел.(рисунок 3).
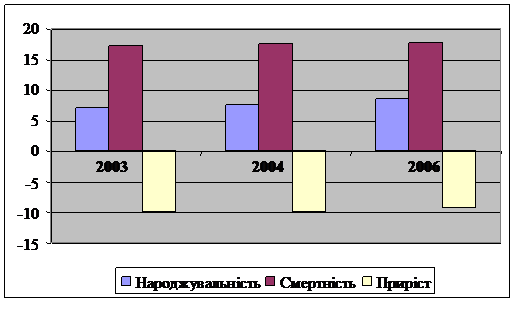
Рисунок 3 – Природное движение населения Донецкой области на 1000чел.
В связи стяжелой экологической ситуацией и социально – экономическими условиями в области изменился показатель смертности от разных заболеваний. Первое место занимают смертельные случаи в результате заболеваний органов дыхания, затем – заболевания системы кровобращения и органов пищеварения (рисунок 4) [2, 4-6].
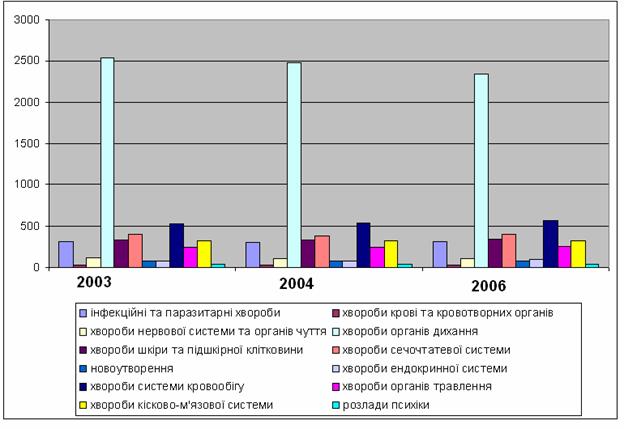
Рисунок 4 – Уровни заболеваемости населения Донецкой области на 10000 чел.
Высокие уровни техногенного загрязнения окружающей природной среды приводят к нарушению антитоксической системы организма. В последние годы в нашем регионе сложилась угрожающая эпидемиологическая ситуация по заболеваемости туберкулезом. Если в 1990 году диагноз активного туберкулеза был установлен полутора тысячам жителей области, то в 2005 году – 4,8 тысячам. Уровень заболеваемости( число заболевших за год в расчетена 100 тысяч населения) возрос за этот период в 3,7 раза – с 28,1 до 103,9 случая. Это выше среднего показаиеля по Украине на 23% (рисунок 5) [4-6].
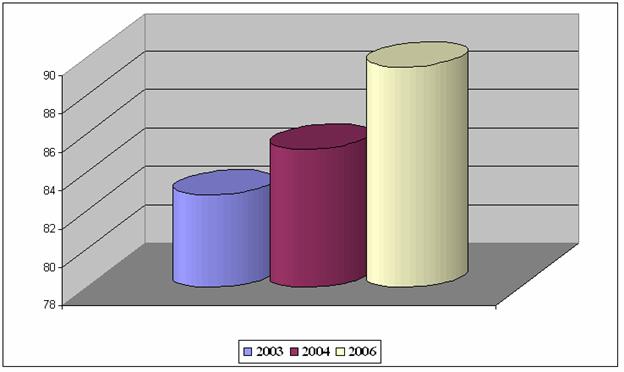
Рисунок 5 – Уровень заболеваемости туберкулезом на 10 000 чел.
Таким образом, показатели состояния здоровья населения и качества окружающей природной среды Донецкой области показывают на значительное ухудшение уровня общественного здоровья населения и обуславливают необходимость проведения комплексных мероприятий, которые направлены на повышение уровня компенсаторно-приспособительских возможностей реакций организма человека и оздоровления природной среды [2].
Обзор методов получения 2,3-бензодиазепинов
Гетероциклические системы с включением гидразина являются во многих случаях структурными компонентами большого количества лекарственных препаратов. Среди них значительное место занимают алкалоиды, много из которых владеют специфическим физиологическим действием и используются в медицине. Именно это стимулирует заинтересованность к этому классу соединений, среди которых найдены и с успехом используются в качестве лекарственных препаратов, а кроме этого они могут выступать как биологическая активная добавка. Работы по установлению структуры, синтеза природных аналогов, поиск новых биологических активных соединений могут сделать существенное влияние на развитие химии гетероциклических соединений и синтеза лекарственных препаратов в целом.
Бензодиазепины, которые имеют в своей структуре семичленные гетероциклы – это группа лекарственных средств, которые используются как главный компонент анестезиологической помощи или как мононаркотик, несмотря на то, что правдивыми общими анестетиками не являются, а скорее типичными представителями малых транквилизаторов – центральных мюрелаксантов.
Бензодиазепины широко известны с тех времен, как среди них были найдены эффективные нейролептики и седативные препарати- представители классов 1,4- та 1,5-бензодиазепина – Седуксен, Валиум и др. Эти классы были достаточно глубоко исследованы, в то время как 2,3-бензодиазепинам до недавнего времени не уделяли достаточного внимания. Характерной чертой производных 2,3-бензодиазепина является чистота фармакологического действия, отсутствие седативного, наркозопотенциального и гипнотического эффектов, толерантности, что свойственные другим представителям класса.
В современной медицинской химии модификация структуры 2,3-бензодиазепина рассматривается как один из наиболее перспективных путей создания лекарственных средств, что стимулируют высшую интегративную деятельность головного мозга - интеллект, память, способность к обучению, повышают стойкость организма к экстремальным условиям. Кроме того, в последнее время 2,3-бензодиазепины обращают на себе внимание как составляющие наноустройств – молекулярные ячейки памяти, переключатели и тому подобное – благодаря их псевдохиральной структуре с широкими возможностями варьирования барьера перехода конформеров.
Одной из главных причин отсутствия фундаментальной обработки в химии 2,3-бензодиазепинов является громкий успех производных 1,4- та 1,5-бензодиазепина на фармацевтическом рынке транквилизаторов, седативних средств и снотворных. Развитие в исследованиях и использовании производных 2,3-бензодиазепина доныне сдерживается малой доступностью соединений указанного ряда в результате отсутствия систематических исследований в этой отрасли.
Успехи в химии 2,3-бензодиазепинов всегда внедрялись в практику. Венгерская фармпромышленность в 1978г. произвела первый в мире дневной транквилизатор-анксиолитик „Грандаксин” со структурой 2,3-бензодиазепина. Следующий подъем интереса к 2,3-бензодиазепинам начался с открытия их способности к неспецифическому связыванию с NMDA-, AMPA- и KA-рецепторами. Установлено, что субсайты АМРА-рецепторов принимают участие в процессах обучения, запоминания, регуляции дегенерации и смерти нервных клеток, а также ответственные за формирование депрессивных состояний.
В 2005 г. компания IVAX (США) успешно закончила клинические испытание средства „Talampanel” для лечения синдрома Паркинсона и эпилепсии. Последние 10 лет ноотропные и анксиолитические свойства 2,3-бензодиазепинов плодотворно изучают американские, венгерские и итальянские фармакологи. По их данным, 2,3-бензодиазепины является перспективной основой новых лекарств для восстановления и защиты головного мозга человека [7].
Анализ литературы позволил выделить следующие методы получения 2,3-бензодиазепинов:
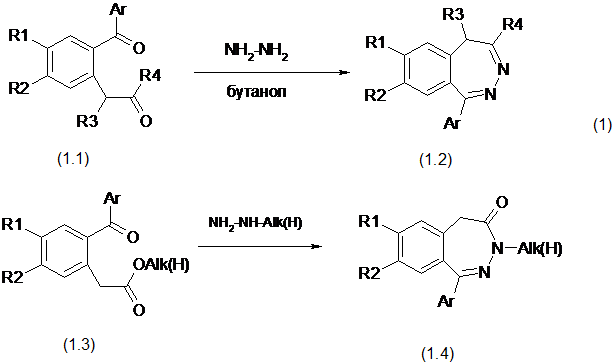
1) Циклизация 1,5-дикарбонильных соединений
Наиболее общим путем синтеза 2,3-бензодиазепинов является реакция 1,5-дикарбонильних соединений с гидразин гидратом и его производными. Взаимодействие 1,5-дикетонов с гидразином в бутаноле приводит к 1-арил-5Н-2,3-бензодиазепинам (схема 1) [8]. В случае циклизации (2-ароил)-фенилуксусных кислот (1.3) или их эфиров образуются соответствующие 1-арил-4,5-дигидро-3H-2,3-бензодиазепин-4-они (1.4) [9].
2) Рециклизация солей бензо[c]пирилия
Соли 2-бензопирилия являются удобными интермедиатами в синтезе производных 2,3-бенздиазепина. В ряду случаев использования этих гетероциклических катионов позволило получить целый ряд 2,3-бензодиазепинов, синтез которых другими методами невозможный или очень усложнен.
3) Аннелирования новых циклов до 2,3-бензодиазепинов
Реакции аннелирования гетероциклических систем до 2,3-бензодиазепиновго цикла являются сейчас важной составляющей в химии данного класса соединений. В литературе описано достаточно много примеров построения полиядерних систем с фрагментом 2,3-бензодиазепина. По большей части это реакции аннелирования до связи 3-4 диазепинового ядра.
4) Другие методы
Возможность синтеза 2,3-бензодиазепинов в реакциях циклизации орто-замещенных диазо-стиролов впервые было продемонстрированный в работах Шарпа и его группы (схема 2). Необходимые для циклизации диазоалкены генерировались in situ путем термического разложения натриевых солей тозилгидразонов стиролов (1.5) их кипячением в органических растворителях [10].

где R = Н, ОСН3;
R1 = H, Alk, Ph;
R2 = H, Alk, Ar.
Текущие и планируемые исследования и их результаты
[4-(3,4-диметоксифенил)-2,5-дигидробензо[d]-2,3-диазепин-1-илиден]-гидразин является аналогом соединения, которое может служить основой синтеза новых лекарственных препаратов и биологически активных веществ . В его основу положен метод, разработанный отделом химии биологически активных соединений ИнФОУ им. Л.М. Литвиненка НАН Украины. Процесс получения данного цикла достаточно сложен и состоит из четырех стадий. Последовательность протекающих реакций схематично представлена на рисунке 6 [11].
По первой стадии кристаллическая гомофталевая кислота (1) реагирует с веротролом (2). Для ускорения протекания реакции к полученному раствору добавляем катализатор. В данном случае в качестве катализатора выступает полифосфорная кислота, которая получается по следущей схеме:
H3PO4 + P2O5 = [ - P – O – P – O – P - ] n
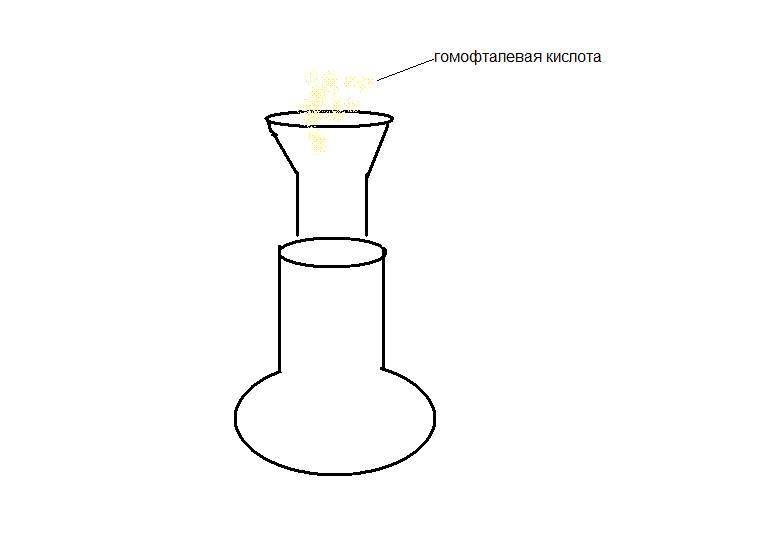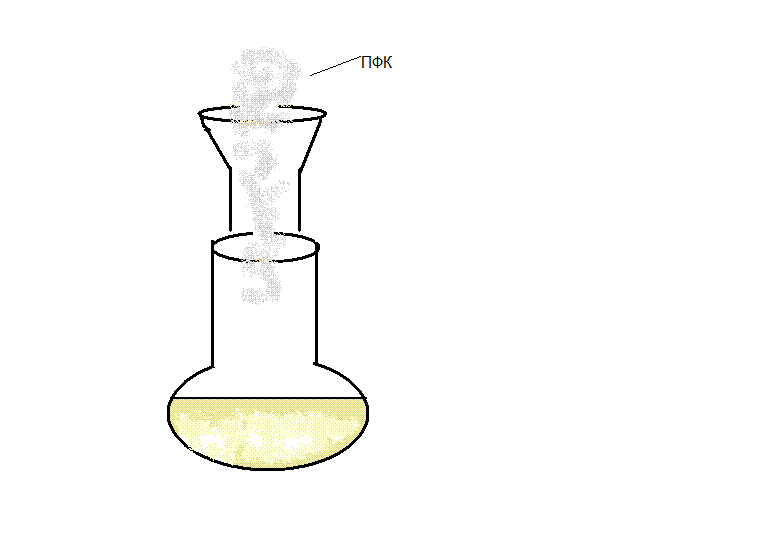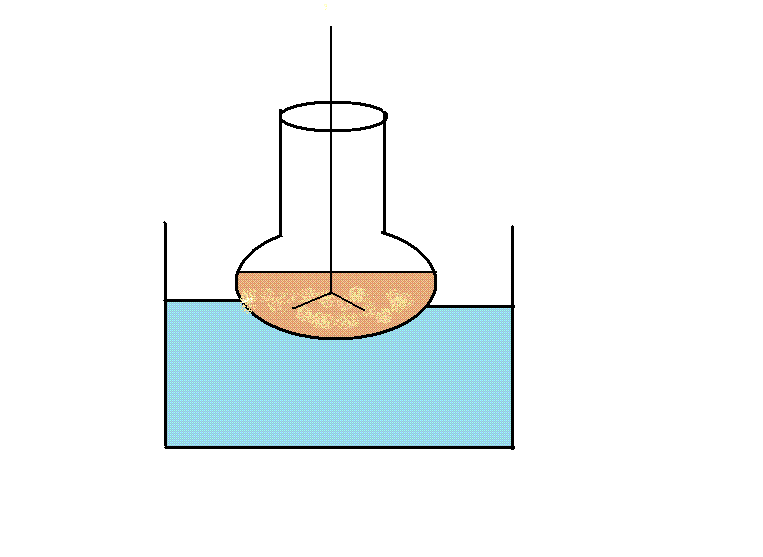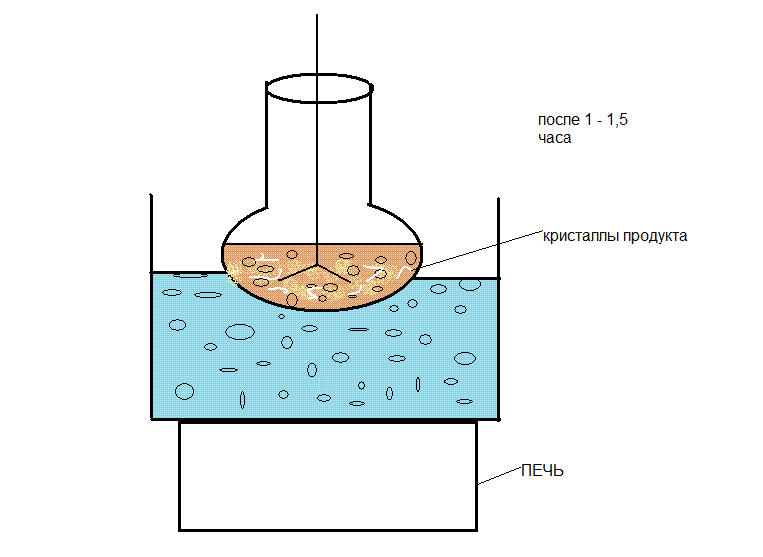
Избыток гомофталевой кислоты смещает равновесие в сторону конечного продукта. Реакционную смесь нагреваем на водяной бане в течении полутора часа. В результате образуется промежуточный продукт 4-(3,4-диметоксифенил)-изохром-1-он (3). Выход его невысок и составил 33%. Малый процент выхода связан с образованием побочных продуктов. Температура плавления кристаллов составляет 155 – 157 0С.
(Технические характеристики анимации: 7 кадров, 2 цикла, задержка 50)
Рисунок 6 - Методика проведения первой стадии синтеза.
Второй стадией является взаимодействие полученного на первой стадии изохром-1-она и гидразина. В данном случае используется не чистый гидразин, а его моногидрат. Исходные компоненты загружаем в колбу, к которой подсоединен обратный холодильник. Перемешивание реакционной смеси является одним из оптимальных условий проведения процесса. Поэтому колба снабжена перемешивающим устройством. Растворителем во второй стадии является изопропанол. Смесь нагреваем до кипения и на протяжении полутора часа продолжаем кипятить до выпадения белых кристаллов - 4-(3,4-диметоксифенил) - диазепин-1-она (4). Затем эти кристаллы профильтровываем на воронке Бюхнера и сушим в сушильном шкафу. Для получения высокого практического выхода необходимым условием является избыток моногидрата гидразина. Также важно подчеркнуть поддержание одной и той же температуры на протяжении всего процесса. Выход 4-(3,4-диметоксифенил)-диазепин-1-она (4) составил 90%. Температура плавления кристаллов составила 174 – 176 0С.

Рисунок 7 – Последовательность стадий синтеза [4-(3,4-диметоксифенил)-2,5-дигидробензо[d]-2,3-диазепин-1-илиден]-гидразина
Следующей стадией является получение 4-(3,4-диметоксифенил)-диазепин-1-тиона (5). В колбу помещаем 4-(3,4-диметоксифенил)-диазепин-1-он и растворитель, которым является этиловый спирт. В момент кипения раствора добавляем реактив Лавессона, после чего подключаем обратный холодильник и греем в течении двух часов.
Для приготовления реактива Лавессона в колбе, оборудованной обратным холодильником, смешиваем абсолютный анизол и сульфид фосфора. Раствор кипятим в течении пяти часов. Характерным признаком протекания реакции является выделение сероводородного газа. Затем колбу охлаждаем и крупнокристаллический осадок фильтруем, промываем чистым анизолом. Осадок на фильтре не высушиваем, а сразу помещаем в герметичную посуду. Это обьясняется тем, что в растворе при нагревании сульфид фосфора может вступать в химическое взаимодействие с парами воды с образованием фосфорного ангидрида.
P2S5 + 5H2O = P2O5 + 5H2S
В свою очередь ангидрид очень хорошо притягивает или «хватает» воду, при этом образуется фосфорная кислота, которая является негативным фактором.
Завершающим этапом получения [4-(3,4-диметоксифенил)-2,5-дигидробензо[d]-2,3-диазепин-1-илиден]-гидразина является реакция взаимодействия диазепин – 1 -тиона с гидразином. Данная реакция протекает в колбе, снабженная обратным холодильником, в течении 30 – 40 минут с момента кипения раствора. Кроме протекания основной реакции могут иметь место побочные реакции, одной из которых является образование того же самого гидразина только с другим положением кратной двойной связи.
Для того, чтобы определить структуру полученного соединения, мспользуется один из физических методов исследования органических соединений – спектроскопия ядерного магнитного резонанса (ЯМР спектроскопия). Данный вид спектроскопии основан на поглощении веществом, которое находится в однородном сильном магнитном поле, энергии радиоволнового излучения.
Для определения температуры плавления полученных веществ используется метод нагрева его в капилляре.
Определение температуры плавления нагревом вещества в капилляре очень удобно, потому что при этом расходуется лишь несколько мг вещества. Капилляр для определения температуры плавления вытягивается из чистой и сухой стеклянной трубки с d = 10-12 мм. Капилляр должен быть запаян с одного конца. Для заполнения капилляра его открытым концом набирают немного измельченного вещества и утрамбовывают. Плотный слой вещества в капилляре должен быть высотой 2 мм. При определении температуры плавления сначала нагрев ведут со скоростью от 4 до 6 0С за минуту, а уже при температурах близких к температуре плавления – со скоростью от 1 до 20С за минуту. Определять температуру плавления необходимо в защитных очках. Определяя температуру плавления следует фиксировать температурный интервал от проявления жидкой фазы к полному плавлению вещества в капилляре. Этот интервал и характеризует температуру плавления вещества. Наличие в веществе примесей обусловливает снижение температуры плавления и увеличивает интервал. Четкая температура плавления, как правило есть признаком чистоты вещества .
В дальнейшем планируется получить практические выходы по последним двум стадиям, а также провести замеры температур плавления 4-(3,4-диметоксифенил)-диазепин-1-тиона и [4-(3,4-диметоксифенил)-2,5-дигидробензо[d]-2,3-диазепин-1-илиден]-гидразина.
Выводы
Таким образом, в ходе выполнения магистрской работы на тему «Исследование синтеза диазепинов как адаптогенов негативных экологических влияний» было проанализировано состояние здоровья населения Украины (на примере Донецкой области), для чего был собран статистический материал за 2003, 2004 и 2006 года. Первое место занимают смертельные случаи в результате заболеваний органов дыхания, затем – заболевания системы кровобращения и органов пищеварения. Высокие уровни техногенного загрязнения окружающей природной среды привели к нарушению антитоксической системы организма. В последние годы в нашем регионе сложилась угрожающая эпидемиологическая ситуация по заболеваемости туберкулезом.
Также предоставлена характеристика Донецкой области с точки зрения ее промышленного потенциала, изучены изменения по выбросам в окружающую природную среду (качественно и количественно). Анализ данных загрязняющих веществ за последние 5 лет (2003 – 2007 гг.) показывает незначительную тенденцию роста уровня загрязнения атмосферного воздуха по диоксиду азота, оксида азота, фенола и формальдегида.
Рассмотрены методы получения бензодиазепинов, основными из которых являются циклизация 1,5-дикарбонильных соединений, рециклизация солей бензо[c]пирилия, аннелирования новых циклов до 2,3-бензодиазепинов и другие.
Составлена схема постадийного синтеза [4-(3,4-диметоксифенил)-2,5-дигидробензо[d]-2,3-диазепин-1-илиден]-гидразина - аналога соединения, которое может служить основой синтеза новых лекарственных препаратов и биологически активных веществ. . В основу его получения положен метод, разработанный отделом химии биологически активных соединений ИнФОУ им. Л.М. Литвиненка НАН Украины. Процесс получения данного цикла достаточно сложен и состоит из четырех стадий.
Список использованной литературы
1 Экология украинской индустрии. http://ecology.iem.ac.ru/ucs/b1222.txt
2 Довкілля та здоров’я. – 2003. №4, с.12-14.
3 Довідка про стан забруднення атмосферного повітря. КЛСЗПС Донецького ЦГМ. 2007р.
4 Показники здоров’я населення та діяльності медичних установ Донецької області за 2006 рік (статистичні матеріали)./ Управління охорони здоров’я Донецької облдержадм. – Донецьк, 2007. – 264с..
5 Показники здоров’я населення та діяльності медичних установ Донецької області за 2004 рік (статистичні матеріали)./ Управління охорони здоров’я Донецької облдержадм. – Донецьк, 2005. – 296с..
6 Показники здоров’я населення та діяльності медичних установ Донецької області за 2003 рік (статистичні матеріали)./ Управління охорони здоров’я Донецької облдержадм. – Донецьк, 2004. – 298с..
7 Electrophysiological studies with a 2,3-benzodiazepine muscle relaxant, GYKI-52466 / I. Tarnawa, S. Farkas, P. Berzsenyi, A A. Pataki, F. Andrasi // Eur. J. Pharmac.- 1989.- Vol.197. - P. 193-199.
8 Богза С.Л. Реакции функционально замещенных солей бензо[c]пирилия. Синтез 5Н-бензо-2,3-диазепинов / С.Л. Богза, Ю.А. Николюкин // Химия гетероцикл. соедин.. - 1993. - № 11. - С. 1475- 1477.
9 Реакции солей 4-цианобензо[c]пирилия с азотсодержащими нуклеофилами / С.Л. Богза, С.Ю. Суйков, Ю.А. Николюкин, В.И. Дуленко // Химия гетероцикл. соедин.-2004. - № 11,-С. 1645-1661.
10 Рециклизация перхлоратов 2-оксобензо[c]пирроло[3,2-e]пирилия гидразидами кислот / С.Л. Богза, А.А. Малиенко, С.Ю. Суйков, К.И. Кобраков, В.И. Дуленко // Химия гетероцикл. соедин.. -1995.- № 12.-С.1691- 1703.
11 Получение 2,3 – диазепинов как структурных компонентов алкалоидов / В. В. Никоненко, А. В. Булавин, О. И. Хороненко // «Охорона навколишнього середовища та раціональне використання природних ресурсів», збірка доповідей. - 2008. - Т.1. - С.134.
ДонНТУ Портал магистров ДонНТУ Реферат | Библиотека | Ссылки | Отчет о поиске | Индивидуальное задание
