

ДонНТУ > Портал магистров ДонНТУ



Факультет экологии и химических технологий
Специальность: Экология химических производств
Материалы по теме выпускной работы: Об авторе | Библиотека | Ссылки | Отчет о поиске | | Методы обеззараживания воды
ПЛАН
Введение
1 Методы анализа
1.1 Термические методы анализа
1.2 ИК-спектроскопия
1. 3 Рентгенофазный анализ
1.4 Йодометрия
2 Результаты исследований
Выводы
Список литературы
ВВЕДЕНИЕ
Самораспространяющийся высокотемпературный синтез (СВС) открыли в 1967 году А. Г. Мержанов, И. П. Боровинская и В. М. Шкирко. Тогда было выявлено явление распространения фронта горения в смесях порошков тугоплавких химических элементов, которые приводят к образованию тугоплавких соединений. Это новое направление, в котором в основном изучались системы простых веществ. Реакции в таких системах представляют собой сильноэкзотермичекое взаимодействие химических элементов в конденсированном виде, что протекает в режиме горения. [1]
Как известно, в системах безводные соли – пероксидные соединения натрия возможно протекание обменных реакций [2], и выделяющегося при этом тепла достаточно для осуществления взаимодействия в режиме самораспространения (СРВ).Например, Mg(ClO4)2 - Na2O2, Cu2Cl2 - NaO2 [3,4]. Изучение реакций, способных протекать в режиме СРВ, представляет интерес для развития новых методов получения неорганических соединений или простых веществ. По литературным данным известно, что при взаимодействии хлоридов некоторых тяжелых металлов с пероксидными соединениями натрия одним из продуктов является газообразный хлор. Так как в настоящее время хлор является наиболее распространенным обеззараживающим агентом [5,6], то его получение представляет значительный интерес. Одним из преимуществ получения газообразного хлора в ходе самораспространяющегося взаимодействия является возможность использовать тепло реакции без подвода энергии извне. Другим достоинством является возможность использования в процессе солей тяжелых металлов – отходов ряда производств.
Целью данной работы является изучение взаимодействия хлорида кобальта с супероксидом натрия и с хлоратом натрия, в частности, количества и состава газообразных продуктов в зависимости от состава исходной смесис целью возможного их дальнейшего использования в качестве обеззараживающих агентов.
1 МЕТОДЫ АНАЛИЗА
В данной работе были использованы следующие методы анализа: дифференциально-термический и термогравиметрический анализ смеси твердых веществ, инфракрасная спектроскопия, рентгенофазный анализ, йодометрия, определение скорости самораспространяющегося взаимодействия.
1.1 Термические методы анализа
Термические методы анализа являются одними из основных при исследовании процессов в конденсированных системах. Среди наиболее широко применяемых неизотермических методов выделяются дифференциальный термический (ДТА) и термогравиметрический (ТГ) анализ. Экспериментально получаемые кривые ДТА и ТГ в большинстве случаев используются для получения первичной информации о температурном интервале стабильности веществ, о составе вещества, температурах начала заметного взаимодействия и фазовых превращениях.
Модель ДТА можно рассматривать как схему, состоящую из двух ячеек предназначенных для термического анализа, внешнего источника тепла (печи) и некоторого участка вокруг ячейки, через который тепловая энергия подводится или отводится от ячейки. Одна из ячеек представляет собой тигель с исследуемым образцом, другая - тигель с термически инертным веществом, принятым в качестве эталона (рис. 1.1).

Рисунок 1.1 – Модель ДТА
Метод ДТА основан на сравнении термических свойств образца исследуемого вещества и термически инертного вещества, принятого в качестве эталона. Регистрируемым параметром служит разность их температур, измеряемая при нагревании образца с постоянной скоростью, которая может быть представлена в виде функции температуры образца, эталона или нагревателя. Изменения температуры образца вызываются физическими переходами или химическими реакциями, связанными с изменением энтальпии. Эти превращения сопровождаются поглощением или выделением тепла.
Термогравиметрия (ТГ) – метод термического анализа, при котором регистрируется изменение массы образца в зависимости от температуры. В данном случае использовалась динамическая термогравиметрия, при которой температура среды, окружающей нагреваемый образец, изменяется с постоянной скоростью.
Установка ДТА позволяет в автоматическом режиме записывать кривые зависимости разности температуры между образцом и эталоном от температуры печи (кривые ДТА) и кривые зависимости потери массы образца от температуры печи.
Схема установки представлена на рис. 1.2.

1 - печь; 2 - тигель с эталоном; 3 - тигель с веществом; 4 - термопара эталона; 5 - термопара вещества; 6 - весы; 7 - ручка включения весов; 8 - прибор управления весами; 9 - тумблеры включения управления весов; 10 - рукоятка включения печей; 11 - задатчик температуры; 12 - самописец кривых ДТА; 13 - самописец кривых ТГ.
Рисунок 1.2 - Схема установки ДТА
Установка состоит из:
1 - двух печей, которые закреплены на поворачивающемся штативе, что позволяет при работе одной печи обеспечивать охлаждение другой;
2 - тигля с инертным эталонным веществом (α-А12О3);
3 - тигля для исследуемого вещества;
4 - термопары, измеряющей температуру эталона. Термопара подключена к каналу Х самописцев (12, 13), что приводит при ее нагреве к смещению каретки самописцев слева направо. Таким образом, на самописцах по оси Х фиксируется температура печи в каждый момент времени;
5 - термопара измеряющая температуру исследуемого вещества. Эта термопара подключена навстречу термопаре (4) (рис.1.1). Таким образом, разница между ЭДС термопары (4) и термопары (5) пропорциональна разнице температур между веществом и эталоном. Эта разница выводится на канал У самописца (12, левый самописец на установке);
6 - аналитических весов с электромагнитной коррекцией положения равновесия. В отличие от обычных аналитических весов, в которых за положением равновесия наблюдение ведется визуально, в данных весах отклонение стрелки от положения равновесия фиксируется фотоэлементом. При отклонении весов от положения равновесия фотоэлемент вырабатывает сигнал, который усиливается и направляется на электромагнит, расположенный под чашкой весов. Электромагнитное поле взаимодействует с постоянным магнитом, расположенным на чашке весов и возвращает весы в состояние равновесия. Напряжение на электромагните, удерживающего весы в состоянии равновесия и пропорциональное массе образца, фиксируется самописцем (13) по каналу У как изменение массы вещества.
7 - ручки включения весов;
8 - прибора управления весами. Прибор принимает сигнал с фотоэлемента и вырабатывает напряжение для управления электромагнитом;
9 - тумблеров включения прибора управления весами;
10 - рукоятки включения печей. С помощью данной рукоятки можно включить печь № 1 или № 2;
11 - задатчика температуры. Он состоит из электродвигателя, редуктора переменного сопротивления и обеспечивает равномерный нагрев печи с определенной скоростью. С помощь подвижной шестерни редуктора скорость нагрева печи можно изменять. Задатчик температуры начинает работать после включения печи;
12 - самописца кривых ДТА. Канал Х самописца настроен и проградуирован на температуру печи.
13 - самописца кривых ТГ. Канал Х самописца настроен и проградуирован на температуру печи.
По полученным в результате термического анализа кривым можно определить наличие эндо- и экзотермических эффектов и сделать предположение о наличии физических или химических превращений; определить температуры превращений; из кривой ТГ произвести расчеты потери массы как в абсолютном выражении так и в процентном.
1.2 ИК-спектроскопия
ИК-спектроскопия – один из основных методов молекулярной спектроскопии – является одним из наиболее часто применяемых методов определения состава и особенностей строения твердых веществ. Большие возможности метода объясняются тем, что ИК-спектры многих соединений являются характеристическими, поскольку поглощение ИК-излучения, проходящего через образец, происходит на частотах, соответствующих энергии перехода атомов в молекуле из основного состояния в возбужденное.
Инфракрасное излучение – уникальное в своем роде физическое свойство. Не существует двух соединений (за исключением оптических изомеров) с различными структурами, но одинаковыми ИК-спектрами. Таким образом, для идентификации неизвестного вещества достаточно сравнить его спектр со спектрами чистых известных веществ. Имея специальный каталог таких спектров сравнения, можно достаточно надежно идентифицировать любое вещество.
Основными частями ИК-спектрофотометра являются: монохроматор, обеспечивающий выделение монохроматического излучения из «белого» спектра источника излучения; источник излучения (разогретый до 1200 °С стержень), который позволяет получать инфракрасное излучение в диапазоне длин волн 2,5-25 мкм; приемник излучения, принимающий прошедшее через образец излучение и преобразующий его в слабый электрический сигнал; система, усиливающая сигнал приемника и управляющая приводом пера самописца; кюветное отделение, служащее для размещения анализируемых образцов.
Принципиальная схема спектрофотометра представлена на рисунке 1.3.

1 – источник излучения; 2 – система зеркал; 3 – исследуемая проба; 4 – эталонная проба; 5 – кюветное отделение; 6 – дифракционные решетки; 7 – призма
Рисунок 1.3 – Оптическая схема инфракрасного спектрофотометра
Исходящие из источника 1 лучи с помощью системы зеркал 2 направляются на исследуемую 3 и эталонную 4 пробы в кюветном отделении 5 спектрофотометра. Затем оба пучка сходятся, вычитаются и направляются системой зеркал на вход монохроматора. Основной частью монохроматора являются дифракционные решетки 6 и призма 7, которые выделяют из сплошного излучения компонент с соответствующей длиной волны. Далее лучи попадают на термоэлемент, который в комплексе с усилительной системой вырабатывает сигнал, управляющий движением пера самописца. В зависимости от угла поворота дифракционных решеток и призмы на приемник попадает монохроматическое излучение с разной длиной волны. Вращая решетки и призму, например, с помощью электродвигателя, можно обеспечить непрерывную развертку излучения по длинам волн. С помощью приемника можно измерить интенсивность прошедшего через образец излучения как функцию длины волны, которая и является ИК-спектром.
Для изучения спектральных характеристик твердых веществ применяют в основном методику регистрации ИК-спектров поглощения. Поэтому успех спектрофотометрического исследования в решающей степени зависит от качества и способа приготовления пробы. В большинстве случаев используются три методики приготовления проб, а именно: растирания образца с вазелиновым маслом; прессования таблеток с бромистым калием; приготовления пленок.
При использовании всех методик исследуемые образцы необходимо растирать до тех пор, пока их размер не станет меньше длины волны ИК-излучения (2,5 - 25 мкм).
1. 3 Рентгенофазовый анализ
Метод рентгеновского дифракционного анализа основан на дифракции рентгеновских лучей кристаллическими веществами. Он подразделяется на рентгеноструктурный и рентгеноспектральный анализы.
При рентгеноструктурном анализе могут быть определены тип кристаллической решетки исследуемого образца, размеры элементарной ячейки; вычислены межплоскостные атомные расстояния; произведен качественный и количественный анализы; установлен фазовый состав вещества; исследованы структура поликристаллов и распределение структурных дефектов в кристаллах; проведены другие специальные исследования состава и структуры монокристаллов и кристаллических порошкообразных веществ, твердых растворов, в том числе керамических и огнеупорных материалов.
Гигроскопичные и окисляющиеся вещества нeo6xoдимo при съемке рентгенограммы изолировать от окружающей среды. Качество рентгенограммы зависит от размера кристаллов, и обычно исследуемое вещество предварительно тщательно измельчается. Приготовление образца ведется в такой последовательности: исследуемое вещество измельчается в фарфоровой (агатовой) ступке и просеивается через сито J 0063; полученный тонкодисперсный порошок впрессовывается в специальную кварцевую кювету (при необходимости используется связывающий материал – цапонлак, клей трагакант, канадский бальзам, пластилин). Поверхность образца должна быть ровной и совпадать с поверхностью кюветы.
Рентгенофазовый аппарат ДРОН-УМІ состоит из отдельных блоков и узлов. Функциональная схема установки приведена на рисунке 1.4.
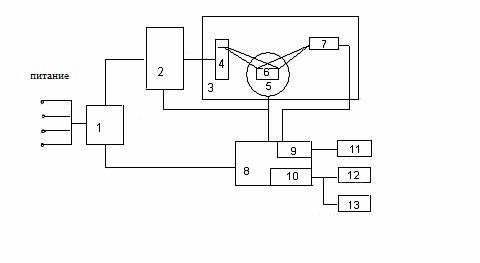
1 – блок электрического питания; 2 – питающее устройство; 3 – дифрактометрическая стойка; 4 – рентгеновская трубка; 5 – гониометр; 6 – гониометрическая приставка; 7 – блок детектирования; 8 – управляющий комплекс; 9 – блок регистрации; 10 – счетный комплекс; 11 – самопишущее устройство; 12 – печатное устройство; 13 – перфоратор.
Рисунок 1.4 – Функциональная схема дифрактометра ДРОН-УМІ
Питание дифрактометра осуществляется через блок электрического подключения 1. Основным узлом устройства является дифрактометрическая стойка 3, на которой смонтирована рентгеновская трубка 4 в защитном кожухе, гониометр 5, блок детектирования 7. Стойка 3 размещена на столе питающего рентгеновского устройства 2, которое обеспечивает питание трубки 4 стабилизированным высоким напряжением.
Управляющий комплекс 8 предназначен для обеспечения управлением гониометром и исполнительными механизмами, а также для сбора и обработки информации с последующим выводом на регистрирующее устройство (печатное устройство 12 или перфоратор 13). Упавляющий комплекс обеспечивает автоматический режим работы устройства ДРОН-УМІ за заданной оператором программой. Для этого применяется мини-ЭВМ 10.
Отображенное от исследуемого образца, размещенного в гониометрической приставке 6 гониометра, рентгеновское излучение попадает в блок детектирования 7, в котором кванты рентгеновского излучения превращаются в электрические импульсы.
В качестве детектора излучения в дифманометра используются пропорциональные счетчики. Импульсы с счетчика идут в блок регистрации 9 управляющего комплекса, усиливаются и подаются в дискриминатор. Полученный при этом исходный сигнал записывается в виде рентгенограммы на диаграммной ленте самопишущим устройством 11 или автоматически вычисляется по программе вычислительного комплекса 10, а потом выводится на печать [7].
1.4 Йодометрия
В основе метода лежит полуреакция
В данной работе йодометрия используется для косвенного определения хлора, восстановившегося йодидом калия
При этом количество выделяющегося J2 эквивалентно количеству хлора. Выделившийся йод оттитровывается стандартным раствором тиосульфата натрия в присутствии индикатора – крахмала
Таким образом, количество пошедшего на титрование тиосульфата натрия эквивалентно количеству хлора.
2 РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
В данной работе проводилось исследование взаимодействия компонентов систем CoCl2 - NaO2 и CoCl2 - NаСlО3.
Для проведения анализа предварительно хлорид кобальта высушивался при температуре 130°С. Для приготовления образцов использовалась фракция СоCl2 с диаметром частиц 0,05 - 0,1 мм. Супероксид натрия и хлорат натрия использовался без дополнительной обработки. Смеси хлорида кобальта с супероксидом натрия и с хлоратом натрия готовились в шаровой мельнице.
В данной работе был использован дифференциально-термический (ДТА) и термогравиметрический анализ (ТГ) смеси твердых веществ. При этом смесь нагревалась от комнатной температуры до 500°С со скоростью 14 град/мин. Для определения скорости СРВ методом глухого прессования прессовалась таблетка, имеющая диаметр 30 мм. Инициирование процесса СРВ осуществлялось путем подвода к таблетке высокотемпературного источника тепла. Также для анализа твердых продуктов взаимодействия исходных веществ применялся метод ИК-спектроскопии, методика с вазелиновым маслом. Анализ газообразных продуктов, в частности, определение наличия газообразного хлора и его количества, осуществлялся йодометрическим методом, для чего образовавшуюся после взаимодействия газовую смесь собирали, а затем прокачивали через подкисленный раствор йодида калия (рис. 2.1).

Рисунок 2.1 - Схема установки (Технические характеристики анимации: кадров - 11, количество повторений - 10, размер - 26,3 Кб, интервал между кадрами - 0,8 секунд)
При проведении термического анализа смесь хлорида кобальта с хлоратом натрия с мольным соотношением компонентов соответственно 3:2 нагревалась от комнатной температуры до 500°С со скоростью 14 град/мин. При этом на кривой ДТА (рис. 2.2) при температуре 240°С фиксируется экзотермический эффект. Потеря массы составила 23,01%.

Рисунок 2.2 - Кривая ДТА для системы CoCl2 : NаСlО3 при мольном соотношении компонентов 3:2
Взаимодействие исходных компонентов при мольном соотношении соответственно 3:2 проходит в соответствии со следующим уравнением реакции
Возможно протекание побочных процессов, например, согласно литературным данным, окисление образовавшегося в ходе реакции (2.1) оксида кобальта СоО при нагревании на воздухе выше 390°С до Co3O4 [8]
С учетом этого процесса суммарное уравнение реакции имеет следующий вид:
Теоретическая потеря массы в соответствии с уравнением реакции (2.3) составляет 23 %. При проведении термического анализа потеря массы составила 23 %, а при проведении СРВ - 22 %.
Анализ содержания газообразного хлора в газообразных продуктах взаимодействия осуществлялся йодометрическим методом. Для этого образовавшуюся после взаимодействия хлорида кобальта с хлоратом натрия с мольным соотношением соответственно 3:2 газовую смесь отбирали, а затем прокачивали через подкисленный раствор йодида калия.
В результате проведенного анализа газообразных продуктов СРВ установлено, что хлор выделяется в количестве 0,53 г на 5 г исходной смеси, что соответствует 23% от количества хлора, содержащегося в первоначальной смеси в виде хлорид- и хлорат - ионов. Содержание хлора в газообразных продуктах составляет 45 %об [9].
Ранее установлено, что в условиях ДТА взаимодействие хлорида кобальта с супероксидом натрия при мольном соотношении 3:2 начинается при температуре 258°С. При данной температуре на кривой ДТА (рис. 2.3) фиксируется сильный экзотермический эффект. Ему на кривой ТГ соответствует скачкообразная потеря массы, которая составила 14,79 %.
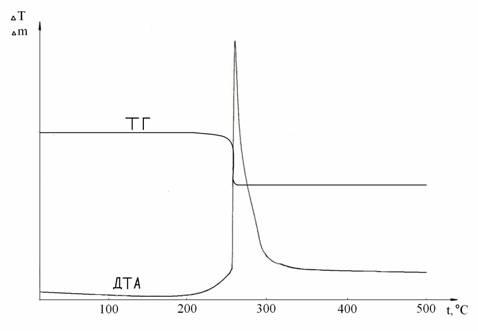
Рисунок 2.3 - Кривые ДТА и ТГ для системы СоCl2 : NaO2 при мольном соотношении компонентов 1:2
Полученный эффект соответствует взаимодействию компонентов системы в соответствии со следующими уравнениями реакций:
Разложение NaO2 до Na2O2 происходит при температуре 140?250°С. Также может протекать побочная реакция (2.2). С учетом ее суммарный процесс взаимодействия хлорида кобальта с супероксидом натрия имеет следующий вид:
При избыточном содержании хлорида кобальта в смеси СоCl2 - NaO2 возможно протекание побочных реакций, в частности, взаимодействие непрореагировавшего хлорида кобальта с кислородом. Процесс может быть выражен следующим образом:
При комнатной температуре этот процесс невозможен (ΔGº = 24,473 кДж/моль), но при температуре выше 304ºС такой процесс становится термодинамически возможным. То есть с учетом побочной реакции суммарное уравнение процесса взаимодействия хлорида кобальта с супероксидом натрия имеет следующий вид:
Анализ газообразных продуктов взаимодействия компонентов системы СоCl2 - NaO2 при мольном соотношении 3:2 показал, что количество выделяющегося газообразного хлора составляет 7,1•10-3 г на 5 г смеси, что соответствует 0,3% от количества хлора, содержащегося в первоначальной смеси в виде хлорид-ионов. Содержание хлора в газообразных продуктах составляет 0,4%. При этом увеличение содержания хлорида кобальта в системе не приведет к существенному увеличению количества хлора в газообразных продуктах. Поэтому получение газообразного хлора при взаимодействии компонентов системы СоCl2 - NaO2 является малоперспективным [10].
ВЫВОДЫ
Сравнение результатов, полученных при исследовании взаимодействия хлорида кобальта с супероксидом натрия и с хлоратом натрия, показывает, что в последнем случае эффективность получения газообразного хлора по всем показателям практически на два порядка выше.
Таким образом, данные факты подтверждают, что существует возможность получения газообразного хлора в ходе самораспространяющегося взаимодействия в системе хлорид кобальта – хлорат натрия, а также данный процесс может протекать в соответствии с приведенным уравнением реакции (5). Дальнейшее изучение процессов, протекающих в системе CoCl2 - NаСlО3, может быть перспективным для получения газообразного хлора [9].
1. Процессы горения в химической технологии и металлургии / Под ред. Мержанова А. Г. Ред. - изд.отдел ОИХФ АН СССР, г. Черноголовка, 1975 г. - 289с.
2. Росоловский В. Я., Никитина З. К., Синельников С. М. Взаимодействие перхлората лития и перхлората кальция с супероксидом и пероксидом натрия // Журн. неорг.химии. - 1995 г. - Т.40. - №1. - с. 6-11.
3. Шаповалов В. В. Самораспространяющееся взаимодействие безводного перхлората магния с пероксидными соединениями натрия // Укр. хим. журн. 2000 г. Т. 66, № 6. С. 96 - 101.
4. Мнускина Ю. В., Шаповалов В. В., Шибико М. М. Взаимодействие хлорида меди (І) с супероксидом натрия/ Сборник статей ДонНТУ, 2005 г., ст.37 - 42.
5. Обзор методов очистки воды: обеззараживание воды / Очистные сооружения, - http://www.1os.ru/content/subs/doc24
6. Хлорирование воды / Нова Терра, - http://www.superfilter.ru/index.php?Page=hlor_water
7. Методические указания к лабораторным работам по курсу "Физика твердого тела" (для студентов специальности 0830) /Сост. В. В. Шаповалов, Ю. Н. Белогуров. - Донецк: ДПИ, 1988г. - 20 с.
8. Краткий справочник физико-химических величин. Изд. 8-е, перераб. / Под ред. А. А. Равделя и А. М. Пономаревой.- Л. Химия, 1983.
9. Получение обеззараживающих агентов при самораспространяющемся взаимодействии в системе CoCl2 - NaClO3. Кулик Т. А., Мнускина Ю. В. Збірка доповідей VIІІ Міжнародної наукової конференції аспірантів і студентів. Т. 2 - Донецьк: ДонНТУ, ДонНУ - 2009 г., с. 108 - 109.
10. Получение хлора в ходе самораспространяющегося взаимодействия в системе CoCl2 - NaO2. Кулик Т. А., Мнускина Ю. В. Збірка доповідей VIІ Міжнародної наукової конференції аспірантів і студентів. Т. 2 - Донецьк: ДонНТУ, ДонНУ - 2008 г., с. 134 - 135.