




Fakultät: Der Ökologie und der chemischen Technologien
Beruf: Ökologie der chemischen Betriebe
Zur Zeit ist Chlor ein erbreitester Agent für Wassersdesinfektion. Früher wurde festgesetzt, dass Erhalten des gasförmigen Chlors bei Selbstverbreitungswechselwirkung (SVW) in den Systemen wasserlos Salzen, die enthalten Chlor,- Natriumsperoxidverbindungen, zum Beispiel, Mg(ClO4)2 - Na2O2, Cu2Cl2 - NaO2, möglich ist. Einer von Vorzugen des Erhaltens des gasförmigen Chlors bei SVW ist es Möglichkeit der Nutzung von Reaktionswärme ohne Energiezuführung von außen. Anderer Vorzug ist die Möglichkeit der Nutzung im Prozess der Schwermetallensalze (der Abfälle der Reihe von Betrieben). Deshalb die Untersuchung der Reaktionen, die fähig im SVW Regime verlaufen, mit dem Ziel der Darstellung gasförmigen desinfizierenden Agenten das bedeutende Interesse vorstellt.
Das Ziel der vorliegenden Arbeit ist die Untersuchung der Wechselwirkung von Kobaltchlorid mit Natriumchlorat. Unter anderem, die Untersuchung von der Anzahl und Aufbau der gasförmigen Produkte der Interaktion in Abhängigkeit von der Basismischungaufbau.
Bei der thermischen Analyse erwärmte die Mischung des Kobaltchlorids mit dem Natriumchlorat mit dem Molverhältnis der Komponenten beziehungsweise 3:2 von der Zimmertemperatur bis 500°C; mit der Geschwindigkeit 14 Grad/Minute. Dabei auf der DTA-Kurve (Abb. 1) bei der Temperatur 240°C; fixiert ein exotermisch Effekt. Der Verlust der Masse hat 23,01 % gebildet.

Die Abbildung 1 - die DTA-Kurve für das System CoCl2 : NaClO3 = 3:2
Die Wechselwirkung der Ausgangskomponenten beim Molverhältnis beziehungsweise 3:2 geht entsprechend der folgenden Reaktionsgleichung
Möglich ist die Nebenreaktionsverlauf, zum Beispiel, laut den literarischen Daten, die Oxidation des Kobaltsoxide CoO, das im Laufe der Reaktion gebildet wurde, bei dem Erhitzen an der Luft höher 390°C bis zu Co3O4
In solchem Fall, hat die summarische Reaktionsgleichung den nächsten Verlauf:
Der theoretische Masseverlust bildet in der Übereinstimmung mit dem Reaktionsgleichung (3) 23 %. Bei der Durchführung der thermischen Analyse hat der Masseverlust 23 %, und bei der SVW - 22 % gebildet.
Die Gehaltsanalyse des gasförmigen Chlors in den gasförmigen Produkten der Wechselwirkung verwirklichte sich von der jodometrische Methode. Dafür entnahm das Gasgemisch, das wurde nach der Wechselwirkung von Kobaltchlorid mit dem Natriumchlorat mit dem Molverhältnis 3:2 gegründet. Dann durchlässt das Gemisch durch die angesäuert Lösung des Kaliumjodids.
Als Ergebnis der Analyse den gasförmigen Produkten des CVW wurde festgesetzt, dass das Chlor entwickelt sich 0,53 g auf 5 g der Ausgangsgemisch. Das ist 23 % von der Menge des Chlors, das sich in der Ausgangsgemisch als das Chlorid- und Chlorationen enthält. Der Gehalt des Chlors in den Produkten bildet 45 %vol.
Früher wurde festgesetzt, dass sich in den DTA-Bedingungen die Wechselwirkung des Kobaltchlorides mit dem Natriumsuperoxid mit dem Molverhältnis 3:2 bei der Temperatur 258°C; beginnt. Bei der vorliegenden Temperatur auf der DTA-Kurve (Abb. 2) fixiert sich ein starker exothermischer Effekt. Auf der TG-Kurve entspricht ihm ein sprunghafter Masseverlust, der 14,79 % gebildet hat.
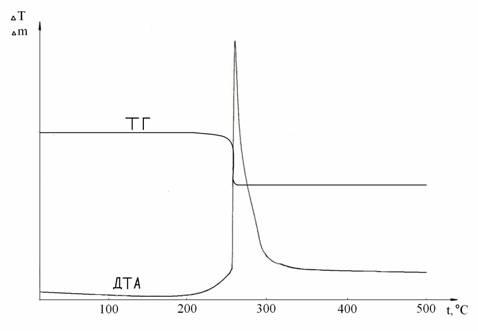
Die Abbildung 2 - die DTA-Kurve für das System CoCl2 : NaO2 = 3:2
Der Gegebene Effekt entspricht der Wechselwirkung der Systemskomponenten entsprechend der folgenden Reaktionsgleichung.
Die Zerlegung NaO2 bis zu Na2O2 geschieht bei der Temperatur 140÷250°C.Auch kann die Nebenreaktion (2) verlaufen. Der summarische Prozess der Wechselwirkung des Kobaltchlorides mit dem Natriumsuperoxid hat den nächsten Verlauf.
Bei dem Mehrgehalt des Kobaltchlorides im Gemisch CoCl2 - NaO2 können die Nebenreaktion verlaufen, insbesondere die Wechselwirkung des nicht umgesetztes Kobaltchlorides mit dem Sauerstoff. Der Prozess kann auf folgende Weise geäussert sein:
Bei der Zimmertemperatur ist dieser Prozess unmöglich (ΔGº = 24,473 kJ/Mol), aber bei der Temperatur über 304ºC wird solcher Prozess thermodynamisch möglich. Das heißt, dass unter Berücksichtigung der Nebenreaktion der summarische Prozessausgleich der Wechselwirkung des Kobaltchlorides mit dem Natriumsuperoxid den nächsten Verlauf hat:
Die Analyse der gasförmigen Produkte der Wechselwirkung der Systemskomponenten CoCl2 - NaO2 beim Molverhältnis 3:2 hat aufgezeigt, dass die Menge das gasförmiges Chlor 7,1∙10-3 g/5g der Gemisch bildet. Das ist 0,3 % von der Menge des Chlors, das sich in der Ausgangsgemisch als das Chlorid - Ionen enthält. Der Gehalt des Chlors in den gasförmigen Produkten bildet 0,4 %.
Dabei wird die Vergrößerung des Gehalts des Kobaltchlorides im System zur wesentlichen Vergrößerung der Menge des Chlors in den gasförmigen Produkten nicht bringen. Deshalb ist eine Darstellung des gasförmigen Chlors bei der Wechselwirkung der Systemskomponenten CoCl2 - NaO2 gering perspektiv.
Der Vergleich der Ergebnisse, die bei der Untersuchung der Wechselwirkung in den Systemen CoCl2 - NaClO3 und CoCl2 - NaO2 bei den identischen Bedingungen bekommen wurden, zeigt auf, dass im Falle der Wechselwirkung der Systemskomponenten CoCl2 - NaClO3 die Erhaltenseffektivität des gasförmiges Chlors nach allen Kennziffern praktisch um zwei Größenordnungen höher ist.
Auf solche Weise, bestätigen die angegebenen Tatsachen, dass die Möglichkeit Erhaltens des gasförmigen Chlors bei der SVW im System CoCl2 - NaClO3 existiert, und auch der angegebene Prozess entsprechend der gebrachten Reaktionsgleichung (3) verlaufen kann. Die weitere Untersuchung der Prozesse, die im System CoCl2 - NaClO3 verlaufen, kann perspektivisch für das Erhalten gasförmigen Chlors sein.