


| Специальность: | Экология химических предприятий |
| Тема выпускной работы: | Активация соединений щелочноземельных металлов в реакциях взаимодействия с диоксидом серы |
| Научный руководитель: | Доктор химических наук, профессор Шаповалов Валерий Васильевич |
Цели и задачи, которые решаются в данном исследовании — изучение процесса активации соединений щелочноземельных металлов в реакциях взаимодействия с диоксидом серы, выявление наиболее эффективного активатора.
Сернистый ангидрид, несмотря на относительно небольшую концентрацию в отходящих газах промышленных предприятий, ввиду своей высокой токсичности как для животных, так и для растений является одним из наиболее опасных веществ, загрязняющих атмосферу. Поэтому очистка так называемых бедных сернистых газов, выпускаемых в атмосферу, от сернистого ангидрида является одной из первоочередных проблем санитарной охраны чистоты воздуха.
Научная новизна исследования состоит в использованиии специализированных активаторов,разработанных кафедрой.
В результате данных исследований планируется изучить процесс активации щелочноземельных металлов в реакциях взаимодействия с диоксидом серы, его термодинамически и кинетические характеристики. На основе практических исследований будет сделан вывод о том, какой из изученных активаторов наиболее всего подходит для использования в качестве активатора поглотителя на предприятиях, использующих серосодержащие виды топлива.
Все процессы очистки от сернистого ангидрида целесообразно разделить на два основных класса, отличающихся по физическому состоянию применяемого основного реагента для извлечения сернистого ангидрида из газов[1]. Первый класс включает в себя процессы с абсорбцией сернистого ангидрида, осуществляющейся при сравнительно низких температурах («жидкостные» методы). Ко второму классу относят методы, основанные на взаимодействии между газом и твердой фазой. Каждый из этих классов принципиально может быть подразделен на три основные группы, отличающиеся по методам использования извлекаемого сернистого ангидрида. Первая группа включает процессы, основной целью которых является только очистка газов без учета возможностей утилизации извлекаемого сернистого ангидрида. Продукты основного взаимодействия сернистого ангидрида с поглотителем являются отходом. Ко второй группе относятся циклические процессы и методы с получением товарного сернистого ангидрида или элементарной серы. В ходе этих процессов производят регенерацию поглотителя. В третью группу процессов очистки газов входят процессы, при которых извлечение сернистого ангидрида осуществляется совместно с его использованием для получения новых химических веществ.[2]
В связи с тем, что для жидкостные методы требуют предварительного охлаждения отходящих газов, больших энергетических затрат и большого расхода воды, для тепловых электростанций, работающих на сернистых видах топлива, более целесообразными являются методы очистки, основанные на взаимодействии между газом и твердой фазой. Как поглотители чаще всего используются оксиды марганца, железа, кальция, их смеси, уголь, цеолиты, и др.
Для получения количественных оценок, возможности осуществления сорбции диоксида серы различными соединениями, были осуществлены термодинамические расчеты реакций.[3] Сделать вывод о возможности протекания реакции между химическими соединениями, можно используя данные об изменении энергии Гиббса в ходе этой реакции. Термодинамический потенциал определяется разницей между энтальпийным (ΔH) и энтропийным (TΔS) факторами, действующими на систему в ходе химического взаимодействия:
Характер изменения энергии Гиббса позволяет судить о принципиальной возможности осуществления процесса. При ΔG<0 процесс может протекать, при ΔG>0 процесс протекать не может (другими словами, если энергия Гиббса в начальном состоянии системы больше, чем в конечном, то процесс принципиально может протекать, если наоборот — то не может). Если же ΔG = 0, то система находится в состоянии химического равновесия. Анализ уравнения позволяет установить, какой из факторов, представляющих энергию Гиббса, ответственен за направление протекания химической реакции:
Реакция возможна, если она сопровождается уменьшением изобарного потенциала; при комнатной температуре, когда значение T небольшое, значение T·ΔS также небольшое, и изменение энтальпии больше T·ΔS. Чем выше температура, тем больше T·ΔS, и даже эндотермическое реакции становятся осуществляемым.[4]
Для расчета энергии Гиббса начальными данными являются значения изменений энтальпии и энтропии химической реакции при определенной температуре.[5]В расчетах принималась температура 298К, при которой рассчитывались значения энтальпии и энтропии реакций.[6] Расчет сделан для оксидов и карбонатов ряда Mg — Ca — Sr — Ba, проявляют сорбционную активность, фосфатов и нитратов этих металлов, которые могут быть использованы как модифицирующие добавки поглотителей, а также некоторых соединений щелочных металлов. Данные, полученные при расчете энергии Гиббса, сведены в таблицу.
| № | Реакция | ΔH, кДж/моль | ΔS, Дж/моль·К | ΔG, кДж/моль |
|---|---|---|---|---|
| 1 | MgO+SO2→MgSO3 | -116,54 | -188,91 | -60,24 |
| 2 | CaO+SO2→CaSO3 | -227,40 | -186,4 | -171,85 |
| 3 | SrO+SO2→SrSO3 | -299,80 | -189,53 | -243,32 |
| 4 | BaO+SO2→BaSO3 | -351,80 | -199,6 | -292,32 |
| 5 | MgO+SO2+O2→MgSO4 | -386,40 | -286,15 | -301,13 |
| 6 | CaO+SO2+O2→CaSO4 | -492,00 | -283,615 | -407,48 |
| 7 | SrO+SO2+O2→SrSO4 | -555,10 | -283,315 | -470,67 |
| 8 | BaO+SO2+O2→BaSO4 | -611,50 | -289,115 | -525,34 |
| 9 | Mg(NO3)2+SO2→MgSO4+2NO2 | -130,90 | 159,7 | -178,49 |
| 10 | Ca(NO3)2+SO2→CaSO4+2NO2 | -122,50 | 145,6 | -165,89 |
| 11 | Sr(NO3)2+SO2→SrSO4+2NO2 | -102,50 | 159,2 | -149,94 |
| 12 | Ba(NO3)2+SO2→BaSO44+2NO2 | -113,70 | 149,9 | -158,37 |
| 13 | Mg3(PO44)2+3SO2→3MgSO3+0,5P4O10 | 94,06 | -560,5 | 261,09 |
| 14 | Ca3(PO4)2+3SO2→3CaSO3+0,5P4O10 | 12,00 | -561,67 | 179,38 |
| 15 | Sr3(PO4)2 +3SO2→3SrSO3+0,5P4O10 | -33,62 | – | – |
| 16 | Ba3(PO4)2+3SO2→3BaSO3+0,5P4O10 | – | – | – |
| 17 | MgCO3+SO2→MgSO3+CO2 | -15,85 | -14,01 | -11,68 |
| 18 | CaCO3+SO2→CaSO3+CO2 | -50,01 | -26,00 | -42,26 |
| 19 | SrCO3+SO2→SrSO3+CO2 | -65,21 | -18,90 | -59,58 |
| 20 | BaCO3+SO2→BaSO33+CO2 | -99,91 | -27,80 | -91,63 |
| 21 | MgCO3+SO2+O2→MgSO4+CO2 | -285,71 | -111,12 | -252,60 |
| 22 | CaCO3+SO2+O2→CaSO4+CO2 | -314,61 | -123,21 | -277,89 |
| 23 | SrCO3+SO2+O2→SrSO4+CO2 | -320,51 | -112,42 | -287,01 |
| 24 | BaCO3+SO2+O2→BaSO4+CO2 | -359,61 | -117,32 | -324,65 |
Из полученных термодинамических оценок видно, что энергия Гиббса реакций с двуокисью серы в ряде соединений Mg — Ba меньше 0, за исключением фосфатов, что определяет их инертность по отношению к SO2. При рассмотрении ряда Mg — Ca — Sr — Ba энергия Гиббса закономерно убывает, как следствие в многокомпонентных системах приоритет в реакции имеют соединения металлов с большим молекулярным весом. Из этого следует, что термодинамически возможно применение всех оксидов и карбонатов щелочноземельных металлов для фиксации диоксида серы из газовых смесей.
Использование в качестве адсорбента карбоната кальция представляется рациональным по следующим причинам:
Процесс поглощения сернистого ангидрида при отсутствии кислорода происходит согласно реакции:
Расчетная адиабатическая температура составляет 381.69 К.
При нагревании образовавшегося сульфита кальция происходит его диспропорционирование:
Расчетная адиабатическая температура реакции составляет 663.87К. В присутствии кислорода в смеси может протекать следующая реакция:
С учетом возможного плавления CaSO4 адиабатическая температура реакции составляет 1512К. Согласно расчетам реакция термодинамически возможна, происходит при высоких температурах, сопровождается выделением тепла
Так же при температурах свыше 873 К возможно частичное разложение CaCO3:
Следовательно для осуществления поглощения сернистого ангидрида карбонатом кальция не требуется предварительное охлаждение дымовых газов. В условиях производства содержание кислорода и сернистого ангидрида будет в избытке по отношению к стехиометрическому. Поэтому был проведен расчет адиабатической температуры реакции при различных мольных соотношениях избытков сернистого ангидрида и кислорода (Рис.1).
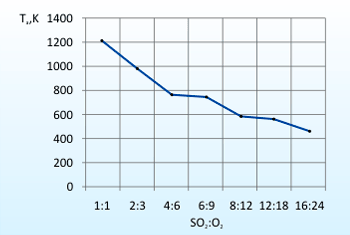
Согласно графику адиабатическая температура реакции будет уменьшаться при увеличении мольного соотношения сернистого ангидрида и кислорода.
Таким образом, поглощение сернистого ангидрида карбонатом кальция можно проводить в широком интервале температур. Все реакции процесса сопровождаются выделением тепла, которое в дальнейшем можно использовать.[7]
Процессы взаимодействия диоксида серы с соединениями щелочноземельных металлов осуществляли на установке, представленной на рисунке 2.
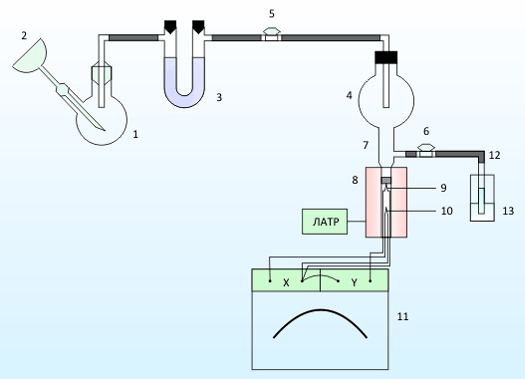
Диоксид серы получают в реакторе 1 при взаимодействии рассчитанного количества суспензии сульфита натрия с концентрированной серной кислотой, которую добавляют через капельную воронку 2. [8] Далее полученный газ проходит осушку с помощью силикагеля в поглотительной трубке 3, и поступает в промежуточные сборник 4 через кран 5. Промежуточный сборник 4 соединен с реакционным сосудом 7 с помощью прозрачного шлифа. В реакционный сосуд должен быть помещен исследуемый адсорбент.
В нижней части сосуда 7 находится выемка для термопары образца 9. Сам реакционный сосуд помещен в трубчатую печь 8, температура его нагрева регулируется с помощью лабораторного автотрансформатора. В нагревательном канале печи находится эталонная термопара 10. Термопары подключены дифференциально к самописцу 11 для лучшей фиксации возможного термического эффекта реакции. Излишки газа отводется с помощью крана 6 и стеклянной трубки 12 в склянку с поглотительным раствором 13.[9]
Для изучения спектральных характеристик вещества было использована методика регистрации ИК-спектров поглощения, что реализовалась на стандартном приборе «Specord 75IR
Основными составляющими устройства прибора является:
Принципиальная схема спектрофотометра приведена на рисунке 3.
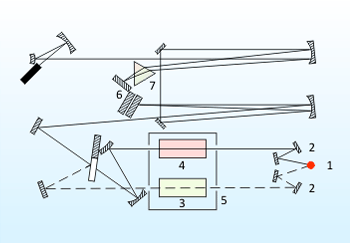
Излучение, которое проходит из источника (1), с помощью системы зеркал (2) идут на исследуемую и эталонную пробы в кюветное отделение (5) спектрофотометра. Дальше оба излучения соединяются и направляются системою зеркал на вход монохроматора. Основной частью монохроматора есть дифракционная решетка (6) и призма (7), которые выделяют из общего излучения компонент с соответствующей длиной волны. Потом лучи попадают на термоэлемент, который в комплекте с усилительной системой производит сигнал, руководствующий движением пера самописца. В зависимости от угла поворота дифракционных решеток и призмы на приемник попадает монохроматическое излучение с разною длиною волн. Вращая решетку и призму, например, с помощью электродвигателя, можно обеспечить непрерывную развертку излучения по длинам волн. С помощью приёмника можно измерить интенсивные излучения, что прошло через образец, как функцию длины волны, которая и есть ИК-спектром.[10]
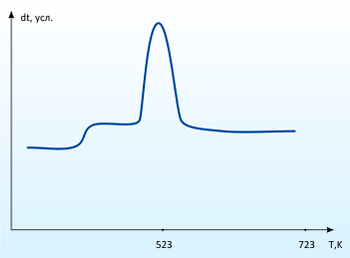
Исследование поглощения диоксида серы карбонатом кальция в лабораторных условиях показали, что при температурах до 500°С активного поглощения не происходит. Но при добавлении активатора эффективность протекания реакции существенно возрастает. На рисунке 4 представлена кривая ДТА процесса поглощения диоксида серы карбонатом кальция в присутствии активатора (10% масс.). По данной кривой можно судить об интенсивности протекания процесса. Масса реагирующей смеси после процесса поглощения увеличилась на 16%. ИК – спектр продукта реакции представлен на рисунке 5. Сравнение спектра с таблицами характеристических частот позволяет сделать вывод о том, что в данном образце имеются анионы SO32-, SO4 2-,CO32-.
Вместе с данными об изменении массы продукта реакции можно сделать вывод о том, что процесс поглощения диоксида серы проходит с образованием как сульфита, так и сульфата кальция при достаточно низких температурах.
Из полученных термодинамических оценок видно, что энергия Гиббса реакций с двуокисью серы в ряде соединений Mg — Ba меньше 0, за исключением фосфатов, что определяет их инертность по отношению к SO2. При рассмотрении ряда Mg — Ca — Sr — Ba энергия Гиббса закономерно убывает, как следствие в многокомпонентных системах приоритет в реакции иметь соединения металлов с большим молекулярным весом. Из этого следует, что термодинамически возможно применение всех оксидов и карбонатов щелочноземельных металлов для фиыыксации диоксида серы из газовых смесей. Полученные данные ΔG<0 для нитратов щелочных металлов (при ΔH<0 и ΔS>0), свидетельствуют о возможности их применения для активации соединений щелочноземельных металлов для поглощения диоксида серы
Использование в качестве адсорбента карбоната кальция представляется рациональным по следующим причинам:
Процесс поглощения диоксида серы проходит с образованием как сульфита, так и сульфата кальция при достаточно низких температурах . Из этого следует, что смеси карбоната кальция с спецализированными активаторами представляет интерес в качестве поглотителя на предприятиях, использующих серосодержащее топливо.