Реферат за темою випускної роботи
Зміст
- Вступ
- 1. Актуальність теми, мета і завдання дослідження
- 2. Характеристика синтетичних переносників кисню
- 2.1 Сполуки кобальту(II)
- 2.2 Дослідження змішанолігандних систем кобальту(II)
- 3 Проведення експерименту
- 4 Результати дослідження
- Висновок
- Перелік посилань
Вступ
Серед різноманітних координаційних сполук особливо цікаві комплексні сполуки перехідних металів з молекулярним киснем, і проблема оборотної взаємодії О2 з комплексами металів надзвичайно важлива. Це, насамперед, пов'язано з тим, що на основі такого типу координаційних з'єднань можна створювати каталізатори високої ефективності для окислення ряду органічних сполук. Поряд з цим, вивчення процесів оксигенації координаційних сполук d-елементів важливо і з точки зору дослідження будови і властивостей переносників молекулярного кисню в живому організмі [1].
Здатністю координувати молекулярний кисень володіють комплексні сполуки певної будови більшості елементів першого перехідного ряду, а також d-елементів VIII групи в нижчих ступенях окислення. Ефективність взаємодії комплексів даних металів з молекулярним киснем визначається геометричною будовою комплексів, складом найближчої координаційної сфери, природою і донорними властивостями ліганду, що займає транс-положення. Одна зі специфічних особливостей кисневих комплексів октаедричного типу полягає в можливості регулювання властивостей координованої молекули кисню шляхом модифікації транс-ліганду.
Цим вимогам певною мірою відповідають низькоспинові плоскі тетракоординаційні комплекси кобальту(II) з підставами Шиффа, координаційна сфера яких містить два або чотири атоми азоту, а в якості транс-ліганда виступає N-гетероциклічна основа. Координаційні сполуки з молекулярним киснем відіграють істотну роль для моделювання як біологічних процесів, так і з'ясування механізмів окислювально-відновних процесів в гомогенному середовищі [1].
1. Актуальність теми, мета і завдання дослідження
Актуальність даної теми полягає в тому, що здатність комплексних сполук кобальту оборотно приєднувати молекулу кисню є важливою з екологічної точки зору. Так як ці сполуки є моделями активних центрів в складних біологічних з'єднаннях (гемоглобіні, міоглобині, гемерітріні, гемоцианіні) і тому можуть розглядатися як природні переносники кисню. Вже розроблені такі препарати як перфторан, перфукол на основі перфрорірованих вуглеводнів, проте вони не досконалі і мають низку недоліків, які перешкоджають їх використанню в клінічних умовах. Для вирішення цієї проблеми необхідний пошук більш оптимальних синтетичних переносників кисню [2].
Мета дослідження полягає у вивченні реакцій комплексоутворення в системі кобальт(ІІ)-аланілаланін-дипіридил як в інертній атмосфері, так і в присутності кисню. Визначенні умов утворення оксигенованих комплексів, що грають важливу роль в сучасній медицині.
Для досягнення мети поставлені такі завдання:
1 – визначити константи рівноваги всіх стадій процесу;
2 – побудувати криві розподілу;
3 – розрахувати рівноважні концентрації в досліджуваній системі;
4 – порівняти отримані результати з наявними в літературі з метою вибору найбільш оптимальних умов проведення дослідження.
2. Характеристика синтетичних переносників кисню
Деякі координаційні сполуки перехідних металів в низьких ступенях окислення здатні оборотно зв'язувати молекулу кисню.
З'ясування закономірностей, що визначають механізми поглинання молекулярного кисню його природними переносниками та його утилізації, вельми складно через високу молекулярну масу білкової частини багатьох природних молекул. Рішення проблем геометричної і електронної будови цих сполук та механізму їх дії значно полегшується при використанні простих модельних систем — комплексів перехідних металів з О2. В даний час досліджено велику кількість таких комплексів, здатних моделювати функції, а в деяких випадках — і будова активного центру природних носіїв О2. Вивчення цих моделей із залученням сучасних фізичних методів дозволило в ряді випадків встановити природу взаємодії металактивного центру з молекулою кисню [3, 4].
Близькими до природних переносникам О2 виявилися комплекси металів першого перехідного ряду в низьких ступенях окислення (Мn(II), Fe(II), Со(II), Ni(II), Сu(I)). Вони (особливо сполуки Со(II)) здатні оборотно оксигенуватися у водних розчинах і мають склад внутрішньої координаційної сфери, аналогічний природним активним центрам. Так, змішані амінокіслотноімідазольні і гістідінантні комплекси Со(II) моделюють функції та склад активного центру гемерітріна [1, 2, 5].
Такі оксигеновані комплекси можна розглядати в якості моделей не тільки природних носіїв кисню, а й металоферментів, які каталізують реакції окислення. Інтерес до активації координованого молекулярного кисню викликаний також можливістю утворення короткоживучих інтермедіатів в гомогенно-каталітичних реакціях автоокисления. Особливе значення для з'ясування механізмів реакцій представляють дослідження реакційної здатності О2 в оксигенованому комплексі. Вивчення реакцій інтермедіата дозволяє представити складний механізм гомогенно-каталітичної реакції у вигляді окремих стадій. Отже, сполуки перехідних металів з О2 відіграють найважливішу роль для моделювання біологічних процесів, а також для з'ясування механізму та пошуку каталізаторів окислювально-відновних процесів.
Однак роль комплексів перехідних металів з О2 не обмежена суто хімічними, біологічними та медичними аспектами. Вони можуть служити джерелами чистого кисню для різних технологічних цілей. Розроблений спосіб одержання запасів кисню на основі біссаліціліденімінкобальта(II). Основний його недолік — необоротне окислення частини переносника кисню в кожному циклі поглинання О2. Координаційні сполуки, які здатні зв'язувати О2, можуть служити індикаторами кисню. Сполуки, здатні приєднувати і активувати О2, можуть служити каталізаторами реакцій для отримання промислово важливих продуктів, каталізаторами електровідновлення кисню, біологічно активними препаратами, а також використовуватися в системах очищення газів від домішок кисню. Сучасні знання про синтетичні переносники молекулярного кисню — координаційних сполуках перехідних металів з О2 — сформувалися в результаті багатостороннього підходу до вивчення властивостей і будови цих комплексів. Розроблені методи синтезу сполук, вивчалися кінетика і термодинаміка процесів оксигенації, електронна та геометрична структури сполук. Найбільш широко перераховані методи використовувалися для дослідження властивостей і будови комплексів кобальту з О2. В даний час координаційні сполуки з молекулярною киснем відомі для всіх 3d – перехідних металів у низьких ступенях окислення [3, 6].
Координація молекули кисню у внутрішній сфері іона металу супроводжується перенесенням електронної щільності з центрального іона на О2, що в деяких випадках призводить до внутрішньомолекулярної окислювально-відновної реакції, в результаті чого координована частка О2 набуває властивостей супероксид- або пероксид- іона. Тому становлять інтерес окислювально-відновні потенціали в ряду іонів 3d-перехідних металів. Стандартний окислювально-відновний потенціал М3+ / 2+х × (М3+ + е = Ме2+) змінюється в ряду від титану до міді (дані для нікелю відсутні) наступним чином: 0,37 (Ti), 0,256 (V), 0,41 (Сr), 1,51 (Мn), 0,771 (Fe), 1,808 (Со), 0,337 (Сu). Сполуки іонів металів в ступені окислення два начала ряду мають нижчі окислювально-відновні потенціали і, як відомо, дуже легко окислюються молекулярним киснем. Водночас метали(II) другої половини ряду погано або абсолютно не окислюються киснем. На перебіг окислювально-відновних процесів між О2 та іонами металів(II) середини 3d-перехідного ряду впливає природа лігандів внутрішньої координаційної сфери, в першу чергу азотовмісних. Відновлення координованої молекули кисню до пероксид- або супероксид- іона часто забезпечує її оборотне зв'язування комплексом металу. Дійсно, в даний час найбільша кількість координаційних сполук з молекулярним киснем отримана для іонів Со(II), Fe(II) і Мn(II) [3].
Штучні переносники кисню — це хімічні сполуки, що використовуються для збільшення обсягу кисню в крові. Прикладами таких переносників можуть бути перфторкарбонати (PFCs), переносники на основі гемоглобіну (LEHs). Штучні переносники кисню можуть бути використані, коли:
– справжня кров недоступна,
– є ризик зараження інфекцією,
– немає часу на те, щоб перевірити сумісність крові донора і реципієнта.
Однак, ці продукти використовуються мало, вони постійно вдосконалюються, вимагають проводити більше наукових досліджень і клінічних випробувань.
Кисневі сполуки металів, що оборотно приєднують кисень, можуть служити моделями природних носіїв молекулярного кисню: гемоглобіну, гемерітріну, гемоціаніну та ін. Синтетичні носії молекулярного кисню представляють і безсумнівно технічний інтерес:
– є потенційною робочою речовиною для одержання кисню з атмосфери в м'яких умовах;
– можуть служити каталізаторами в гомогенно-каталітичних окисно-відновних реакціях (так як при координації молекулярного кисню відбувається його активація);
– використовуватися для підвищення ефективності роботи позитивного електрода в паливних елементах;
– для глибокого очищення рідин і газів від кисню, служити антиоксидантами [2].
З відомих нині комплексів, що оборотно зв'язують молекулярний кисень, більшу частину становлять комплексні сполуки кобальту з різними лігандами: шіффово підставами, амінами, амінокислотами, порфиринами та ін. Особливий інтерес представляють змішанолігандні дикісневі комплекси, що містять у внутрішній сфері поряд з π-акцепторними лігандами типу 1,10-фенантролін, фрагменти білків амінокислоти або пептиди. Такі комплекси за типом організації аналогічні природним переносникам О2, які як відомо, мають високу ефективність [3].
2.1 Сполуки кобальту(II)
Особливе становище серед металів першого перехідного періоду за здатністю утворювати координаційні сполуки з О2 займає кобальт. Більшість відомих у даний час координаційних сполук 3d-перехідних металів з О2 складають сполуки кобальту із співвідношенням Со:О2 = 2:1 і 1:1. У цьому розділі розглядаються основні типи координаційних сполук кобальту з О2.
Відомо кілька різновидів лігандів, які, координуючись з Со(II), створюють умови для оборотного утворення комплексів з О2: підстави Шиффа, порфіріни, аміни, макроциклічні аміни, поліаміни, амінокислоти, комплексони, пептиди, поліпептиди. Розгляд основних типів координаційних сполук кобальту з О2 показує , що у більшості з них координаційне число дорівнює шести. Іон кобальту в оксигенованих комплексах пов'язаний з лігандами головним чином через атоми азоту (як правило, не менше трьох) і кисню. Отримані переносники кисню різнолігандногу складу: іон амінокислоти — імідазол, іон амінокислоти — нуклеотид, іон амінокислоти або дипептид — гетероциклічний амін, комплекси з сірозмістуючими підставами Шиффа та ін.
Комплекси з О2 вивчені у водних і неводних розчинах. У водних та інших полярних розчинниках з високою діелектричною проникністю утворюються
переважно двоядерні оксигеновані комплекси, що мають більш полярний зв'язок метал-молекула кисню, ніж одноядерні. Одноядерні оксигеновані
комплекси менш стійкі, ніж двоядерні. Виділенню одноядерних комплексів сприяють мала діелектрична проникність середовища, висока концентрація
кисню, низька температура і значні перешкоди на шляху димеризації. Більшість одноядерних оксигенованих комплексів кобальту утворюється в
наведених розчинниках. До складу внутрішньої координаційної сфери їх входять підстави Шиффа або порфіріни. Ліганди — порфіріни різних
типів — представляють істотний інтерес для отримання оксигенованих комплексів, так як це найбільш близькі моделі гема в природних переносниках
кисню. Вивчено різні фізико-хімічні властивості комплексів кобальту з порфиринами: термодинаміка і кінетика зв'язування кисню, вплив стереохімії
порфирина і аксіального ліганду на здатність зв'язувати кисень. Показано, що зазначені комплекси швидко реагують з киснем і дають з'єднання
Со:О2 = 1:1 при низьких температурах. При підвищенні температури до кімнатної відбувається необоротне окислення Со(II) і виходять не здатні
до оксигенації порфіринові комплекси Со(III). Синтез комплексів кобальту зі стерично частокольними
порфиринами — перспективний шлях поліпшення
властивостей цих синтетичних переносників кисню. Більшість сполук Со(II) з порфиринами розчиняються і реагують з О2 в наведених розчинниках,
причому в полярних апротонних розчинниках утворюються більш міцні кисневі продукти, ніж в розчині толуолу. Координаційні сполуки Со(II) з
підставами Шиффа є першими синтетичними переносниками кисню [5, 7, 8, 9].
Таким чином, іони 3d-перехідних металів у низьких ступенях окислення утворюють координаційні сполуки, здатні оборотно реагувати з О2. Ця властивість залежить від природи лігандів, внутрішньої координаційної сфери іонів металів. До складу найближчого оточення іона металу входять переважно атоми азоту, а також атоми кисню, фосфору, іноді сірки. Відомі одноядерні (М:О2 = 1:1) і двоядерні (М:О2 = 2:1) координаційні сполуки 3d-перехідних металів з О2. Останні частіше зустрічаються у металів кінця ряду.
Більшість синтетичних переносників кисню являє собою координаційні сполуки Со(II). На їх основі отримані найбільш ефективні переносники О2 в твердому стані (координаційні сполуки Со(II) з підставами Шиффа) і в розчинах (комплекси кобальту з гістидином, іоном амінокислоти і гетероциклічними підставами, поліазамакроциклічними лігандами) [1]. У загальному вигляді утворення дикисневих комплексів кобальту може бути передано наступною схемою (заряди іонів опущені) (рисунок 2.1):

Рисунок 2.1 — Механізм утворення дикисневих комплексів
(анімація: 10 кадрів, 7 повторень, 9 кілобайт)
Рівняння (1) відповідає освіті моноядерного дикисневого комплексу. Якщо при цьому не створені сприятливі умови, які стабілізують моноядерний дикисневий комплекс, то він перетворюється на біядерний комплекс (рівняння (2)).
До стабілізуючих чинників, які запобігають утворенню біядерних комплексів, відносяться: застосування донорних розчинників з низькою діелектричною константою; просторові чинники, які ускладнюють димеризацію комплексу, низька температура розчину, низька концентрація комплексу; застосування в якості як лігандів макромолекул, які знижують можливість утворення О2-містка між двома центральними іонами кобальту(II). У водних розчинах освіти дикисневих комплексів практично завжди призводить до утворення біядерних комплексів [3].
2.2 Дослідження змішанолігандних систем кобальту
Початок досліджень процесу утворення змішанолігандних оксигенованих комплексів кобальту(II) було покладено в 1980 р. роботою, в якій розглянута оксигенація гліцінатофенантролінового комплексу кобальту(II).
Потім пішли дослідження процесу оксигенації комплексів кобальту(II) з дипіридилом, фенантроліном і аніонами інших α-амінокислот (аланіну, аміномасляної, норваліну, норлейціну, валіну, лейцину і ізолейцину). При дослідженні цих комплексів вперше були зроблені спроби математичного моделювання процесів утворення біядерних бімостікових комплексів. Була складена схема основних рівноваг процесу оксигенації комплексів кобальту(II), що містять у внутрішній координаційній сфері два бідентатних ліганда і дві молекули води [2] (рисунок 2.2):
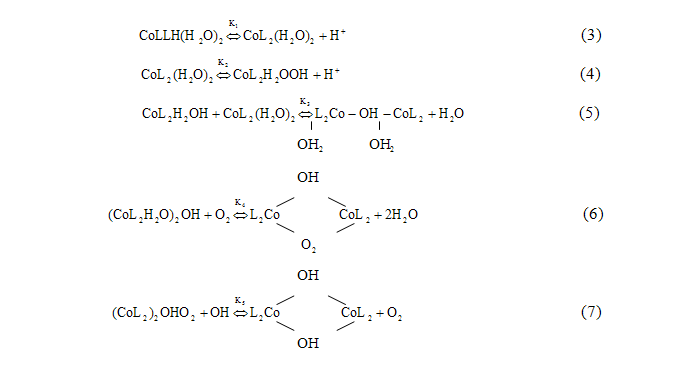
Рисунок 2.2 — Схема основних рівноваг процесу оксигенації комплексів кобальту(II)
2,2'-дипіридил був синтезований в кінці 19-го століття Блау. Молекула 2,2'-дипіридилу (Dipy) представлена на рисунку 2.3:
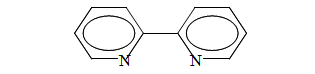
Рисунок 2.3 — Молекула 2,2’-дипіридилу (Dipy)
Завдяки наявності у складі молекули дипіридилу двох атомів азоту вони в процесі утворення комплексів з іонами металів виступають як бідентатні ліганди. Причому, разом з донорними властивостями, дипіридил, як ліганд, володіє значними акцепторними властивостями.
Дипептиди — це сполуки, які складаються з двох залишків амінокислот, з'єднаних один з одним пептидним зв'язком. У водному розчині дипептиди існують у вигляді цвіттер-іонів, в яких депротоновані карбоксильная група і протонована аміно-група (рисунок 2.4):
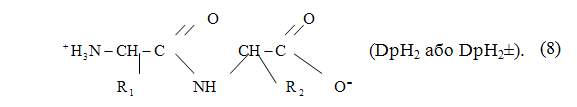
Рисунок 2.4 — Молекула дипептиду
За допомогою рН-потенціометричних досліджень в інертної атмосфері було встановлено, що у водних розчинах суміші монодіпіріділового комплексу кобальту(II) [CoAA(H2O)4]2+ і дипептидів відбувається утворення змішанолігандних діаміндипептидних комплексів [11].
Калориметрично встановлено, що дипептиди утворюють змішанолігандні комплекси з монодіаміновими комплексами кобальту(II) тільки після депротонування NH3+ -групи дипептида. Таким чином, в досліджених системах встановлюється наступна рівновага (рисунок 2.5):

Рисунок 2.5 — Рівновага у системі кобальт(II)-дипептид
Для дослідження змішанолігандної системи кобальт(II)-аланілаланін-дипіридил-кисень використовуються рівняння хімічних реакцій, отримані при дослідженні однорідних систем. Сюди входять реакції процесу комплексоутворення в системі кобальт(II)-аланілаланін (7 реакцій), кобальт-дипіридил (10 реакцій), кобальт-аланілаланін-дипіридил (4 реакції), останні 11 реакцій схеми — це реакції оборотного приєднання молекулярного кисню однорідними дипіріділовимі і аланілаланіловимі комплексами кобальту, а також змішанолігандними комплексами кобальту [2].
3. Проведення експерименту
Для дослідження процесу комплексоутворення та оксигенації в системі кобальт(II)-аланілаланін-дипіридил-кисень був застосований рН-потенціометричний метод. рН-метрично встановлювався склад комплексів, які утворюються в розчині, як в інертній атмосфері, так і в атмосфері повітря. У процесі проведення експерименту проводилося титрування водних розчинів суміші солі кобальту(II), дипіридилу і аланілаланіну (з аланілового ряду дипептидів), при мольному співвідношенні 1:1:1 і 1:1:2, при іонній силі 0,1 (KNO3), t = 25°C, в інертної атмосфері і атмосфері повітря.
Схема установки для проведення рН-потенціометрічніх досліджень представлена на рисунці 3.1.

Рисунок 3.1 — Схема установки для проведения рН-потенціометричних досліджень
Як реєструючий прилад використовувався мілівольтметр типу рН-121. Налагодження рН-метра проводилося з використанням стандартних буферних розчинів зі значенням рН 1,68, 4,01, 6,86, 9,18. Основна похибка вимірювання мілівольтметра типу рН-121 становить ± 0,05. Як електрод порівняння використовувався хлорідсрібний електрод типу ЕВЛ-1МЗ. Індикаторним електродом служив скляний електрод типу ЕСЛ-43-07. Реакційний осередок (5) з розчином термостатується водою, яка надходить з термостата (8) за допомогою насоса, що працює від двигуна (9) потужністю 80 Вт, по гумових шлангах. Температура в осередку підтримується постійною і дорівнює 25°С і контролюється двома лабораторними термометрами (6) встановленими на термостаті і в комірці. Для підтримки постійної температури на термостат був встановлений контактний термометр (7), нагрівання проводиться двома тенами потужністю 200 і 400 Вт, відведення надлишку тепла виробляється водопровідною водою через вбудований в термостат трубчастий теплообмінник. Перемішування здійснювалося барботажем газу або магнітною мішалкою (4).
При проведенні досліджень рН-потенціометрично в інертній атмосфері в реакційний осередок (5) подається інертний газ з балона (10), який містить аргон ОЧ. При проведенні рН-потенціометричних досліджень в атмосфері повітря, повітря подається компресором (13), проходячи очищення через хлоркальцієву трубку з аскарид (12) і осушувач (14) [10].
4. Результати дослідження
Під час дослідження була складена система рівнянь для змішанолігандної системи Со(II)-Alaala-dipy- O2, проведено рН-потенціометричне дослідження суміші монодипіріділового комплексу кобальту(ІІ) і аланілаланіну лугом в атмосфері повітря, дані дослідження наведені в таблицях 4.1 і 4.2.
Таблиця 4.1 — Дані рН-метричного титрування лугом розчину суміші солі кобальту(II), аланілаланіну і дипіридилу (мольне співвідношення 1:1:1) в атмосфері кисню, при t = 25°С, μ = 0,1 (KNO3), [O2] = 2,5 × × 10-4моль/дм3
| Вихідний склад суміші | |
| Со(ІІ):Alaala:dipy = 1:1:1 | |
| VКОН, мл | рН |
| 0,05 | 7,23 ± 0,051 |
| 0,09 | 7,38 ± 0,052 |
| 0,11 | 7,47 ± 0,050 |
| 0,14 | 7,54 ± 0,061 |
| 0,17 | 7,60 ± 0,050 |
| 0,21 | 7,65 ± 0,053 |
| 0,28 | 7,74 ± 0,052 |
| 0,35 | 7,81 ± 0,064 |
Таблиця 4.2 — Дані рН-метричного титрування лугом розчину суміші солі кобальту(II), аланілаланіну і дипіридилу (мольне співвідношення 1:2:1) в атмосфері кисню, при t = 25°С, μ = 0,1 (KNO3), [O2] = 2,5 × × 10-4моль/дм3
| Вихідний склад суміші | |
| Со(ІІ):Alaala:dipy = 1:2:1 | |
| VКОН, мл | рН |
| 0,07 | 7,09 ± 0,052 |
| 0,14 | 7,25 ± 0,052 |
| 0,20 | 7,35 ± 0,059 |
| 0,26 | 7,42 ± 0,058 |
| 0,33 | 7,49 ± 0,062 |
| 0,41 | 7,55 ± 0,059 |
| 0,47 | 7,60 ± 0,060 |
| 0,54 | 7,66 ± 0,051 |
Загальна схема рівноваг процесу комплексоутворення та оксигенації в змішанолігандній системі кобальт(II)-аланілаланін-дипіридил-кисень в атмосфері повітря включає 32 реакції.
Необхідне подальше вивчення властивостей отриманих в системі Co(II)-Alaala-dipy-O2 оксігенованних біядерних комплексів кобальту, з метою визначення оптимальних умов їх утворення для подальшого застосування як синтетичних переносників кисню.
Висновок
Під час проведення роботи був розглянутий процес утворення і оксигенації комплексів кобальту в змішанолігандній системі кобальт(ІІ)-дипіридил-аланілаланін. Були визначені значення рН в цій системі в інертній атмосфері і в атмосфері повітря. Надалі планується розрахунок констант рівноваги, побудова кривих розподілу і розрахунок рівноважних концентрацій у досліджуваній системі.
Отримані константи можуть використовуватися як самостійні довідкові величини, а дані про найбільшу концентрацію комплексу при кожному певному рН можуть бути використані для отримання необхідного комплексу — синтетичного переносника кисню.
Перелік посилань
- Братушко, Ю.И. Координационные соединения 3d-nepexoдных металлов с молекулярным кислородом / Ю.И. Братушко. — К.: Наук. Думка, 1987. — 168 с.
- Ганнова Ю.М., Фурман О.В., Катишева В.В. Визначення умов утворення октанованих комплексів в системі кобальт(II)-гліцилаланін-дипіридил // Наукові праці ДонНТУ. Серія: хімії і хімічна технологія. — 2013. — Вип. 2(21) — с.83–91
- Гринберг, А.А. Введение в химию комплексных соединений / А.А. Гринберг. — М.: Химия, 1971. — 371 с.
- Паладе Д.М. Кинетика и механизм образования оксигенированных комплексов кобальта // Коорд. химия. — 1992. — Т. 18, — №7 — С.729–749.
- Паладе Д.М. Определение кобальта в его комплексных соединениях // Ж. аналит. химии. — 1966. — Т.21. — С.377–378.
- Паладе Д.М., Линькова B.C. Чудаева Г. В. Оксигенация бисдипиридилового комплека кобальта(II) // Ж. Неорган. химии. — 1982. — Т.27, — № 9. — С. 2311–2315.
- Скурлатов Ю.И., Пурмаль А.П. Связывание О2 комплексами Со2+ с 2,2'-дипиридилом. — № 1474 — 70 Деп.: М. — 1969. — 19 с.
- Скурлатов Ю.И., Пурмаль А.П. Связывание О2 комплексами Со2+ с 2,2'-дипиридилом // Ж.физ.химии. — 1970. — Т.44. — С. 1364–1372.
- Эйхгорн, Г. Неорганическая биохимия / Г. Эйхгорн. — М.: Мир, 1978. — 737с.
- Ганнова Ю.Н., Шаповалов В.В., Фурман Е.В. Оксигенация в смешаннолегандной системе кобальт(II)-фенантролин-аланилаланин // Наукові праці ДонНТУ. Серія: хімії і хімічна технологія. — 2011. — Вип. 2(18) — с.15–21
- Краткая химическая энциклопедия. — М.: Советская энциклопедия, 1964 — Т.З. — 903 с.
