Реферат за темою випускної роботи
Зміст
- Вступ
- 1. Актуальність, мета та задачі дослідження та заплановані результати
- 2. Полігони Донецька
- 3. Фільтрат полігонів ТПВ
- 4. Очистка фільтрату полігонів ТПВ
- 5. Фізико-хімічні основи процесу адсорбції
- 6. Активація мінеральних сорбентів
- 7. Методика експерименту
- 7.1 Сорбційна здатність активованого глауконіту відносно іону амонію
- 7.2 Сорбційна здатність активованого глауконіту відносно фенолу
- Висновки
- Перелік посилань
Вступ
Однією з найбільш гострих екологічних проблем в Донецькій області є проблема поводження з відходами. Накопичені в області у великих кількостях відходи негативно впливають на навколишнє природне середовище. Площа земель, відведена під відходи, наближається до 2% загальної території області [1].
Через відсутність заводів з переробки відходів, що використовуються як вторинна сировина, та знешкодження токсичних відходів, небезпечні відходи зберігаються під відкритим небом на спеціальних полігонах, що не завжди відповідає екологічним вимогам. Інтенсивне утворення і складування небезпечних відходів негативно впливає на навколишнє природне середовище, сприяє активізації екзогенних геологічних процесів, зміні фізико-механічних властивостей і складу ґрунтів [1].
1. Актуальність, мета та задачі дослідження та заплановані результати
В даний час э необхідність розробки і впровадження екологічно та економічно безпечних технологій та обладнання для знешкодження і переробки величезної кількості побутових і промислових відходів, а також їх похідних — фільтрату та біогазу, що утворюються в результаті розкладання відходів.
Вплив фільтрату на поверхневі і, в більшій, мірі на підземні води, є основним чинником негативного впливу полігону.
Мета: пошук методу, що забезпечує ефективність очищення фільтрату ТПВ з урахуванням різних супутніх факторів, а саме: потужності полігону та вимог до показників очищеного фільтрату.
Для дослідження можливостей застосування природного сорбенту щодо очищення фільтрату поставлені наступні задачі:
1 — розглянути утворення фільтрату на полігонах ТПВ, описати найбільш оптимальний спосіб очищення;
2 — дослідити експериментально сорбційну активність хімічномодіфікованного глауконіту за стандартними методиками та визначити сорбційні властивості.
2. Полігони Донецька
Полігони (точніше, звалища — в нинішньому їх вигляді) твердих побутових відходів (ТПВ) значно погіршують навколишнє природне середовище.
Полігон є спеціальною спорудою, призначеною для централізованого складування (ізоляції) ТПВ. Умови його функціонування покликані забезпечити надійність в питаннях охорони довкілля та санітарно-епідеміологічної безпеки для населення [2]. У таблиці 2.1 приведено характеристику полігонів ТПВ м. Донецьк.
Таблиця 2.1 — Характеристики полігонів ТПВ м. Донецьк
| Полігон | Скільки років діє | Середньоріч. приймання ТПВ (т) | Площа робочого тіла, га | Глибина, м (серед.) |
| Ларінський | з 1993 р. | 135000 | 20 | 15 |
| Чулковський | з 1979 р. | 40000 | 3,1 | 6 |
| Петровський | з 1972 р. | 44000 | 3,5 | 10 |
Експлуатація полігонів ведеться без урахування сучасних екологічних вимог, таких як наявність дренажної системи для відведення фільтрату і ізолюючого екрану. До того ж існуючі полігони або давно вже виробили свій нормативний термін і ТПВ звозять на них через відсутність будь-якої альтернативи, або ж ресурс полігонів практично вичерпаний [3].
У таблиці 2.2 наведено зміст неорганічних і органічних сполук в підземних водах в районі полігонів ТПВ м. Донецьк.
Таблиця 2.2 — Зміст неорганічних і органічних сполук в підземних водах в районі полігонів ТПВ м. Донецьк, мг/дм3 [4]
| Компоненти (речовини і іони) | NH4 | Феноли | Нафтопродукти |
| ПДК | 2,0 | 0,1 | 0,3 |
| Петровський | 1,8 | 0,01 | 0,1 |
| Ларинський | 1,9 | 0,01 | 0,1 |
| Чулковський | 2,6 | 0,01 | 0,15 |
Закон України Про відходи
регламентуючи повноваження місцевої державної адміністрації, зобов’язує в ст. 20 Організовувати збір і видалення побутових та інших відходів, створювати полігони для їх захоронення, здійснювати роздільний збір корисних компонентів...
[5]. Якщо проаналізувати кількість ТПВ, що щорічно вивозяться з різних міст, в млн. м3, то лідером тут є Донецька (4,9), Дніпропетровська (3,56) області, та м. Київ (4,3). Всього ж показник вивезених за рік відходів по Україні становить 49,79 млн. м3 при населенні 46,9 млн. [3].
В Україні за найсміливішими підрахунками полігонами можна вважати не більше 10% звалищ [3, 5]. Як відомо звалище це важке випробування для навколишнього середовища і населення прилеглих районів, воно отруює своїм існуванням ґрунт, поверхневі і підземні джерела, повітря, вбиває флору і фауну. Також є джерелом важких інфекційних захворювань, які переносяться мухами, комарами, гризунами. Протягом експлуатації полігонів виділяється так званий фільтрат — рідка коричнево-бура складова ТПВ з різко вираженим гнильним запахом [6].
3. Фільтрат полігонів ТПВ
Ефективних технологій очищення та утилізації фільтрату на данний час не існує. Основними джерелами утворення фільтрату в тілі полігону є [3]:
а) вихідна вологість окремих компонентів;
б) атмосферна волога;
в) волога, що утворюється в результаті біохімічних процесів в тілі полігонів ТПВ.
Фільтраційні води відрізняються нерівномірністю накопичення протягом року за рахунок сезонності атмосферних опадів. На практиці прийнято розрізняти так званий молодий
і старий
фільтрат. Молодий
утворюється на перших етапах розкладання відходів, триває до 5–10 років, характеризується середнім значенням рН і високим значенням БПК, іноді до 40000мг2/дм3. Старий фільтрат утворюється в основному на постексплуатаційним етапі життєдіяльності полігону і характеризується БПК близько 200–400 мгO2/дм3 [5,7]. Основними джерелами утворення фільтрату є продукти анаеробного розкладання ТПВ, проникнення атмосферних опадів. Тому доцільно, щоб уникнути останнього чинника і розповсюдження хвороботворних мікроорганізмів за допомогою різних представників фауни використовувати на пунктах збору сміття закриті пластикові різнокольорові контейнери з написами на кожному з них скло
, папір
, і т.п. [5,7].
4. Очистка фільтрату полігонів ТПВ
Хімічний склад фільтрату в основному залежить від морфологічного складу ТПВ і часу перебування в тілі полігону. Аналіз складу фільтрату свідчить про широке різноманітті хімічних елементів і їх концентрацій [5]. При дослідженні хімічного складу фільтратів полігонів твердих побутових відходів визначаються тільки звичайні, передбачені нормативними документами, компоненти стічних вод [8].
Тому, склад фільтрату є визначальним фактором при виборі схеми очищення, як правило, виділяють фізико-хімічну, біологічну очистку чи їх комбінацію [5].
Наприклад, використання сорбційної очистки ефективно при очищенні нізкоконцентрованих фільтраційних вод та доочистка доочистка на будь-якому етапі життєдіяльності полігону ТПВ[9].
Отже, існує багато методів, серед яких ефективнішим є сорбційний метод. В якості сорбенту звичайно використовують активоване вугілля, але вартість очищення дуже велика. Останім часом все більше поширюються не вуглецеві природні сорбенти, серед яких значне місце займає глауконіт. Ефективність практичного використання глауконіту в якості сорбційного матеріалу залежить від його пористої структури, питомої поверхні, форми та розміру зерен, а також інших структурно-геометричних характеристик, сукупність яких називають текстурою сорбенту [10].
З кожним роком розширюється коло науково-технічних завдань, пов’язаних з використанням адсорбційних процесів [11].
Адсорбційне розділення та очистка речовин досить давно застосовується в різноманітних галузях хімічної, нафтохімічної, газової, фармацевтичної та харчової промисловості [12].
На території України розташовані одні з найбільших в світі покладів нерудних копалин. Важливе місце в їх структурі займають природні адсорбенти і каталізатори — алюмосилікатні сполуки, які зосереджені у більш ніж сорока родовищах. Ці речовини у природному стані або після найпростішої обробки (подрібнення, сушка тощо) придатні для очищення, розділення багатокомпонентних сумішей, змінювання іонного складу рідин [13].
До сорбційних матеріалів існує низка вимог, а саме [14]:
а) висока сорбційна здатність;
б) висока швидкість вилучення речовини;
в) висока стійкість у водних середовищах (хімічна, механічна, радіаційна);
г) доступність, простота синтезу, оптимальна вартість.
Зокрема, перспективним є застосування як адсорбентів природних дисперсних сорбентів, що обґрунтовується низкою переваг, а саме [15,16]:
- Природні сорбенти широко розповсюджені в Україні.
- Природні сорбенти є доступним, недорогим матеріалом.
- Адсорбційні технології з використанням природних дисперсних сорбентів забезпечують високий ступінь очищення.
- Відпрацьований природний адсорбент не потребує регенерації.
Разом з тим природні дисперсні сорбенти мають цінні властивості, серед яких — розвинута питома поверхня, високі адсорбційні та іонообмінні властивості, що і обумовлює їх широке застосування в промисловості та в сільському господарстві [16].
Дослідження показали, що для всіх типів сорбентів адсорбція проходить як за механізмом фізичної сорбції молекул, так і за механізмом іонного обміну [15, 17].
Оскільки розчинники сорбуються на природних дисперсних сорбентах переважно за механізмом фізичної сорбції, доцільно застосовувати природні дисперсні сорбенти з великими вхідними вікнами
адсорбційного простору, здатними адсорбувати великі молекули розчинників [15].
Останнім часом значну увагу дослідників привертають адсорбційні методи очищення газових та рідинних середовищ від забруднювачів, зокрема із застосуванням природних дисперсних сорбентів — глауконітів [16].
Застосування глауконіту дозволяє видалити із забруднених вод радіоактивні ізотопи (на 65–98%), важкі метали Cu2+, Ni2+, Fe3+, Pb3+, Sb3+ (94,8–100%), Cr3+, As3+ (33,6–33,8%), ефективно очищувати промислові стоки також від завислих речовин, поверхнево-активних речовин, гербіцидів, пестицидів, фенолів, текстильних барвників тощо. Ще однією особливістю застосування глауконіту є його пролонгована дія та максимально низький відсоток десорбції (2–8%), тобто відпадає потреба в утилізації продукту очищення [18].
5. Фізико-хімічні основи процесу адсорбції
Термодинамічна система, що складається з двох та більше фаз, називається гетерогенною. У гетерогенній системі фази відокремлені один від одного поверхнями розділу. Поблизу поверхні фізико-хімічні властивості фази відрізняються від властивостей в обсязі фази. Так енергія молекул на поверхні відрізняється від енергії молекул в глибині фази. Це пов’язано з тим, що зв’язки молекул, що знаходяться в поверхневому шарі ненасичені. Характер руху молекул на поверхні буде іншим, ніж у середині твердого тіла. Внаслідок цього концентрація розчиненої речовини на поверхні фази відрізнятиметься від концентрації розчиненої речовини в глибині фази. Таке явище отримало назву поверхневого згущення компонента [19]. Поверхневе згущення компонента, що припадає на одиницю площі поверхні фази, називається адсорбцією:
nповik = Гik
де nповik — поверхневе згущення i-го компонента на k-ій поверхні;
Г — адсорбція i-го компонента на k-ій поверхні.
Тверде тіло, на поверхні якого відбувається адсорбція, тобто концентрування газу або пари, називається адсорбентом, а речовина, що поглинається з об’ємної фази — адсорбатом [19,20].
Залежність рівноважної величини індивідуальної адсорбції речовини (цільового компонента) при постійній температурі від його вмісту в об’ємній фазі називають ізотермою адсорбції. Підтримка постійної температури забезпечується легше, ніж підтримка постійного вмісту в будь-який з фаз. Тому експериментальний матеріал по адсорбції зазвичай отримують у вигляді ізотерм. Вони ж часто є первинним об’єктом теоретичного аналізу. На рисунку 5.1 наведено типові ізотерми адсорбції. З рисунка видно, що величина адсорбції (Х) зростає в міру збільшення концентрації (С) (парціального тиску, Р) адсорбата і убуває з ростом температури (Т) [21].
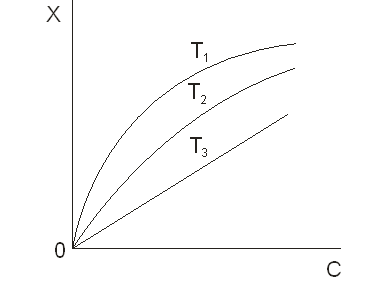
Рисунок 5.1 — Ізотерми адсорбції за умовою T1 <T2 <T3
Теоретична інтерпретація ізотерм, наведених на рисунку 5.1, для адсорбції на плоскій поверхні адсорбенту вперше була виконана американським фізиком Ленгмюром і по його імені ізотерми такого типу, які показані на малюнку, стали називати ленгмюровскими. Рівняння Ленгмюра записується так [21]:
X = XmbC/(1 + bC),
де Xm — гранична величина адсорбції;
b — коефіцієнт, що має сенс константи рівноваги.
6. Активація мінеральних сорбентів
З точки зору екології природні сорбенти розглядаються не тільки як дуже доступні і дешеві матеріали, здатні ефективно зв’язувати і нейтралізувати різні забруднювачі, але і як екологічно чиста, не забруднююча навколишнє середовище сировина [22].
Важливою властивістю порід є можливість поліпшення їх якості шляхом застосування різних методів активації і модифікування. Це дає можливість створювати нові матеріали із заданими фізико-хімічними і технологічними властивостями стосовно до вирішення конкретних завдань.
Активація і модифікування неорганічних природних сорбентів проводиться з метою спрямованої зміни їх властивостей. Існує ряд ефективних методів хімічного та фізичного модифікування поверхні і регулювання пористості сорбентів.
Фізичні способи активації сорбентів зводяться до обробки зразків у млинах, впливу вакууму (вакуумна сушка), високого тиску і температури (гідротермальна обробка), ультразвукових коливань, радіації та струму високої частоти. Хімічні способи активації сорбентів полягають у впливі на зразки хімічних реагентів. Залежно від хімічного реагенту розрізняють кислотну, лужну, сольову і комбіновану активацію. В якості реагентів використовуються [22]:
- Мінеральні кислоти — сірчана, соляна, фосфорна.
- Органічні кислоти — щавлева, оцтова.
- Луги — їдкий натрій, їдкий калій, вуглекислий натрій, гідрат окису кальцію та інші.
- Легко розчинні у воді солі. У цьому випадку, як правило, відбувається обмінна реакція між катіонами розчинної у воді солі і катіонами, що входять до складу поглинаючого комплексу природного сорбенту, в результаті чого утворюються монокатіонзміщені форми сорбенту.
- Важко розчиняємі у воді солі, наприклад вуглекислий кальцій. У даному випадку після обробки зразок прожарюють при заданій температурі.
- Органічні речовини — аміни, аміди. При цьому отримують специфічні форми органофільних сорбентів.
- Водорозчинні полімерні речовини.
Відомі ефективні методи хімічного та фізичного модифікування поверхні природних мінеральних сорбентів які проводять з метою регулювання їх адсорбційної і катіонообмінної здібності. Однак багато з цих методів найчастіше призводять до отримання суперечливих і непорівнянних результатів.
Тому в даній роботі були експериментально використані традиційні методи хімічної активації, мінерального сорбенту глауконіту, — кислотний і лужний в режимі кипіння і в режимі просочення.
Обробка природних сорбентів мінеральними кислотами — один з найважливіших способів отримання високоякісних активованих адсорбентів, що застосовуються в різних галузях народного господарства [22].
Згідно з існуючими уявленнями, при декатіонуванні глинястих мінералів, яке починається з отримання водневої форми, відбувається розрив зв’язку Si–O–Al в суміжних тетраедрах, в результаті чого утворюються групи ОН, пов’язані з атомом кремнію, і трикоординовані атоми алюмінію, а також бренстедовський центр [22]. Схема кислотної активації представлена на рисунку 6.1.
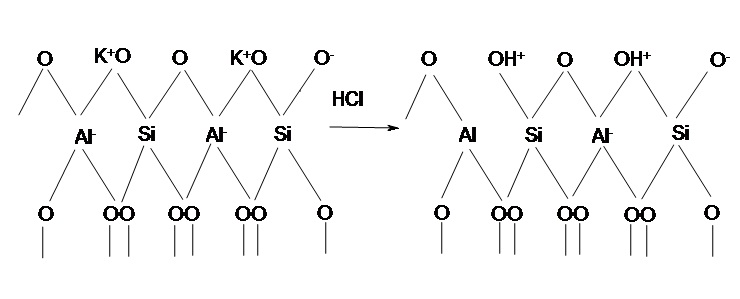
Рисунок 6.1 — Схема кислотної активації глауконіту
На поверхні ультрамікрочастинок знаходяться силанольні групи у вигляді частково катіонної і протонованої форми. Отже, механізм кислотної активації представлено на рисунку 6.2.
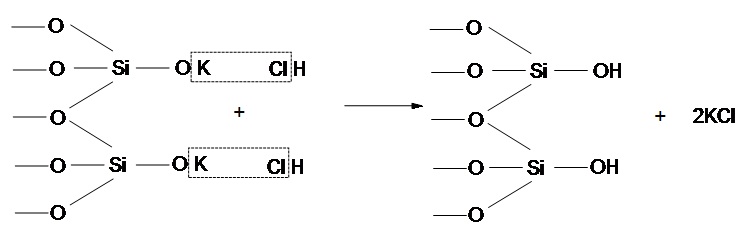
Рисунок 6.2 — Механізм кислотної активації
При активації кременистих з’єднань лугом задіяні силанольні групи, перебуваючі у водневій формі, і місце водневого протона займає іон Na+. Механізм лужної активації представлено на рисунку 6.3.
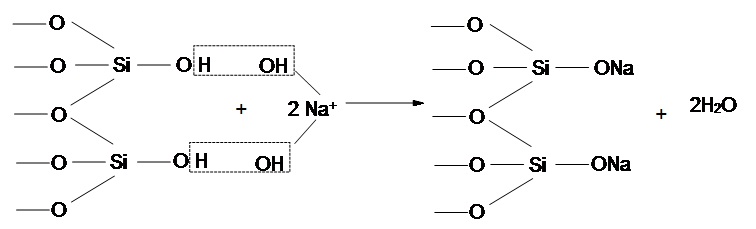
Рисунок 6.3 — Механізм лужної активації
Активація природних сорбентів проводиться з метою спрямованої зміни їх властивостей.
7. Методика експерименту
Хімічна активація глауконіту у режимі кипіння проведена за наступною методикою:
- дослідний зразок очищали від сторонніх включень (механічних домішок), подрібнювали до однорідного фракційного складу;
- додавали соляну кислоту або розчин гідроксиду натрію в об’ємному співвідношенні 1:10 (тверда фаза : розчин), ретельно перемішували;
- активацію проводили на протязі 30 хв. та 1 годину, для частини зразків проводили промивку дистильованою водою в об’ємному співвідношенні 1:5 (суспензія: дистилят).
Хімічна активація методом просочування проводиться згідно [23].
Активовані сорбенти висушувалися в нормальних умовах.
7.1 Сорбційна здатність активованого глауконіту відносно іону амонію
Визначення вмісту іонів амонію у воді проводили колориметричним методом [24], що ґрунтується на реакції взаємодії іонів NH4+ з лужним розчином іодомеркуріата калію K2[HgI2], так званим реактивом Неслера. В результаті цієї взаємодії утвориться іодістий меркурамоній. Схема реакції зображена на рисунку 7.1.
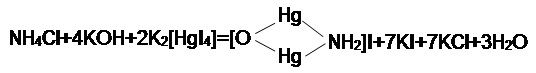
Рисунок 7.1 — Схема реакції
Визначення проводили у присутності подвійної калієво-натрієвої солі винної кислоти для запобігання побічних реакцій між іонами Са2+ і Мg2+, присутніми у воді, з іонами ОН-, що вносяться реактивом Неслера.
Оптичну густину отриманих розчинів визначали за допомогою фотоколориметричного методу (при довжині хвилі — 440 нм, товщина кювети — 30 мм). Вихідний модельній розчин NH4Cl з концентрацією іонів NH4+ 0,1 г/дм3.
Визначення проводять методом порівняння: знаходять оптичні щільності стандартного розчину з відомою концентрацією іонів амонію і досліджуваного розчину з невідомою концентрацією іонів NH4+.
Час контакту адсорбенту з модельним розчином — 20 хвилин, маса наважки сорбенту — 0,5 г.
Таблиця 7.1 — Вплив параметрів хімічної активації на сорбційну здатність глауконіту Амвросіївського родовища
| № зразка | Відомості про спосіб активації | Вихідна концентрація NH4+ мг/дм3 | Залишкова концентрація NH4+ мг/дм3 | Ступінь очищення, % |
| Зразок 1 | не піддавався активації | 0,1 | 0,0152 | 84,84 |
| Зразок 2 | 0,1 Н NaOH просочення / час активації 30 хв. / промитий | 0,1 | 0,0130 | 87,02 |
| Зразок 3 | 0,1 Н NaOH просочення / час активації 30 хв. / не промитий | 0,1 | 0,0150 | 85,02 |
| Зразок 4 | 0,1 Н NaOH просочення / час активації 60 хв. / промитий | 0,1 | 0,0130 | 87,05 |
| Зразок 5 | 0,1 Н NaOH просочення / час активації 60 хв. / не промитий | 0,1 | 0,0111 | 88,88 |
| Зразок 6 | 0,1 Н NaOH кипіння / час активації 60 хв. / промитий | 0,1 | 0,0082 | 91,84 |
| Зразок 7 | 0,1 Н NaOH кипіння / час активації 60 хв. / не промитий | 0,1 | 0,0046 | 95,44 |
| Зразок 8 | HClконц просочення / час активації 60 хв. / промитий | 0,1 | 0,0020 | 98,02 |
| Зразок 9 | HClконц кипіння / час активації 60 хв. / промитий | 0,1 | 0,0019 | 98,11 |
| Зразок 10 | HClконц кипіння / час активації 30 хв. / промитий | 0,1 | 0,0020 | 98,02 |
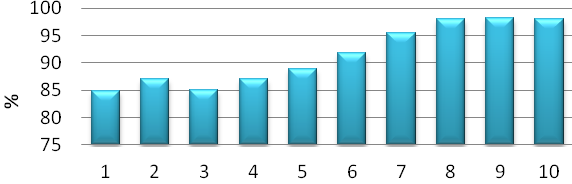
1 — глауконіт природній, 2 — глауконіт активований 0,1 Н NaOH (просочення — 30 хв., промитий), 3 — глауконіт активований 0,1 Н NaOH (просочення — 30 хв., не промитий), 4 — глауконіт активований 0,1 Н NaOH (просочення — 60 хв., промитий), 5 — глауконіт активований 0,1 Н NaOH (просочення — 60 хв., не промитий), 6 — глауконіт активований 0,1 Н NaOH (кипіння — 60 хв., промитий), 7 — глауконіт активований 0,1 Н NaOH (кипіння — 60 хв., не промитий), 8 — глауконіт активований HClконц (просочення —60 хв., промитий), 9 — глауконіт активований HClконц (кипіння — 60 хв., промитий), 10 — глауконіт автивований HClконц (кипіння — 30 хв., не промитий)
Рисунок 7.2 — Гістограма ступеню очищення від іонів амонію
Варто відзначити, що всі хімічно модифіковані зразки проявили збільшення адсорбційної здатності до іонів амонію, відносно неактивованого глауконіту того ж родовища.
Результати модифікації природного сорбенту глауконіту свідчать про те, що модифікація глауконіту двома найбільш розповсюдженими засобами — лужна та кислотна активація глауконіту за різними способами проведення призводить до зміни адсорбційної здатності щодо іонів амонію, аналіз показав, що кращими адсорбційними властивостями відносно іонів амонію володіє хімічно модифікований зразок, який активований за допомогою концентрованої соляної кислоти, що піддавався кипінню з часом активації 60 хв. та промивався (зразок № 9) відносно не активованого глауконіту ступінь очищення зросла на 13,3%. Серед зразків, що піддавалися лужній активації найкращу сорбційну здатність показав зразок, що активований за допомогою 0,1 Н NaOH, що піддавався кипінню з часом активації 60 хв. та не промивався. Ступінь очищення при зіставленні з неактивованим глауконітом зріс на 10,6%.
Таблиця 7.2 — Експериментальні дані визначення сорбції NH4+ зразка № 8
| Маса наважки глауконіту, г | 0,5 | 0,5 | 0,5 | 0,5 | 0,5 | 0,5 |
| Час контакту адсорбенту з розчином, хв. | 10 | 10 | 10 | 10 | 10 | 10 |
| Вихідна концентрація NH4+С1, мг/л | 1 | 2 | 5 | 10 | 20 | 30 |
| Залишкова концентрація NH4+ С2, мг/л | 0,2959 | 0,6939 | 0,9847 | 1,5969 | 2,3010 | 2,8214 |
| Адсорбційна ємність сорбенту Г, мг/г | 0,14 | 0,26 | 0,80 | 1,68 | 3,54 | 5,43 |
| Lg Г | – 0,53 | – 0,16 | – 0,01 | 0,20 | 0,36 | 0,45 |
| Lg Сзал | – 0,85 | – 0,58 | – 0,01 | 0,23 | 0,55 | 0,74 |
Можна припустити, що навіть якщо при витримці мінералу при низьких pH відбувається вихід деякої кількості катіонів з алюмосилікатного шару, сорбовані катіони NH4+ здатні заміщати їх, при цьому встановлюються більш міцні зв’язки між шарами.
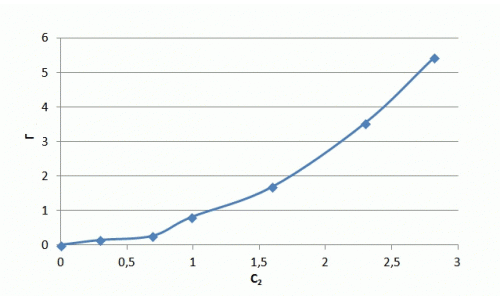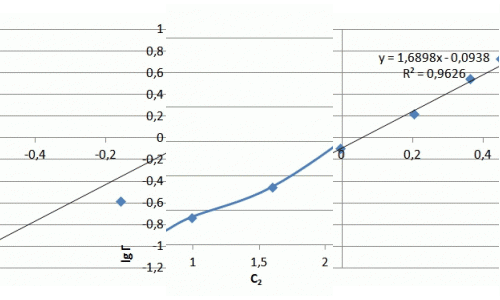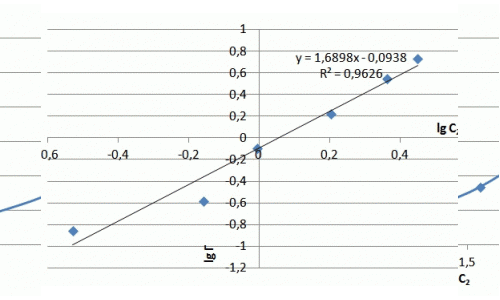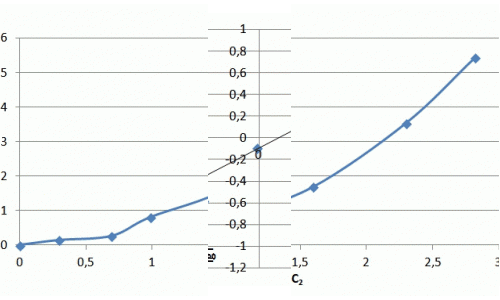
Рисунок 7.3 — Ізотерма адсорбції іонів аміаку в натуральних координатах та в логаріфмічніх координатах
(12 кадрів, 7 циклів тривалістю по 6 секунд, 207 Кб)
Хід ізотерми на початковій ділянці відповідає ізотермі Ленгмюра, проте насичення зразка не відбувається і ізотерма сорбції приймає лінійний характер. Значення сорбції значно перевершують показники насичення для катіонів металів і складають, в даному випадку максимальне значення — 5 мг/м. У літературі зазначається виборча здатність шаруватих силікатів до катіонів великих розмірів, що можна пояснити ситовим ефектом.
Таблиця 7.3 — Експериментальні дані визначення сорбції NH4+ зразка № 8, № 3, № 10
| Номер зразка | Маса наважки, г | Час контакту адсорбенту з розчином, хв. | Вихідна концентрація NH4+, мг/л | Остаточна концентрація NH4+ , мг/л | Ступінь очищення, % |
| Зразок № 8 | 0,5 | 30 | 100 | 6,21 | 93,7 |
| Зразок № 9 | 0,5 | 30 | 100 | 5,09 | 94,9 |
| Зразок № 10 | 0,5 | 30 | 100 | 5,57 | 94,4 |
З отриманих результатів випливає, що сорбція амонію відбувається не тільки на поверхні глауконіту, але і в його порових просторах, де розташовані менш доступні обмінні центри, через що підвищується ступінь очищення розчинів від NH4+. Рівняння Фрейндліха має вигляд: Г = 0,74·С0,53. Отриманий коефіцієнт α = 0,74 свідчить про високі сорбційних властивості.
7.2 Сорбційна здатність активованого глауконіту відносно фенолу
Визначення концентрації фенолу у розчині [25]: залишкову концентрацію фенолу визначали бромід-броматним методом, який полягає у бромуванні фенолу з подальшим визначенням надлишкового брому.
5КВr + КВrО3 + 3Н2SO4 = ЗВr2 +2К2SO4 + ЗН2O.
Надлишковий бром, який не пішов на бромування, визначали йодометричним методом.
Час контакту адсорбенту з модельним розчином — 20 хвилин, маса наважки сорбенту — 1 г.
Таблиця 7.4 — Результати експерименту з активації
| № зразка | Сорбент | Відомості про спосіб активації | Вихідна концентрація, ммоль/дм3 | Залишкова концентрація, ммоль/дм3 | Ступінь очищення, % |
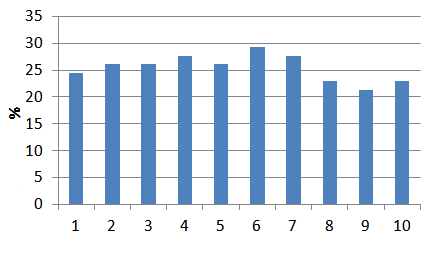
| Зразок 1 | Глауконіт | не піддавався активації | 1,06 | 0,80 | 24,53 |
| Зразок 2 | Глауконіт | 0,1 Н NaOH просочення / час активації 30 хв. / промитий | 1,06 | 0,78 | 26,10 |
| Зразок 3 | Глауконіт | 0,1 Н NaOH просочення / час активації 30 хв. / не промитий | 1,06 | 0,78 | 26,10 |
| Зразок 4 | Глауконіт | 0,1 Н NaOH просочення / час активації 60 хв. / промитий | 1,06 | 0,77 | 27,67 |
| Зразок 5 | Глауконіт | 0,1 Н NaOH просочення / час активації 60 хв. / не промитий | 1,06 | 0,78 | 26,10 |
| Зразок 6 | Глауконіт | 0,1 Н NaOH кипіння / час активації 60 хв. / промитий | 1,06 | 0,75 | 29,25 |
| Зразок 7 | Глауконіт | 0,1 Н NaOH кипіння / час активації 60 хв. / не промитий | 1,06 | 0,77 | 27,67 |
| Зразок 8 | Глауконіт | HClконц просочення / час активації 60 хв. / промитий | 1,06 | 0,82 | 22,96 |
| Зразок 9 | Глауконіт | HClконц кипіння / час активації 60 хв. / промитий | 1,06 | 0,83 | 21,38 |
| Зразок 10 | Глауконіт | HClконц кипіння / час активації 30 хв. / промитий | 1,06 | 0,82 | 22,96 |
Спроба збільшити сорбційну здатність глауконіту за допомогою хімічної активації показала найкращий результат для зразка № 4 — активація 0,1 Н NaOH, кіпіння на протязі 60 хв. промитого, яка дозволила значно (на 4,72%) знизити залишкову концентрацію фенолу у воді, однак хімічна активація соляною кислотою досить серйозно вплинула на сорбційну здатність мінералу — сорбція фенолу, по відношенню до якого глауконіт не володіє вибірковою сорбційною активністю, знизилася на 3,15 та 1,57%.
1 — глауконіт природній, 2 — глауконіт активований 0,1 Н NaOH (просочення — 30 хв., промитий), 3 — глауконіт активований 0,1 Н NaOH (просочення — 30 хв., не промитий), 4 — глауконіт активований 0,1 Н NaOH (просочення — 60 хв., промитий), 5 — глауконіт активований 0,1 Н NaOH (просочення — 60 хв., не промитий), 6 — глауконіт активований 0,1 Н NaOH (кипіння — 60 хв., промитий), 7 — глауконіт активований 0,1 Н NaOH (кипіння — 60 хв., не промитий), 8 — глауконіт активований HClконц (просочення —60 хв., промитий), 9 — глауконіт активований HClконц (кипіння — 60 хв., промитий), 10 — глауконіт автивований HClконц (кипіння — 30 хв., не промитий)
Рисунок 7.4 — Гістограма ступеню очистки від фенолу
Не ефективність кислотної активації можна пояснити тим, що глауконіт в значній мірі нестійкий в кислих і навіть слабокислих середовищах, що супроводжується вимиванням деяких катіонів зі структури й диспергуванням мінералу [26].
Таблиця 7.5 — Експериментальні дані визначення сорбції фенолу зразком № 4
| Вихідна концентрація фенолу Свих, ммоль/дм3 | 1,06 | 2,12 | 4,25 | 6,38 | 8,51 | 10,63 |
| Залишкова концентрація фенолу Сзал, ммоль/дм3 | 0,97 | 1,83 | 3,73 | 5,53 | 7,50 | 9,50 |
| Адсорбційна ємність сорбенту Г, ммоль/г | 0,04 | 0,12 | 0,21 | 0,34 | 0,4 | 0,45 |
| Об’єм фільтрату, см3 | 100 | 50 | 25 | 25 | 10 | 10 |
| Lg Г | –0,01 | 0,26 | 0,57 | 0,74 | 0,88 | 0,98> |
| Lg Сзал | – 1,43 | – 0,93 | – 0,68 | – 0,47 | – 0,39 | – 0,34 |
Рівняння Фрейндліха для фенолу має вигляд: Г = 0,097·С1,11. Отримана ізотерма адсорбції свідчить про наявність макропор та мікропор та про сильну міжмолекулярну взаємодію. Отриманий коефіцієнт α = 0,097 свідчить про низькі сорбційні властивості.
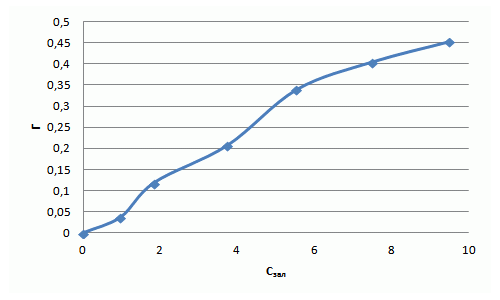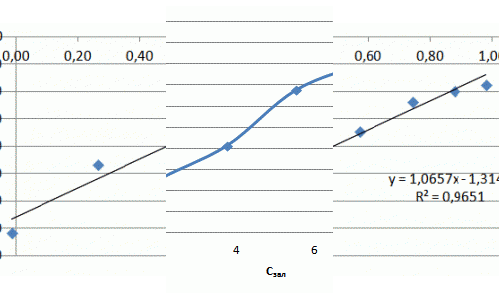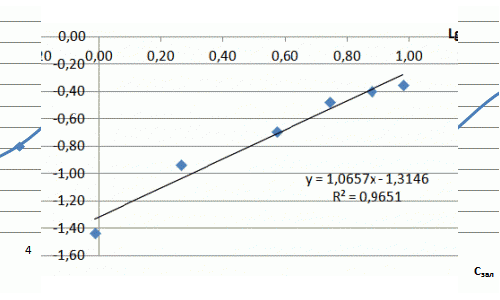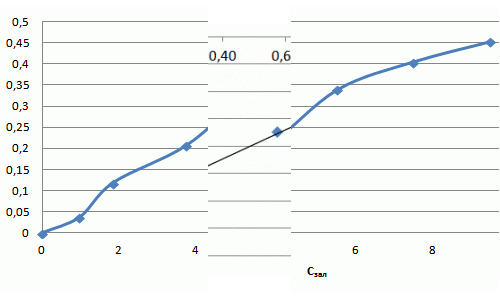
Рисунок 7.5 — Ізотерма адсорбції фенолу в натуральних координатах та в логарифмічних координатах
(12 кадрів, 7 циклів тривалістю по 6 секунд, 114 Кб)
Висновки
За результатами виконаної роботи зроблені наступні висновки:
1 — розглянуто утворення фільтрату на полігонах ТПВ, описанo спосіб сорбційного очищення як найбільш оптимальний;
2 — доведено перспективність та ефективність використання активованих природних сорбентів, зокрема активованого глауконіту, для очищення фільтрату. Його перевагами є: доступність, можливість багаторазового використання без регенерації.
Надалі планується вивчити сорбційну активність модіфікованного глауконита по відношенню до важких металів і барвників.
Перелік посилань
- Величко Н.В. Оценка состояния почвогрунтов в зоне влияния ларинского полигона промышленно-строительных отходов / Н.В. Величко, О.О. Гладкова, Ю.А. Проскурня// Актуальні проблеми геології. Збірник матеріалів Міжвузівської наукової конференції студентів геологічних, екологічних і гірничих спеціальностей 26 квітня 2013 року. — Донецьк: ДонНТУ, 2013. — С. 23–26
- Андоленко С.С. Нормативно-правовое регулирование сферы обращения с отходами в Украине /С.С. Андоленко, И.Н. Ющенко, О.Н. Андрейчук// Наукові праці Донецького національного технічного університету. Серія: Гірничо-геологічна. — Донецьк :ДонНТУ, 2010. —Вип.№12 (173). — С. 184–192
- Солодовник М.В. Особенности очистки сточных вод полигонов твердых бытовых отходов / М.В.Солодовник //Программа и тезисы докладов. Часть I. Строительство, архитектура, экология — Х.: ХНАГХ, 2008. — С. 221–223
- Краснянский, М.Е. Исследование влияния свалок ТБО г. Донецка и г. Макеевки на природную среду/ М.Е. Краснянский, А. Бельгасем // Экология и науч.-техн. прогресс: Матер. 3 междунар. науч.-практ. конф. студ., аспирантов и мол. ученых / — Пермь: Перм. ГТУ, 2005. — С. 247–255.
- Сатин И. В. Сравнительный анализ методов очистки фильтрата / И. В. Сатин, А. С. Трякина// Донбасская национальная академия строительства и архитектуры Сер. Технологія, організація, механізація та геодезичне забезпечення будівництва. Міське будівництво і господарство, 2010. — Вип 3(83). —С. 270–275
- Вилсон Д. Утилизация твердых отходов. Т. 1: Пер. с англ. — М.: Стройиздат, 1985. — 336 с.
- Гриценко А.В. Технологические основы промышленной переработки отходов мегаполиса/ А.В. Гриценко, Н.П. Горох. — Х.: ХНАДУ, 2005. —340 с.
- Щербина Г.П Исследование фильтрационных стоков полигона ТБО для установления возможности утилизации его с использованием фермента класса оксигедаз / Г.П. Щербина// Інформаційно-аналітичний збірник «Санітарна очистка міст та комунальний автотранспорт» К.: Концерн ;Видавничий Дім ;Ін Юре” , 2002. — Вип. 4 . — С. 51–56
- Солодовник М.В. Реагентный метод очистки сточных вод полигоновтвердых бытовых отходов / М.В. Солодовник // Материалы III Международной научно-практической конференции «Вода, экология,общество». — Х.: ХНАГХ, 2010. — С. 176–177
- Литвин Т. С. Визначення сорбційних властивостей глауконіту / Охорона навколишнього середовища та раціональне використання природних ресурсів — 2012 / Т. С. Литвин, Я. М. Зуб, О.А. Трошина Матерiали ХХII Всеукраїнської наукової конференцiї аспiрантiв і студентів. — Донецьк, ДонНТУ, 2012. —Том 1, — С.104–105
- Стеценко, Н. О. Дослідження адсорбції барвних речовин цукрового виробництва природними дисперсними мінералами України / Н. О. Стеценко, О. В. Подобій, О. М. Мірошников, О. В.Грабовська // Магістеріум. Хімічні науки, 2010. — Випуск 40. — С. 37–40.
- Лыгин В.И. Адсорбция из растворов на поверхностях твердых тел /В.И. Лыгин. — М.: Мир, 1986. — 488 с.
- Орлов Л. О. Ефективність використання антиадгезійного покриття форм для виробництва м’ясних хлібів / Л. О. Орлов, В. Л. Яровий, М. Г. Янковий // Матеріали V всеукраїнської науково-практичної конференції «Теорія і практика сучасного природознавства». Секція «Хімічні та біохімічні науки і технології», 24–25 листопала 2011 р, — С 61–64
- Корнілович Б. Еколого-хімічні проблеми видобутку та перероблення уранової сировини / Б. Корнілович, В. Стрелко, Ю. Кошик, В. Павленко //Вісн. НАН України. — 2010. — № 10. — С. 8–14
- Петрушка, І. М. Очищення стічних вод від двокомпонентних органічних забрудників методом рідинної хроматографії. / І. М.Петрушка, О. В.Стокалюк, М. С.Мальований, Я. М.Захарко // Хімія, технологія речовин та їх застосування: [збірник наукових праць]/ — Л.: Видавництво Національного університету «Львівська політехніка», 2007. — С. 250–255
- Доскач Т. М. Дослідження адсорбційної здатності сумішей на основі мінеральних сорбентів / Т. М. Доскач, М. С. Мальований, З. С. Одноріг, А. О. Мараховська, О. М. Піх //Хімія, технологія речовин та їх застосування: [збірник наукових праць] — Львів: Видавництво Національного університету "Львівська політехніка", 2011. — С.266–269.
- Мальований М. Очищення питної води від іонів амонію адсорбцію на природних сорбентах / М. Мальований, Г. Сакалова, А. Мараховська, Н. Чорномаз. // Захист навколишнього середовища. Енергоощадність. Збалансоване природокористування : збірник матеріалів I міжнародного конгресу, Львів, 28–29 червня 2009 р. —Л.: Видавництво Національного університету "Львівська політехніка" 2009, — C. 55
- Василінич Т. М. Очищення стічних вод шкіряного виробництва від іонів хрому / Т. М. Василінич // Вісник Хмельницького національного університу. Серія: Технічні науки — № 1. — С. 228–231.
- Воюцкий С. С. Курс коллоидной химии / С. С. Воюцкий. — М.: Химия,1976. — 512 с.
- Фридрихсберг Д. А. Курс коллоидной химии / Д. А. Фридрихсберг. — Л.: Химия, 1995. — 400 с
- Шумяцкий, Ю.И. Адсорбционные процессы. Учебное пособие / Ю.И. Шумяцкий. — М.: РХТУ им. Д.И.Менделеева, 2005. —164 с.
- Лыгина Т.З. Технологии химической активации неорганических природных минеральных сорбентов: монография/ Т.З.Лыгина, О.А. Михайлова, А.И. Хацринов, Т.П. Конюхова, Казань: Изд-во Казан. гос. технол. ун-та, 2009. —120 с.
- Бовсуновський Є.О. Вплив параметрів кислотної активації суглинку темно-бурого на його сорбційні властивості щодо іонів хрому (ІІІ)/ Є.О. Бовсуновський, О.В. Рябчевський, Ю.Я. Годовська, О.Г. Личманенко// Вісник НАУ. — Х:НАУ —2012. № 4 — С. 123–125
- Воды минеральные питьевые лечебные, лечебно-столовые и природные столовые. Метод определения ионов аммония : ГОСТ 23268. 10–78 [действующий от 01.01.74 ]. — М. : ИПК Издательство стандартов, 2010. — 6 с. — (Межгосударственный стандарт).
- Вигдорович В.И. Извлечение фенола из водных растворов глауконитом / В.И. Вигдорович, Л.Е. Цыганкова, Д.В. Николенко, А.И. Акулов //Сорбционные и хроматографические процессы. — 2010. — Т. 10. —№ 4. — С. 505–511
- Ю.И. Особенности структуры и сорбционно-обменные свойства глауконита Багарякского месторождени / Ю.И. Сухарев, А.Е. Черногорова, Е.А. Кувыкинаи//Известия Челябинского Научного Центра. Серия химия и химическая технология —Челябинск, 1999. —№4. —С. 64–69
