РЕФЕРАТ
Зміст
Вступ
У вітчизняній гальваностегії для очищення стічної води застосовують реагентний метод. Забруднюючі речовини видаляються з води за допомогою вапняного молока у вигляді малорозчинних сполук. Очищення від зважених речовин, які утворюються після осадження важких металів гідроксидом кальцію, здійснюється в прес-фільтрі, тонкошарових відстійниках, прояснювачах [1].
Завислі речовини, вилучені з очищеної води, являють собою гальванічний шлам. Переважно шлам не знаходить широкого застосування, тому ліквідується в шламосховищах, підлягає захороненню на спеціально відведених територіях.
Високий вміст в шламі нікелю, хрому, цинку, міді означає, що на сучасному рівні розвитку промисловості, а також при інтенсивному впровадженні ресурсозберігаючих технологій гальванічний шлам не може розглядатися як відхід. Його потрібно розглядати як вторинну сировину.
Сучасний розвиток технологій на Україні в основному передбачає використання гальванічного шламу в якості інертного наповнювача в будівельних матеріалах.
Дана робота присвячена розгляду можливих способів вилучення цінних металів зі шламу, які можуть бути використані у якості вторинної сировини для виробничого процесу. Основним завданням був аналіз можливості селективного вилучення органічними речовинами різних металів з гальванічного шламу.
1 МЕТА, ЗАВДАННЯ, ОБ'ЄКТ ДОСЛІДЖЕННЯ
Об'єктом
дослідницької роботи був гальванічний шлам цеху санітарно-технічної арматури
ПАТ АЗОКМ
. Даний відхід утворюється при очищенні стічних вод, які
надходять від ванн нанесення нікелевого, хромового покриття, а також з ванн для
знежирення, декапірування і промивки поверхні виробів. Метою роботи було
визначення можливості переробки шламу для розділення суміші гідроксидів металів
і виділення очищених оксидів цих металів з можливістю їх подальшого
використання в гальваностегії в якості сировини.
Були поставлені наступні завдання:
- вивчення складу і властивостей гальванічного шламу;
- дослідження можливості вилучення металів з гальванічного шламу;
- вибір і обґрунтування методу переробки гальванічного шламу.
2 НЕГАТИВНИЙ ВПЛИВ ШЛАМУ НА НАВКОЛИШНЄ СЕРЕДОВИЩЕ
Для очищення води від іонів металів їх осаджують за допомогою гідроксиду кальцію. При цьому утворюються нерозчинні речовини, які знаходяться у воді в завислому стані. При їх видаленні з води за допомогою фільтрування утворюється гальванічний шлам. У більшості випадків він не знаходить широкого застосування ні у виробництві, ні в інших сферах промисловості, тому захоронюється в шламосховищах або підлягає захороненню на спеціально відведених територіях.
Гальванічний шлам (рис. 1) має III клас небезпеки, негорючий. У його складі містяться гідроксиди важких металів, а сам шлам проявляє лужні властивості.
Рисунок 1 — Складування гальванічного шламу на відкритій місцевості
Переробка такого виду
промислових відходів є актуальним завданням на сьогоднішній день. В даний
час на підприємствах Донецької області ПрАТ ДОНЕЦЬКСТАЛЬ
— Металургійний
завод, ПАТ Новокраматорський машинобудівний завод
, Сніжнянський
машинобудівний завод ПАТ Мотор Січ
, ПАТ Донецький завод Продмаш
у
виробництві для захисту поверхні виробів активно використовується
гальваностегія. При очищенні стічної води, яка утворюється в процесі нанесення
покриття за допомогою гальваностегії, утворюється гальванічний шлам.
Використання методів переробки шламу дозволить звільнити площі, які використовуються під шламосховища, знизити негативний вплив відходів на навколишнє середовище, а також підвищити рівень ресурсозбереження на підприємстві внаслідок використання вторинних ресурсів, які можуть бути отримані з гальванічних шламів.
3 СКЛАД І ВЛАСТИВОСТІ ГАЛЬВАНІЧНОГО ШЛАМУ
Шлам являє собою пастоподібну масу темно зеленого кольору (рис. 2, a) нерозчинну у воді з великим вмістом вологи. рН шламу коливається від 6 до 9. Для визначення вмісту вологи наважку шламу висушили у сушильній шафі при температурі 100–110 о С протягом 2 годин. Після просушування в сушильній шафі шлам має характерний для гідроксиду хрому зелений колір, розсипчасту структуру (рис. 2, b).
a — вихідний шлам; b — шлам після просушування в сушильній шафі
Рисунок 2 — Зразок гальванічного шламу
Після прожарювання в печі при температурі 600 оС протягом години гідроксиди металів переходять в оксиди і колір шламу переходить в коричневий.
Для визначення хімічного складу досліджуваного гальванічного шламу наважку масою 15,2 г розчинили в сірчаній кислоті з концентрацією 15 % мас. При цьому гідроксиди металів, які містяться в шламі, перейшли в водорозчинні сульфати. Частина шламу не розчинилася в кислоті, нерозчинні речовини видалили за допомогою фільтрування. В отриманому фільтраті об’ємом 1 дм3 визначили концентрацію хрому, нікелю, міді. Визначення концентрації хрому і нікелю проводили фотометричним методом за допомогою фотоколориметру КФК–2 МП. Визначення вмісту міді проводили йодометричним методом [2]. Аналіз шламу показав наступні результати:
- вміст вологи 65,4 %;
- вміст Cr(OH)3 6,2 %;
- вміст Ni(OH)2 1,24 %;
- вміст Fe(OH)3 3,8 %;
- вміст Cu(OH)2 1,77 %;
- нерозчинні в кислоті речовини 14,9 %.
Методом інфрачервоної спектроскопії встановлено наявність сульфат-іонів у вихідному шламі. Характерні піки поглинання для іонів SO42- складають: 1105, 983, 611, 450 см-1. На рисунку 3 представлений ІЧ спектр шламу, відмитого дистильованою водою і висушеного при температурі 110 оС, в якому вміст сульфат-іонів значно нижче, а також ІЧ спектр вихідного шламу.
a — відмитий шлам; b — вихідний шлам
Рисунок 3 — ІЧ спектр гальванічного шламу
Наявність іонів SO42-, напевне, зумовлена вмістом малорозчинної сполуки CaSO4, яка утворюється при осадженні важких металів.
4 МЕТОДИ ВИЛУЧЕННЯ МЕТАЛІВ З ШЛАМУ
4.1 Кислотно-лужне виділення металів
Для виділення металів з шламу можна використовувати залежність виділення нерозчинних сполук (гідроксидів, карбонатів) від рН розчину [3]. Для цього спочатку шлам переводять в розчинну форму за допомогою розчину сірчаної кислоти. При цьому основний склад гальванічного шламу — гідроксиди металів — переходять у сульфати.
З очищеного від нерозчинних сполук (глина, пісок) розчину сульфатів металів проводять осадження гідроксидів шляхом обробки Са(ОН)2 і доведення pH до певного для кожного металу значення. Послідовний ряд осадження гідроксидів металів з початково кислого розчину наведено в таблиці 1 [3]. Початок осадження металів відповідає вихідній концентрації осаджуваного іона 0,01 моль/дм3, повне осадження — концентрації іона металу 10-5 моль/дм3.
| Катіон | Значення рН | |
| початок осадження | повне осадження | |
| Залізо Fe3+ | 7,5 | 9,7 |
| Залізо Fe2+ | 2,3 | 4,1 |
| Цинк Zn2+ | 6,4 | 8,0 |
| Хром Cr3+ | 4,9 | 6,8 |
| Нікель Ni2+ | 7,7 | 9,5 |
| Алюміній Al3+ | 4,0 | 5,2 |
| Кадмій Cd2+ | 8,2 | 9,7 |
Як видно з табл. 1, теоретично можливе роздільне осадження гідроксидів заліза, нікелю, цинку, хрому, оскільки значення рН початку їх осадження та повного осадження не накладаються один на одне.
4.2 Екстракція органічними речовинами
Рідинна екстракція органічними розчинниками застосовується в технології рідкісних, кольорових і благородних металів, в хімічному аналізі. Особливе значення в процесі екстракції має екологічна безпека технологічних процесів. Високі вимоги до властивостей екстрагентів виключають застосування пожежонебезпечних, токсичних і високолетких розчинників. Одним із шляхів вирішення даної проблеми є використання легкоплавких органічних сполук в якості екстрагентів.
Особливий інтерес в
плані практичної реалізації представляють екстракційні системи водний розчин —
розплав органічної речовини
. Особливістю даного типу екстракції є
існування органічної фази в рідкому стані тільки при підвищених
температурах. Після екстракції та охолодження екстракційної судини до
кімнатної температури утворюється застигла компактна маса розплаву, яку легко
відокремити від водної фази і зберігати досить довгий час.
В якості легкоплавких органічних реагентів широко застосовуються 8-оксихінолін, саліцілальдоксім, бензоілацетон, дібензоілметан, нафтол, аліфатичні карбонові кислоти [4].
Екстракція носить катіонообмінний характер, має явну залежність від активності іонів водню у водній фазі. Сіль металу з аніоном органічної кислоти, яка утворюється при екстракції, має підвищену розчинність в органічній рідині або в надлишку карбонової кислоти. Виходячи з низької здатності до гідратації солей, нетоксичності та пожежної безпеки в якості екстрагента була обрана стеаринова кислота - одноосновна карбонова кислота аліфатичного ряду [5–6].
При утворенні хелатної структури мила (солей жирних кислот) відбувається обмін кислотного водню карбоксильної групи карбонової кислоти на іон металу згідно з реакцією [8]:
2C17H35COOH + Me2+ → (C17H35COO)2Me + 2H+ .
Схема обміну катіона водню на катіон металу в молекулі карбонової кислоти в просторі представлена на рисунку 4.
Рисунок 4 — Екстракція нікелю (II) стеариновою кислотою
(Анімація, 14 кадрів, 164 КБ, 5 циклів)
Кислотність водного розчину є одним з основних факторів, які значно впливають на селективність процесу вилучення іонів металів. Природа металу і застосовуваного екстрагента також визначає інтервал значень рН, в якому метал витягується повністю.
5 ЕКСПЕРИМЕНТАЛЬНА ЧАСТИНА
Для визначення можливості селективного виділення металів з гальванічного шламу провели розчинення його наважки масою 15,4 г в розчині сірчаної кислоти. Отриманий розчин розбавили до 1 дм3 і відокремили нерозчинені частинки.
5.1 Кислотно-лужне розділення металів
Для визначення можливості розділення гідроксидів металів зазначеним способом змінювали рН середовища за допомогою 1 Н розчину КОН. Досліджували можливість розділення при наступних значеннях: рН = 3, рН = 4,5, рН = 8,5. Встановлено, що при значеннях рН = 3 і рН = 4,5 виділення іонів нікелю (II) та хрому (III) в осад становить 5 % і 10 % відповідно. При рН = 8,5 в осад виділяється 85 % хрому (III) і 100 % нікелю (II).
З отриманих даних з’ясували, що селективне виділення металів з розчинів у вигляді гідроксидів при розглянутих значеннях рН середовища неможливе, оскільки одночасно відбувається осадження практично всіх металів.
5.2 Селективна екстракція стеариновою кислотою
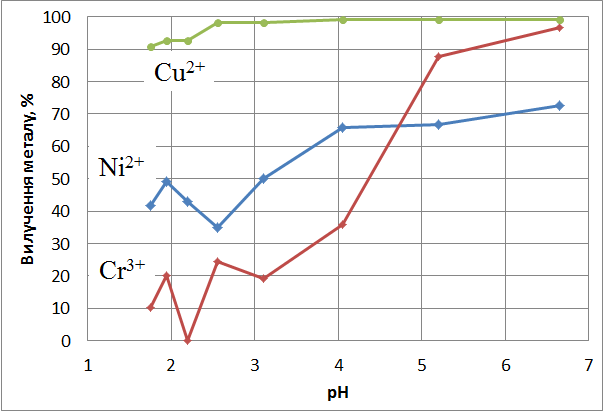
В якості екстрагента в поставленому експерименті була використана стеаринова кислота. Метою дослідження було визначення можливості селективного виділення нікелю та хрому з розчину шляхом варіювання рівня рН. Концентрація нікелю в розчині складала 0,120 г/дм3; хрому 0,475 г/дм3; співвідношення об’ємів фаз фільтрат : екстрагент = 3 : 1. Екстракцію вели при температурі 70–90 оС. У діапазонах рН = 1,75–2,2 і рН = 3,0–4,0 значення різниці кількості витягнутого нікелю та хрому було максимальним (рис. 5).
Рисунок 5 — Залежність ступеня вилучення металів розплавом стеаринової кислоти від рН
Кількість витягнутого з розчину хрому склала 0–10 % при рН = 1,75–2,2 і 20–35 % при рН = 3,0–4,0. Кількість витягнутого нікелю при рН = 1,75–2,2 склала 40–45 % і при рН = 3,0–4,0 склала 50–65 %.
Таким чином, розділення металів в їх розчині можливе з використанням екстрагентів при варіюванні рН середовища. Стеаринова кислота як екстрагент проявляє селективні властивості відносно даних металів при різних значеннях рН.
ВИсновки
При виконанні роботи були отримані наступні результати і зроблені наступні висновки:
- встановлено хімічний склад
гальванічного шламу, який утворюється на ПАТ
АЗОКМ
, оцінено негативний вплив таких видів відходів на навколишнє середовище та здоров’я людей; - зроблено висновок, що ліквідаційні методи знешкодження шламу не є раціональними і безпечними для навколишнього середовища, тому що неможливо усунути контакт відходу з атмосферним повітрям і поверхневими водами при ліквідації шламу в шламосховищах;
- показано, що питання поводження з відходами гальванічних виробництв залишається актуальним і пов'язаний з вибором методу їх переробки в товарні продукти з найменшими економічними витратами;
- для дослідження складу і властивостей гальванічного шламу були обрані методи вилучення металів за значенням рН середовища і за допомогою органічного екстрагента;
- показано, що при збільшенні рН середовища спостерігалося спільне осадження гідроксидів металів в діапазоні рН = 4,5–8,5, що означає неможливість використання методу для розділення металів;
- знайдено, що роздільне виділення металів з їх розчину можливе з використанням екстрагента при варіюванні рН середовища. Доведено, що стеаринова кислота як екстрагент проявляє селективні властивості відносно нікелю та міді, що може дозволити витягувати метали необхідної чистоти з шламу.
перелік посилань
- Ситтиг, М. Извлечение металлов из неогранических соединений и отходов: Пер. с англ. / М. Ситтиг. — М.: Металлургия, 1985. — 408 с.
- Лурье, Ю.Ю. Аналитическая химия промышленных сточных вод / Ю.Ю. Лурье. — М.: Химия, 1984. — 448 с.
- Родионов, А.И. Техника защиты окружающей среды: Учебник для вузов / А.И. Родионов, В.Н. Клушин, Н.С. Торочешников. — М.: Химия, 1989. — 512 с.
- Салыкбаева А.С.,
Исаева С.Х. Экстракция ионов никеля (II) расплавом стеариновой кислоты //
НАУКА И ОБРАЗОВАНИЕ — 2011
/ Матеріали VII міжнародної наукової конференції молодих вчених. — Астана: Євразійський національний університет імені Л.Н. Гумільова, 2011, с.: 372–376. - Патент 2100465 Рос. Федерация: C22B34/32, C22B3/26, C01G37. Способ экстракции хрома (III) из водных растворов / Воропанова Л.А., Величко Л.Н., Амбалова Ф.В., Хугаева М.Р. Заявитель и патентообладатель Воропанова Лидия Алексеевна. — Заявл. 22.05.1996; Опубл. 27.12.1997. — 3 с.
- Патент 2221882 Рос. Федерация: C22B3/26, C22B23:00. Способ экстракции кобальта из водных растворов / Воропанова Л.А., Дударникова В.Д. Заявитель и патентообладатель Воропанова Лидия Алексеевна. — №2002111626/02; Заявл. 30.04.2002; Опубл. 20.01.2004. — 2 с.
- Иваненко, Е.И. Переработка отходов гальванического производства / Е.И. Иваненко, С.В. Фроленкова — К.: КПИ, 2012. — 4 с.
- Меркин, Е.Н. Экстракция металлов некоторыми органическими катионообменными реагентами / Е.Н. Меркин. — М.: Цветметинформация, 1968. — 35 с.