Реферат за темою випускної роботи
Зміст
- Вступ
- 1. Актуальність теми
- 2. Мета і задачі дослідження та заплановані результати
- 3. Огляд літературних джерел
- 3.1 Отримання кисню з пероксидних сполук
- 3.2 Пероксид натрію Na2O2
- 3.3 Реакції пероксиду натрію і супероксиду натрію з оксидами
- 3.4 Перхлорати
- Висновки
- Перелік посилань
Вступ
Важко уявити собі область існування або практичної діяльності людини без споживання кисню. Провідними компаніями, що займаються виробництвом кисню, проводяться інтенсивні пошуки нових способів одержання О2, кількість яких наближається до двадцяти [1]
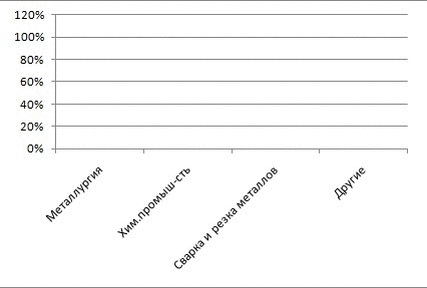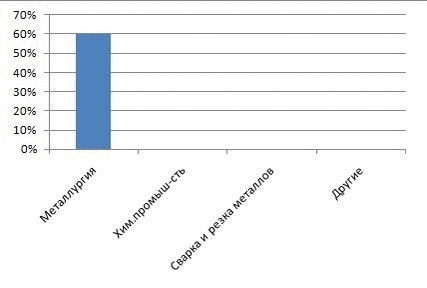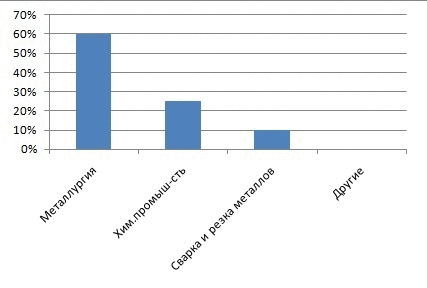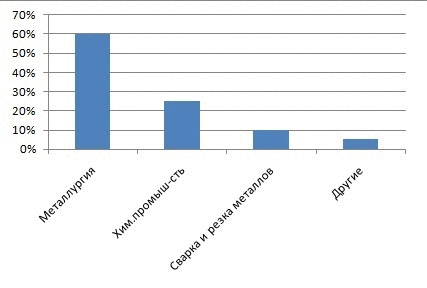
Рисунок 1 – Частка кисню на різні види промисловості
(анімація: 5 кадрів, постійно повторюється 72,5 кб)
Головними споживачами кисню, звичайно, є енергетика, металургія і хімічна промисловість. Електричні і теплові станції, які працюють на вугіллі, нафті або природному газі використовують атмосферний кисень для спалювання палива. Для металургійної та хімічної промисловості потрібен вже не атмосферний, а чистий кисень. Щорічно в усьому світі отримують понад 80 млн. тонн кисню. Для його виробництва потрібно величезна кількість електроенергії, отримання якої, теж пов'язано з витрачанням кисню. Чистий кисень витрачається головним чином на отримання сталі з чавуну і брухту [1].Кисневе (а не повітряне) дуття в домнах дозволяє істотно підвищувати швидкість доменного процесу, заощаджувати кокс і одержувати чавун кращої якості. Кисневе дуття застосовують у кисневих конвертерах при переділі чавуна в сталь. Чистий кисень чи повітря, збагачене киснем, використовується при одержанні і багатьох інших металів (міді, нікелю, свинцю й ін). Кисень використовують при різанні і зварюванні металів. При цьому застосовують балонний
кисень. У балоні кисень може знаходитися під тиском до 15 МПа[2].Балони з киснем пофарбовані в блакитний колір. Застосування кисню для вирішення екологічних проблем, пов'язаних з очищенням стічних вод і з знищенням небезпечних відходів.
Відомо більше десяти способів одержання О2. При цьому виділяються дві групи процесів: класичні, відкриті до початку ХХ століття, і нові, що розробляються з шістдесятих років (табл. 1).
| Класичні | |
|---|---|
| 1. Термічне розкладання 2. Електроліз води 3. Каталітичне розкладання пероксиду водню | 4. Гідроліз перекисних сполук 5. Термохімічне виділення з повітря 6. Кріогенне виділення з повітря |
| Нові | |
| 7. Термохімічне розкладання составів 8. Абсорбція з повітря розчинниками 9. Адсорбційне виділення з повітря 10. Виділення з повітря в мембранних апаратах 11. Електрохімічне виділення з повітря | 12. Розкладання води в термохімічної циклі 13. Магнітне виділення з повітря 14. Фотохімічне розкладання води 15. Радіоліз води 16. Бездротове розкладання води 17. Резонансне розкладання води |
1. Актуальність теми
На сьогоднішній день, на думку більшості експертів, теоретичних і технологічних революційних змін у класичних способах отримання кисню в найближчому майбутньому не передбачається. Тому нові методи отримання кисню здобувають все більшу актуальність. Особливе значення має спосіб отримання кисню методом термохімічного розкладу спеціально розроблених твердофазних хімічних композицій. Кисень-в хімічно зв'язаному стані дозволяє створити системи поєднують переваги як балонного зберігання: простоту, високу надійність, постійну готовність до роботи, відсутність втрат, так і зберігання при кріогенних параметрах: високі питомі і об'ємні характеристики. Для реалізації переваг хімічні джерела О2 повинні задовольняти ряду основних, часом суперечливих вимог: легкість отримання О2; стійкість при зберіганні; висока чистота одержуваного кисню; безпека і надійність в експлуатації; виділення великої кількості кисню з одиниці об'єму хімічного джерела кисню. Цим вимогам задовольняють дві групи речовин: хлорати та перхлорати лужних і лужноземельних металів; пероксиди, супероксиды і озоніди металів.
2. Мета і задачі дослідження та заплановані результати
Метою дослідження є отримання кисню шляхом каталітичного розкладання хлорату натрію і вибору ефективного каталізатора.
В роботі поставлені наступні завдання:
- Провести аналіз літературних даних за властивостями хлорати та перхлорати лужних та лужноземельних металів.
- Провести аналіз літературних даних за властивостями пероксидних сполук на питомий вміст кисню, здатності утворювати стійкі супероксид.
- Проаналізувати взаємодію пероксидних сполук натрію з хлоратами і перхлорату металів.
- Дослідити ефективність використання реакцій простих речовин з пероксидними сполуками натрію.
3. Огляд літературних джерел
3.1 Отримання кисню з пероксидних сполук
Інтерес до пероксидних сполук продиктований двома обставинами: різноманіттям видів, які набуває кисень, з'єднуючись з різними елементами при утворенні того чи іншого пероксидного з'єднання, і можливістю використання цього різноманіття в усіх випадках, коли необхідно мати джерело хімічно зв'язаного і легко виділяється О2.
З пероксидних сполук за питомою змістом кисню найбільший інтерес представляють пероксиди літію, натрію, кальцію і магнію. Разом з тим, за вмістом кисню в одиниці об'єму вони, в цілому, поступаються пероксидам важких металів (Sr, Ba, Zn, Cd). Лужні метали (окрім літію) здатні утворювати стійкі, на відміну від важких металів, супероксиди. Найкращими характеристиками, як видно, має супероксид натрію.
3.2 Пероксид натрію Na2O2
Пероксид натрію Na2O2 – одне з пероксидних сполук натрію, що характеризується наявністю молекулярного іона O22–; вміст активного кисню становить 20,5 вага %. Чистий пероксид натрію – білий порошок; технічний порошок має слабожовтого забарвлення, обумовлену домішкою надпероксида натрію NaO2. Решітка Na2O2 гексагональна (перекручена); щільність 2,60. Існує в трьох модифікаціях: Q – Na2O2, стійка при температурі рідкого повітря, Na2O2 (I), стійка до 512±10С і Na2O2 (II), стійка вище цієї температури. Пероксид натрію диомагнитен.

Рисунок 2 – Пероксид натрію
При нагріванні пероксиду натрію при 311-4000С спостерігається деяка втрата активного кисню, бурхливий розкладання починається при 5400С. Плавиться пероксид натрію вище 5960С і повністю віддає свій активний кисень при 6750С. Розчиняється у воді. При цьому утворюються NaOH, H2O2 і виділяється деяка кількість кисню, т. к. лужне середовище і підвищена температура сприяють розкладанню H2O2. З розведеними кислотами пероксид натрію реагує з утворенням відповідних солей і пероксиду водню. Енергійно реагує з киснем, сіркою, натрієм, моно - і діоксиду вуглецю. Відомі молекулярні сполуки пероксиду натрію з водою (октагидрат Na2O2x8H2O), з пероксидом водню (дипероксигидрат Na2O2x2H2O2) і з водою і пероксидом водню (тетрагидрат дипероксигидрата Na2O2х2H2O2х4H2O). З вологою і вуглекислим газом повітря пероксид натрію реагує з утворенням NaOH, Na2CO3 і з виділенням кисню. На цьому засновано його застосування для регенерації повітря в зачинених приміщеннях[4].
Пероксид натрію отримують окисленням розплавленого на деках металевого натрію в протитоку очищеного від CO2 і висушеного повітря або форсуночных апаратах. Для отримання високоякісного пероксиду натрію рекомендується відновлювати пероксид натрію, отриманий окисленням металу, до окису шляхом нагрівання при 130-2000C З невеликими порціями металевого натрію в інертній атмосфері, зволоженою парами води, а отриманий таким чином окислювати оксид до пероксиду в обертових печах при 250-4000С. Отриманий продукт містить 96-98 % Na2O2. Оскільки пероксид натрію досить агресивний по відношенню до металів, при його отриманні користуються зазвичай реакторами з нікелевих сплавів, покритих графітом, і мішалками з цирконію.
В герметично закритій тарі пероксид натрію не схильний до розкладання навіть при тривалому зберіганні. Судини з пероксидом натрію слід зберігати в прохолодному місці, далеко від легкозаймистих матеріалів. Сам по собі пероксид натрію не запалюється, але горюча при зіткненні з органічними речовинами, наприклад деревом, оливою, папером або відновниками в присутності вологи [5].
Застосування пероксиду натрію в останніх випадках засноване на процес взаємодії між пероксидом і двоокисом вуглецю:
Видихуване легкими вуглекислий газ поглинається з одночасним виділенням газоподібного кисню. Останній знову може служити для дихання [3] .
3.3 Реакції пероксиду натрію і супероксиду натрію з оксидами
Взаємодія пероксидних сполук натрію з оксидами представляє інтерес, принаймні, з двох причин. По-перше, Na2O2 і NaO2 є найбільш поширеними після KO2 компонентами сумішей, що використовуються для регенерації повітря в замкнених об'ємах або ізолюючих дихальних апаратах . Теоретично 1 кг Na2O2 здатний виділити 143 л О2 і поглинути 287 л СО2, а NaO2 відповідно 305 л О2 і 203 л СО2 . Цим обумовлений інтерес до реакцій взаємодії пероксидних сполук з Н2О, водяною парою і іншими газоподібними оксидами – СО, NO, NO2, SO22O2 здатний взаємодіяти з погано розчинними оксидами, переводячи їх у розчинний стан, що полегшує їх визначення.
За М. Хармелену, характер взаємодії конденсованих оксидів елементів з Na2O2 може бути зведений до чотирьох видів реакцій.
- Пероксид натрію реагує як оксид з утворенням солі і виділенням кисню, який в реакції не бере участь.
- Na2O2 реагує з оксидом металу, переводячи його в інший оксид, в якому метал знаходиться в більш високому валентном стані. При цьому кисень не виділяється і пероксид відновлюється до оксиду.
- Пероксид натрію реагує з оксидом металу, переводячи його в більш високе валентний стан і утворюючи з ним з'єднання. У цьому випадку, як і в попередньому, кисень не виділяється.
- Реакція між оксидом металу та пероксидом натрію проходить за участю кисню повітря за рівнянням [6]:
х Na2O2 + MOn + y O2 = Na2xMOn+2x+2y, х Na2O2 + MOn + y O2 = MOn+x+2y + Na2O.
3.4 Перхлорати
Перхлорати — солі або ефіри хлорної кислоти. Солі металів, неметалів, гідразину, гідроксиламіну та амонію відносяться до неорганічних похідним хлорної кислоти, а ефіри і солі органічних сполук — органічних похідних хлорної кислоти.
Вперше перхлорат калію був відкритий в 1816 р. в Німеччині віденським ученим Стадіоном, який розплавив в реторті невелику кількість хлорату калію і обережно додав у неї трохи сірчаної кислоти. Він виявив, що після виділення діоксиду хлору залишок являє собою суміш сульфату калію і важкорозчинної солі, яку він ідентифікував як перхлорат калію. Займаючись вивченням нової солі Стадіон приготував хлорну кислоту електролізом.
У 1830 р. Серулля повідомив про розробку нового методу отримання хлорної кислоти, розкладанням хлорноватої кислоти. У 1831 р. Серулля описав ще один метод перетворення хлорату калію перхлорат. Одночасно з вивченням хлорної кислоти Серулля приготував перхлорат амонію і перхлораты ряду металів. Заслугою Серулля можна вважати також популяризацію терміна «перхлорат», замість вживалася Стадіоном та іншими дослідниками з 1816 по 1831 рр. терміна оксихлорат
.
У 1886 р. Бекуртс вперше повідомив про присутність перхлоратів у природних покладах нітратів в Чилі. У зв'язку з цим пошкодження посівів зернових в Бельгії, де застосовували в якості добрив чилійську селітру, були пояснені дією перхлоратів. Перхлорат калію вперше отримали в промисловому масштабі в 1905 р. в Мансбо.
Гофман з співробітниками в 1906 р. почали вивчення сполук, що утворюються при додаванні водного розчину хлорної кислоти до різних органічних сполук. Майже всі ці сполуки термічно нестійкі і детонують при нагріванні [7].
Похідні металів, неметалів і неорганічних катіонів, загальної формули M(ClO4)n (де n — валентність металу) відносять до неорганічним сполукам. Неорганічні перхлораты діляться на дві групи — іонні і ковалентні. Перхлорат-іон дуже рідко входить у внутрішню сферу комплексних сполук. Радіус перхлорат-іона 0,236 нм.
Іонні перхлораты (наприклад, перхлораты лужних, лужноземельних металів, амонію) — тверді кристалічні речовини, незабарвлені, якщо катіон не має забарвлення, не гідролізуються водою, часто утворюють гідрати. При нагріванні плавляться, при подальшому нагріванні розкладаються до досягнення температури кипіння (деякі перхлораты розкладаються без плавлення) з виділенням кисню. Розчинність у воді може бути різною (наприклад, перхлорат натрію NaClO4 добре розчинний у воді, а перхлорат калію KClO4 — мало розчинний у воді).
Ковалентні перхлорати — легкоплавкі тверді або рідкі речовини, незабарвлені, якщо катіон не має забарвлення. Перхлорати неметалів та деяких металів гідролізуються водою. При нагріванні плавляться, деякі киплять без розкладання. Зазвичай розчиняються в органічних розчинниках (наприклад, перхлорат срібла добре розчинний в бензолі, спиртах, ефірі). Перхлорат хлору ClClO4 (т. кіп. +44,5 0C) — цікаве з'єднання, що має хлор в двох ступенях окислення і володіє сильним хлорируючую дією. До неорганічним перхлоратам іноді відносять перхлорфторид FOClO3 (безбарвний газ).
Застосування неорганічних перхлоратів:
- При нагріванні перхлорати розкладаються виділяючи кисень, що зумовило їх застосування в якості окислювачів ракетного твердого палива.
- Перхлорати лужних металів служать вихідними сполуками для синтезу інших органічних і неорганічних перхлоратів.
- Перхлорати комплексів заліза, кобальту і міді розглядаються в якості перспективних вибухових речовин (наприклад, для підриву лазером).
- Перхлорат магнію використовується як осушувач.
- Перхлорат калію використовується для лікування захворювань щитовидної залози.
- Перхлорат-іон використовується для осадження калію, рубідію, цезію з водних або спиртових розчинів [7].
Висновки
Проведений аналіз літературних джерел дозволяє зробити наступні висновки:
- Поява нових і розвиток існуючих способів одержання кисню свідчить про зростання потреби суспільства в кисні.
- Розглянуто і проаналізовано загальні властивості пероксидів натрію і перхлоратів.
- Аналіз хімічних і фізичних властивостей речовин (неорганічних пероксидів, перхлоратів), що в індивідуальному стані вони не можуть використовуватися для вирішення практичних завдань. Вони перспективні лише в якості складових компонентів хімічних систем.
При написанні даного реферату магістерська робота ще не завершена. Остаточне завершення: червень 2018 року. Повний текст роботи та матеріали по темі можуть бути отримані у автора або його керівника після вказаної дати.
Перелік посилань
- Синявский Ю.В., Боярский М.Ю. Оптимизация систем хранения кислорода. – М.: МЭИ. 1972. – 46 с..
- Угай Я.А. Общая и неорганическая химия. — Москва: Высшая школа, 1997. — 432-527 с.
- Михайленко Я.И. Курс общей и неорганической химии / Я.И. Михайленко – М.: Высшая школа, 1966. – 238 c.
- Глинка Н. Л. Общая химия. — М.:
Химия
, 1977, переработанное. — 566. — 720 с. - Кнунянц И.Л. и др. Химическая энциклопедия. — Москва: Советская энциклопедия, 1990. — Т. 2. — 387- 671 с.
- Лидин Р.А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с.
- Шумахер И. «Перхлораты: свойства, производство и применение». — М.:ГНТИХЛ 1963
