Реферат за темою випускної роботи
Зміст
- Вступ
- 1 Актуальність
- 2 Аналіз обʼєкта вимірювання
- 2.1 Спектр поглинання та флуоресценції листків рослин
- 2.2 Методи вимірювання
- 2.3 Постановка задачі
- 3 Розробка структурної схеми
- Макетний зразок
- Перелік посилань
Вступ
Флуориметр, або люмінометрічний аналізатор – це прилад, який дозволяє визначати концентрацію речовини за рівнем світіння в них. Принцип дії флуориметра заснований на явищі флуоресценції – здатності молекул випромінювати світлові хвилі самостійно, або робити це після хімічної реакції з іншими речовинами. Знаючи світіння різних зʼєднань, можна виявляти їх наявність в різних складах і речовинах.
Хлорофіл – зелений пігмент рослин – безпосередньо бере участь в декількох фізіологічних процесах. Вивчаючи його флуоресценцію, ми побічно вивчаємо інші рівні фотосинтезу, наприклад, процеси на рівні пігментів, реакції руху електронів, темнові ферментні реакції та інші [1]. Ці показники часто є визначальними для фізіологічного стану рослин. Прояв впливу стресових умов у рослин відбувається на тому етапі, коли більшість фізіологічних процесів вже незворотні. Фотосинтез – найкращий індикатор для визначення стану рослини на рівні клітин. Справа в тому, що процес фотосинтезу часто сповільнюється в рослинах, піддаваємих впливу навіть короткочасних несприятливих умов – дефіцит води, температура, нестача поживних речовин, конкуренція бурʼянів, проникнення збудників хвороб [2, 3]. Отже, аналіз параметрів флуоресценції хлорофілу вважається важливим методом для оцінки здоровʼя, внутрішньої цілісності рослини в межах надземної частини культури. Це також швидкий і точний спосіб діагностики і визначення ступеня стійкості рослини до несприятливих або стресових умов.
1 Актуальність
В даний час на території Донецької області активно розвивається сільське господарство і вирощуються різні види культур.
Для вирощування якісної продукції найчастіше недостатньо оцінювати стан рослин органолептичним методом.
Відгук рослини на вплив стрес‑факторів (таких як посуха, надмірна волога, неприйнятний рівень рН та ін.) У вигляді, наприклад,
пожовклого листя проявляється занадто пізно для прийняття оперативних заходів щодо коригування стратегії вирощування.
Найбільш оперативним з нині відомих методів є метод оцінки проходження фотосинтезу шляхом вимірювання флуоресценції хлорофілу [4].
Цей метод передбачає застосування приладів‑флуориметрів, які опромінюють лист рослини світловим потоком, а потім фіксують відгук
рослини з подальшим
аналізом фіксованих даних, що дозволяє вжити заходів щодо оперативного усунення стресу. Виходячи з вищесказаного, актуальним є дослідження
флуоріметріческого методу оцінки стану рослин. У свою чергу для дослідження даного методу існує необхідність в розробці пристрою, здатного фіксувати
так звану криву Каутского, аналіз якої дасть можливість визначення впливу стрес‑факторів на рослину.
Розроблювальний пристрій для реєстрації флуоресценції хлорофілу в листі рослин дасть можливість визначити, як рослина відчуває себе в певних умовах, що допоможе виявити і усунути фактори згубного впливу на рослину, спрогнозувати тенденцію розвитку врожаю, змоделювати максимально можливу продуктивність культури в наявних умовах і т. д.
2 Аналіз обʼєкта вимірювання
Флуоресценція хлорофілу – явище не дуже складне. Його суть полягає в здатності зеленого пігменту – хлорофілу – поглинати, а потім випромінювати (відсвічувати) світлову енергію і довгі хвилі світла. Тривалість такого випромінювання хлорофілом визначається двома факторами: кількістю світла, поглиненого рослиною, і рівнем конкуренції за світлову енергію з іншими енергетичними процесами, які відбуваються в рослині (в основному, це процеси утворення нових речовин і віддачі тепла в рослині). Якщо хлорофіл починає менше поглинати світла, то його конкуренти отримують світловий енергії більше. отже, зміни в інтенсивності флуоресценції відображають зміни в ефективності утворення нових речовин – майбутнього нашого врожаю.
2.1 Спектр поглинання та флуоресценції листків рослин
Хлорофіл здатний до виборчого поглинання світла. Спектр поглинання даного зʼєднання визначається його здатністю поглинати світло певної довжини хвилі (певного кольору). Він має дві основні лінії поглинання в червоних та синьо‑фіолетових променях (мал. 1). При цьому хлорофіл a має максимум поглинання 429 і 660 нм, тоді як хлорофіл b – 453 та 642 нм. Однак необхідно враховувати, що в листі спектри поглинання хлорофілу змінюються в залежності від його стану, ступеня агрегації, адсорбції на певних білках [5]. В даний час показано, що є форми хлорофілу, що поглинають світло з довжиною хвилі 700, 710 і навіть 720 нм. Ці форми хлорофілу, поглинають світло з великою довжиною хвилі, мають особливо важливе значення в процесі фотосинтезу.
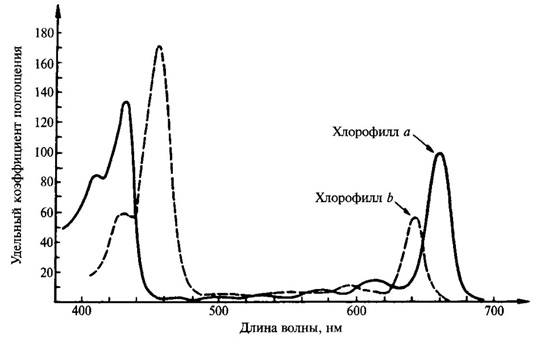
Малюнок 1 – Спектр поглинання хлорофілу a та b
Пігментний склад фотосинтетичних антенних комплексів вищих рослин різноманітний. У нього входять 2 різновиду хлорофілів (Хл a, Хл b) і кілька видів каротиноїдів (лютеїн, віолоксантін, зеаксантин, неоксантін, β‑каротин), однак прийнято вважати, що здатність до флуоресценції в природних умовах мають тільки молекули Хл a, внаслідок того, що вся енергія збудження, отримана іншими пігментами антени, передається на молекули Хл a [8]. Спектр флуоресценції зеленого листа розташовується в червоній області довжин хвиль (660 – 780 нм) і, як правило, мають два широких максимуму (мал. 2): один на довжині хвилі 680 – 690 нм (F685), інший – на довжині хвилі 730 – 740 нм (F740) [8, 9]. Основний внесок в довгохвильовий пік спектра вносить реабсорбция довгохвильовими формами хлорофілу флуоресценції, випущеної більше короткохвильовими формами [8, 9].
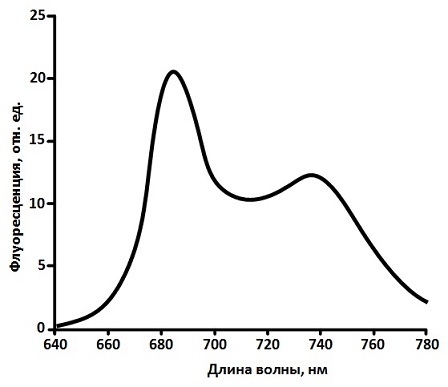
Малюнок 2 – Характерний спектр флуоресценції зеленого листа
2.2 Методи вимірювання
Найбільш практичними і часто використовуваними методами вимірювання є пряма реєстрація флуоресценції (метод тривалої індукції хлорофілу [6]) та модулированная флуоресценція (метод модуляції світлового сигналу).
Пряма реєстрація флуоресценції хлорофілу
Вимірювання проводиться після адаптації фотосинтезуючого обʼєкта до темряви (близько 20 – 30 хв), що визначає загасання
процесів,
повʼязаних зі світловою фазою фотосинтезу. Потім зразок висвітлюється безперервним світлом довжиною хвилі коротше 670 нм.
З включенням збуджуючого світла фотоприймач реєструє світло флуоресценції хлорофілу в діапазоні довжин хвиль приблизно від 680 нм до 760 нм.
За характером кривої індукції флуоресценції можна судити про деякі характеристики фотосинтетичного апарату зразка та динаміці протікання реакцій фотосинтезу.
Описаний метод використовується у флуориметрах, які оцінюють рівень стресу в рослині (так званий Plant Strеss Meter). Такі Флуоріметри можуть реєструвати і аналізувати криві індукції флуоресценції хлорофілу за короткі часи опромінення чинним світлом, як правило – до 10 секунд, але вимір має проводитися після темнової адаптації рослини
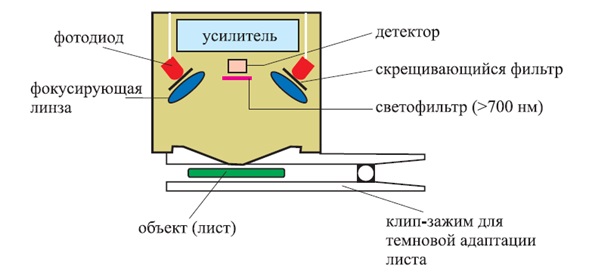
Малюнок 3 – Схема вимірює головки флуориметра, що використовує
Використовуючи цю методику визначаються наступні параметри:
- Fo – початкова (нульова) флуоресценція;
- FM – максимальний рівень флуоресценції;
- Fv = FM - Fo – змінна флуоресценція;
- Fv / FM – максимальна ефективність ФС2;
- TFM – час для досягнення FM;
- AM – площа поверхні над індукційної кривої флуоресценції хлорофілу.
Модульована флуоресценція хлорофілу
При цьому методі вимірювання світло включається на короткий час (1 – 3 мкс), цей інтервал часу достатній для визначення імпульсу флуоресценції хлорофілу. На детектор цього апарату потрапляють три види світлових сигналів:
- розсіяне від поверхні обʼєкту діюче світло (безперервне освітлення);
- сигнал флуоресценції обʼєкта, індукованої чинним світлом (безперервний сигнал);
- імпульсно‑індукований сигнал флуоресценції, возбудженої модульованим світлом; саме цей сигнал флуоресценції посилюється в електронному вигляді, а інші, не імпульсні сигнали, ігноруються.
Вимірювання можуть проводитися на цілих листах або їх частинах, а також на суспензіях хлоропластів або клітин водоростей, адаптованих до темряви або на світлі.
При використанні системи PAM [7] вимір починається включенням дуже слабкого імпульсного променя модульованого випромінювання, ML (від англ. Modulated Light), який викликає флуоресценцію хлорофілу. Джерелом ML є світловипромінюючі діоди (LED), які випускають випромінювання в червоній області спектра (як правило, λmax = 650 нм). Це випромінювання дуже слабке і не викликає індукційні процеси в листі, а збудження флуоресценції хлорофілу відбувається в основному з втрат енергії при її міграції по антені, і, отже, його значення можна прийняти за Fo (мал. 4). Потім включається насичуєчий імпульс SP (від англ. Saturating Pulse). Це короткий (наприклад, 0,8 с) і дуже потужний імпульс світла, інтенсивність якого може доходити до 16000 мкмоль·м-2·с-1 (LED, λmax = 665 нм). Під впливом редукції всіх акцепторів в ФС 2 тимчасово блокуються фотохімічні реакції, в результаті чого різко підвищується вихід флуоресценції. Інтенсивність флуоресценції в попередньо адаптованому до темряви обʼєкті досягає максимального значення (FM). Після зниження рівня флуоресценції до вихідного темнового значення Fo включається безперервне діюче світло, AL (так званий Actinic Light), із заданою щільністю потоку фотосинтетично активних фотонів, PPFD (від англ. Photosynthetic Photon Flux Density), як правило – від 200 до 500 мкмоль·м-2·с-1 (LED, λmax = 665 нм). При цьому спостерігається збільшення виходу флуоресценції, яка досягає максимального значення FP, характерного для даної інтенсивності AL. Протягом наступних кількох хвилин ефективність флуоресценції зменшується, досягаючи стаціонарного рівня FT, що означає урівноваження всіх реакцій на різних етапах фотосинтезу.
Після 240 секунд з моменту включення освітлення AL включається другий насичує імпульс SP, який редукує акцептори електронів ФС2 і тимчасово блокує фотохімічні реакції. Під впливом цього імпульсу спостерігається підвищення рівня флуоресценції до F'M, який нижче, ніж FM. Різниця між FM і F'M повʼязана з нефотохіміческім гасінням флуоресценції. Вимірювання флуоресценції хлорофілу з використанням PAM флуориметра забезпечує швидку оцінку ефективності перетворення енергії фотонів ФАР в хімічну енергію в процесі фотосинтезу досліджуваних обʼєктів і визначення ряду важливих параметрів:
- F'o – початкова (нульова) флуоресценція, виміряна в адаптованому до світла обʼєкті;
- F'M – максимальна флуоресценція;
- F'v/F'M = (F'M - F'o)/F'M – максимальна ефективність первинної фотохімічної реакції в адаптованому до світла обʼєкті;
- ФФС2 = (F'M - F'T)/F'M – дійсний квантовий вихід фотохімічних реакцій в ФС2 на світлу;
- qP = (F'M - F'T)/(F'M - F'o) – фотохімічні гасіння;
- qN = (FM - F'M)/(FM - Fo) – нефотохімічні гасіння;
- ETR = ФФС2 × 0,50 × PPFDa = 0,84 × 0,50 × PPFDa – швидкість лінійного перенесення електронів (тут PPFDa означає швидкість поглинання світла зразком, виражена в мкмоль·м-2·с-1).
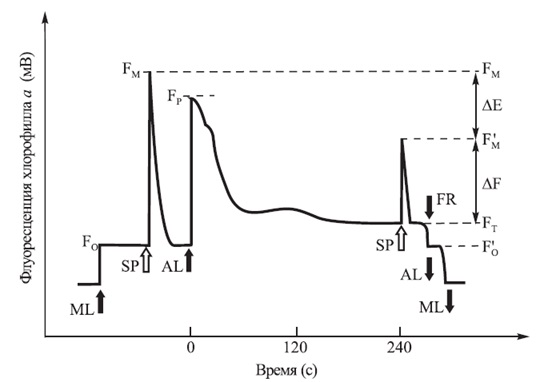
Малюнок 4 – Схематичне уявлення типового експерименту по визначенню фотосинтетичної ефективності при вимірюванні модульованої флуоресценції
- ML – модульоване вимірювальне світло;
- SP – насичуючий імпульс;
- AL – діюче світло;
- FR – близьке інфрачервоне світло (далекий червоний);
- FO – мінімальна флуоресценція хлорофілу в адаптованих до темряви обʼєктах;
- FM – максимальна флуоресценція хлорофілу в адаптованих до темряви обʼєктах;
- FP – максимальна флуоресценція хлорофілу при опроміненні чинним світлом;
- F'M – максимальна флуоресценція хлорофілу в адаптованих до світла обʼєктах;
- FT – стаціонарний рівень флуоресценції хлорофілу в адаптованих до світла обʼєктах;
- F'o – мінімальна флуоресценція хлорофілу в адаптованих до світла обʼєктах;
- ΔЕ = FM - F'M;
- ΔF = F'M - FT.
У проектованому пристрої в якості методу вимірювання обраний перший метод, а саме – пряма реєстрація флуоресценції (Метод тривалої індукції (стимуляції) хлорофілу). Вибір цього методу обгрунтований порівняльної простої технічної реалізації, отже більшою дешевизною щодо другого методу.
2.3 Постановка задачі
Завданням даної роботи є розробка пристрою для реєстрації флуоресценції хлорофілу і її параметрів в листі наземних частин рослин,
здатне здійснювати вимірювання безпосередньо в місцях зростання цих рослин. Якщо розглядати сучасні пристрої Флуоріметри як прототип,
то завданням можна назвати розробку вимірювального блоку цього пристрою, однак цей блок
здатний працювати самостійно,
вправляючись за допомогою спеціального програмного забезпечення з ПК, отже його можна вважати повноцінним пристроєм.
Цей пристрій, на відміну від потенційних прототипів матиме значно нижчу вартість і просту конструкцію,
що зробить його доступним для пересічних користувачів і малих сільських господарств з низьким бюджетом.
Головне достоїнство розроблюваного устрою щодо аналогів – доступність.
3 Розробка структурної схеми
Розроблювальний пристрій можна представити у вигляді такої структурної схеми:
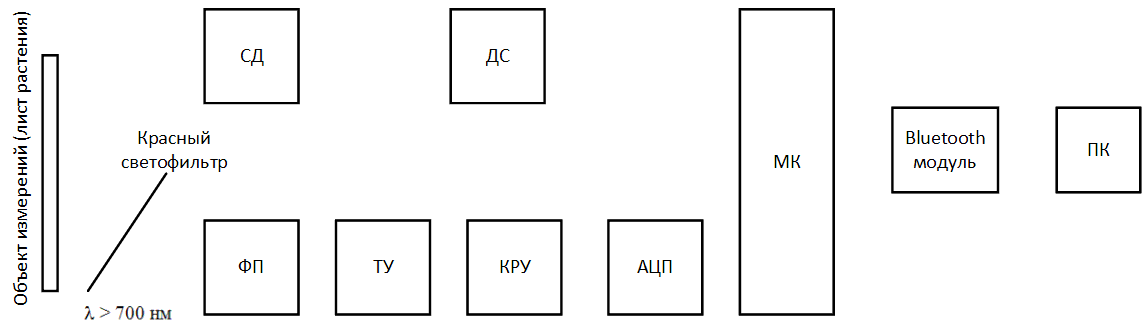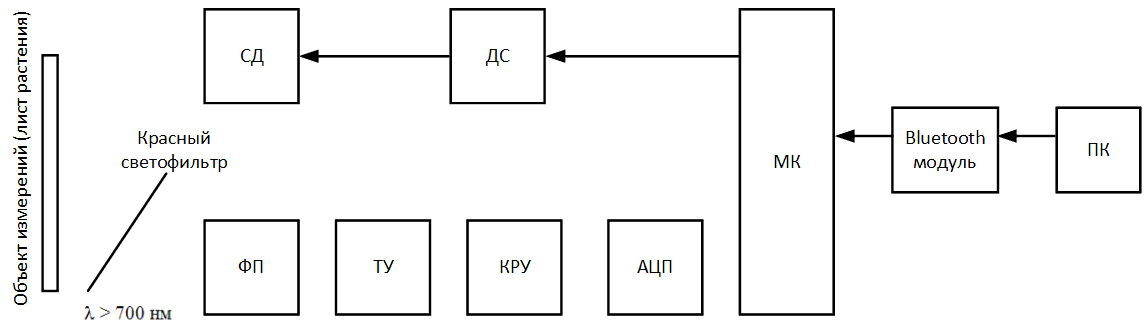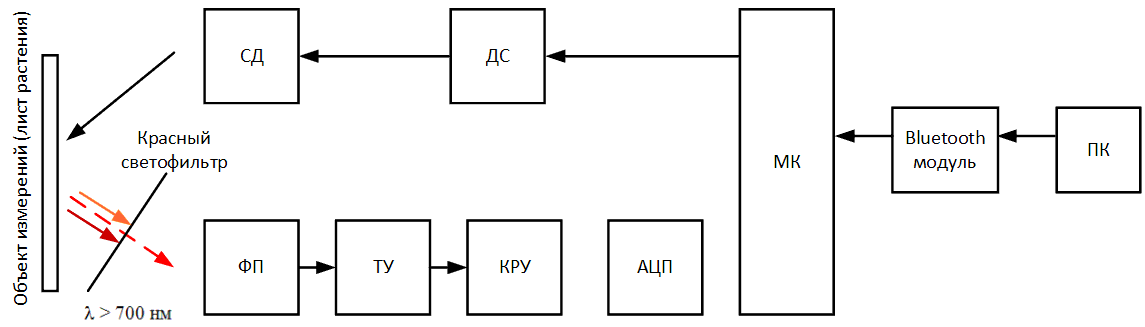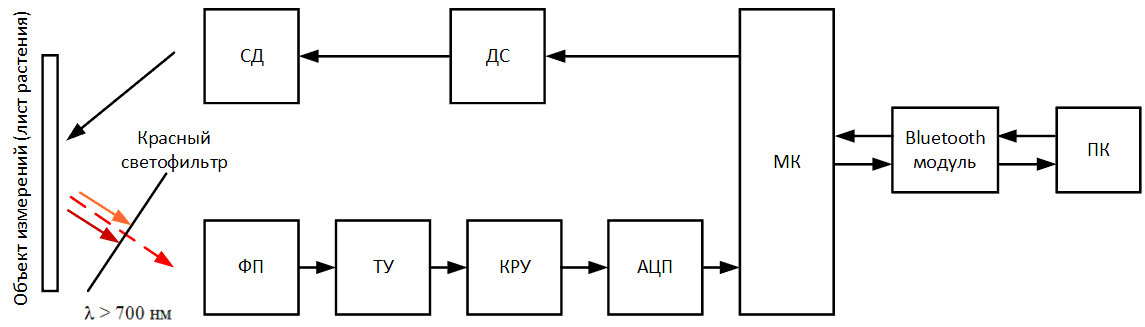
Малюнок 5 – Структурна схема проектованого пристрою (анiмована, 14 КБ, 12 кадрів)
- ДС – драйвер світлодіода;
- СД – світлодіод;
- ФП – фотоприймач;
- ТУ – трансімпедансним підсилювач;
- КРУ – каскад регулювання посилення;
- АЦП – аналого‑цифровий перетворювач;
- МК – мікроконтролер;
- ПК – персональний компʼютер.
Схема має наступний алгоритм роботи. У розробленому програмному забезпеченні на компʼютері або ноутбуці натискається кнопка Start
,
по бездротовій мережі Bluetooth через вбудований в пристрій Bluetooth модуль на мікроконтролер (МК) приходить сигнал, який сигналізує про початок вимірювання.
Мікроконтролер подає електричний сигнал на драйвер світлодіода (ДС), тим самим запалюючи світлодіод (СД) і починаючи процес освітлення поверхню листової
пластини. Одночасно з цим включається фотоприймач (ФП) і перетворює випромінюється листом флуоресценцию, що потрапила на нього через червоний світлофільтр в
електричний сигнал. Сигнал посилюється за допомогою трансімпедансним підсилювача (ТС) і потрапляє в каскад регулювання посилення (КРУ), в якому може бути
зменшений або збільшений до певного рівня, щоб уникнути виходу за межі вимірюваного діапазону. Аналоговий сигнал з КРУ потрапляє на аналого‑цифровий
перетворювач (АЦП), який перетворює аналоговий сигнал в цифровий і передає його в мікроконтролер (МК). МК протягом усього вимірювання зберігає
вимірювальні значення флуоресценції (код АЦП) в спеціальний масив, який в кінці виміру через Bluetooth модуль передається на персональний компʼютер (ПК)
для подальшої обробки в спеціальному ПО.
Відповідно з описаним алгоритмом в обʼєктно‑орієнтованоій мові програмування Delphi було створено програмне забезпечення, представлене на малюнку 6.
Малюнок 6 – Інтерфейс програмного забезпечення для ПК
4 Макетний зразок
Для тестування програмного забезпечення і більш детального практичного дослідження явища флуоресценції хлорофілу був створений макетний зразок розробляємого пристрою (мал. 7).
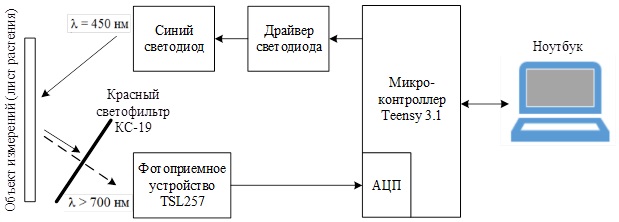
Малюнок 7 – Структурна схема макетного зразка розроблювального пристрою
Принцип роботи залишається тим же: з ноутбука на мікроконтролер по USB приходить сигнал, за яким починається вимір, МК подає сигнал на драйвер синього світлодіода, світлодіод опромінює обʼєкт вимірювання (лист рослини), при цьому лист перевипромінює червоною флуоресценцією, яка через червоний світлофільтр потрапляє на фотоприймальний пристрій, перетворюється в напругу та потрапляє в АЦП мікроконтролера, де оцифровується і зберігається в оперативній памʼяті МК. Після закінчення вимірювання масив виміряних кодів АЦП через USB передається на ноутбук, де обробляється в спеціальному ПО.
Макетний зразок був протестований на листках рослин різних видів, а отримані в результаті криві відповідають кривим, отриманим аналогами розроблювального пристрою. Одна з зареєстрованих кривих наведена на малюнку 8.
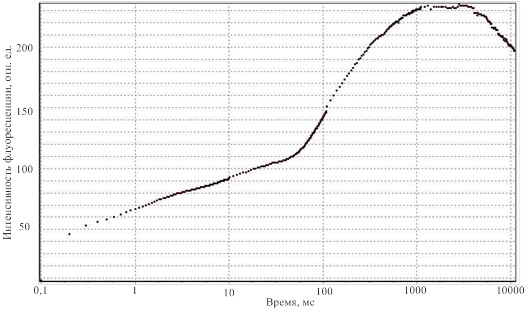
Малюнок 8 – Результат реєстрації кривої Каутского за допомогою розробленого макета проектованого пристрою
На даному етапі пристрій реєструє тільки криву швидкої індукції флуоресценції хлорофілу, що проходить в перші 10 секунд вимірювання. Це дозволяє отримати всі необхідні параметри для визначення стану рослини, за винятком FT, в подальшому буде реалізована можливість проводити повний цикл вимірювання і реєструвати всі параметри.
Перелік посилань
- В. Н. Гольцев, М. Х. Каладжи, М. А. Кузманова, С. И. Аллахвердиев Переменная и замедленная флуоресценция хлорофилла a – теоретические основы и практическое приложение в исследовании растений. – М.–Ижевск: Институт компьютерных исследований, 2014. – 220 с.
- Л. А. Вадимович Механизмы токсического действия полициклическихароматических углеводородов на фотосинтетический аппарат, 2016.
- Д. А. Тодоренко Характеристики световых реакций фотосинтеза при воздействии токсических веществ, 2016.
- В. С. Лысенко, Т. В. Вардуни, В. Г. Сойер, В. П. Краснов Фундаментальные исследования, 2013, № 4–1. Флуоресценция хлорофилла растений как показатель экологического стресса: теоретические основы применения метода, 2013.
- Т. Э. Кулешова, А. И. Лихачев, Е. С. Павлова, Д. О. Кулешов, А. В. Нащекин, Н. Р. Галль Журнал технической физики, 2018, том 88, вып. 9. Взаимосвязь спектров поглощения пигментов растений и светодиодного освещения с различным спектральным составом
- Д. Ю. Корнеев Информационные возможности метода индукции флуоресценции хлорофилла, 2002.
- Г. В. Мельников, М. И. Лобачев, А. Г. Мельников Вестник СГТУ, 2003, № 1. Высокочувствительный импульсный флуориметр для экологического мониторинга окружающей среды
- C. Buschmann Variability and application of the chlorophyll fluorescence emission ratio red/far‑red of leaves // Photosynth. Res. 2007. V. 92. P. 261–271.
- К. Б. Асланиди, А. А. Шалапенок, В. Н. Карнаухов, Н. Г. Берестовская, В. И. Шавкин Метод определения функционального состояния растений по спектрам флуоресценции хлорофилла (техника биомониторинга). Пущино: НЦБИ АН СССР. 1988.
- N. A. Mir, R. Perez, R. M. Beaudry (1996) Chlorophyll fluorescence and whole fruit senescence in Golden Delicious apple. In: International Postharvest Science Conference Postharvest 96. – Taupo, New Zealand, p. 121–126.
- P. S. Basu, A. Sharma, N. P. Sukumaran (1998) Changes in net photosynthetic rate and chlorophyll fluorescence in potato leaves induced by water stress. Photosynthetica, 35:13–19.
- G. Angelini, P. Ragni, D. Esposito, P. Giardi, M. L. Pompili, R. Moscardelli, M. T. Giardi (2001) A device to study the effect of space radiation on photosynthetic organisms. Physica Medica, v. XVII, Supplement 1, 1st International Workshop on Space Radiation Research and 11th Annual NASA Space Radiation Health Investigators’ Workshop.
