Истомин Александр Леонидович

E-mail:shults@ukrtop.com
Факультет экологии и химической технологии
Специальность Химическая технология топлива и углеродистых материалов
(8.091604)

Факультет экологии и химической технологии
Специальность Химическая технология топлива и углеродистых материалов
(8.091604)
1. Обоснование и актуальность темы
В связи с быстрыми темпами развития фармакологической науки, во всем мире значительно увеличился интерес к органической химии как основному источнику биологически активных веществ, так как не все необходимые потенциальные лекарственные формы можно извлеч из природного сырья.
Практически можно сказать, что человека на протяжении всей его жизни окружает химия в своих различных проявлениях, причем все процессы в его
организме протекают по законам органической и биоорганической химии. Органическая химия - достаточно затратная и тяжелая область практической деятельности, однако потенциальные блага,
получаемые в результате исследований, неоценимы по сравнению с затраченным трудом. Это иновые химические агенты, и конструкционные материалы с фантастическими свойствами, и органические проводники (в т. ч. "органические металлы") и полупроводники, и новые лекарства, и краски, и моющие средства и этот список можно продолжать практически бесконечно.
Особый интерес представляет химия гетероциклических соединений, т. е. имеющих в своем
составе кроме атома углерода другие атомы периодической системы Менделеева. Это
связано с целым рядом особых свойств, проявляющихся у подобных веществ.
К данным свойствам можно отнести различные виды фунгицидной, акарицидной,
фармакологической активности, новые оптические свойства получаемых органических
соединений, возможность их применения во многих отраслях человеческой
деятельности.
В последние 15-20 лет заметно вырос интерес к химии гетероциклических В-хлорвинилальдегидов. Это вызвано во-первых той исключительной ролью, которую играют в биоэнергетике организма вещества полученные на их основе. Во-вторых это разнообразные виды физиологической активности: противоопухолевая, противовоспалительная, сердечно-сосудистая, тромболитическая, противовирусная и т. д. С химической точки зрения В-хлорвинилальдегиды благодаря своим разнообразным химическим свойствам, являются отличными исходными реагентами для формирования комбинаторных рядов гетероциклических соединений и моделирования структуры потенциальных биологически активных соединений, что и определяет высокую практическую значимость исследований в данном направлении. С другой стороны В-хлорвинилальдегиды и их производные интересны с точки зрения таких классических вопросов теоретической органической химии как реакционная способность, таутомерия, конформационный анализ и особенности электронного строения данных систем.
2.Обзор состояния вопроса
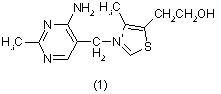
Тиазольный цикл входит в состав витамина В1 (тиамина) (1) [5]:
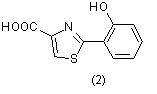
Из грибка Xerocumus subtomemtosus выделена новая аминокислота, а из Pseudomonas aeruginosa - аэрогиноевая кислота (2), [5]:
Бензотиазольное ядро играет важную роль в биолюминисценции светлячков, причем хромофор, ответственный за свечение, очень близок по структуре к люциферину (3), [6]:
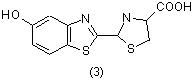
При люминисценции промежуточно образуются диоксетаны, которые разлагаются с образованием электроновозбужденных частиц, ответственных за хемилюминесценцию. Интересной группой природных соединений, включающих фрагменты бензотиазола, являются фемеланины - высокомолекулярные пигменты перьев птиц [6].
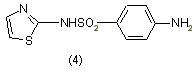
Производные тиазола используются для приготовления лекарственных веществ. Одним из них является сульфамидный препарат - сульфотиазол (норсульфозол) (4), обладающий сильным бактерицидным действием [5]:
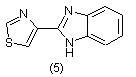
Известны и другие сульфамидные препараты, содержащие тиазольное кольцо. В качестве средств против глистных инфекций в настоящее время имеется несколько сильнодействующих препаратов. Одним из них является тиабендазол (5), синтезированный в 1961 г. химиками фирмы Мerck [7]:
Выдающимися антигельминтными свойствами обладает тетрализон, открытый бельгийским ученым Янссеном (6) [7]:
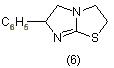
Тетрализон оптически активен, причем биологическая активность присуща лишь l-изомеру. В настоящее время освоена технология разделения образующегося при синтезе рацемата с рециркуляцией неактивного d-изомера.
Тиазольный цикл также входит в состав пенициллинов. Наиболее ценными являются ампицилин и метицилин. Ампицилин (7) отличается широтой противомикробного действия, возможностью применения в виде таблеток и относительной стойкостью к кислотам [7].
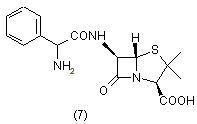
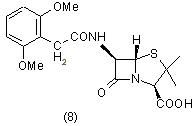
Однако он легко разрушается ферментом пенициллиназой и поэтому не может быть использован для лечения заболеваний, вызываемых резистентными стафилококками. В тоже время метицилин (8) лишен указанного недостатка [7]:
Интерес представляет такая группа соединений как мезоионные тиазолы типа А. Для этих соединений в литературе описан широкий спектр биологической активности. Так, например, производные 1,3-тиазолийолата-4 (9) являются стимуляторами центральной нервной системы и противоопухолевыми препаратами [8].
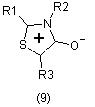
Производные 1,3-тиазол-4-имина (10) могут быть использованы как противоопухолевые, седативные вещества и как стимуляторы центральной нервной системы [8]:
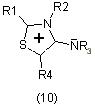
Большой интерес представляют конденсированные производные тиазола, которые могут быть использованы, а некоторые используются как потенциальные биологически активные вещества.
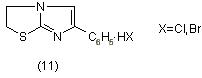
Так бром(хлор)гидрат 6-фенилимидазо[2,1-b]тиазолидин (ФИАНТ-2)
(11) [9] применяют в ветеринарной медицине как иммуностимулятор для повышения иммунитета птиц. ФИАНТ-2 оказался менее токсичным, более технологичным, экологически безопасным и дешевым заменителем импортного препарата ''тетрамизол''.
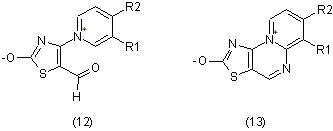
Тиазольные бетаинальдегиды (12) обладают выраженным противовирусным действием, а 2-окси-3-тиазолино[4,5-d]-4-R2-пиримидо[1,2-b]пиримидины представляют собой мезоионные структуры (13) и привлекают внимание как ''молекулярные клины'' с присущим им комплексом свойств: антимикробные, противовирусные, противоопухолевые [10].
Тиазолидиндион-2,4 был получен впервые в 1865 году Хейнцом при нагревании продукта взаимодействия этилового эфира монохлоруксусной кислоты с роданидом калия с разбавленной соляной кислотой. Препарат именовался в старой химической литературе ''горчичноуксусная кислота'' (14).
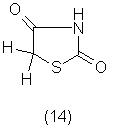
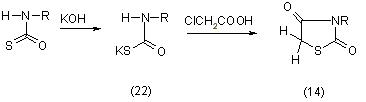
Кроме того встречаются также названия: лактам аминоформилтиогликолевой кислоты, 2,4-тиазолидиндион, 2,4-дикетотиазолидин, 2,4-дикетотетрагидротиазол, 2,4-дикетотиазол. Для получения тиазолидиндиона-2,4 могут быть использованы 4 метода синтеза в зависимости от исходного серусодержащего соединения. Первый метод основан на использовании тиоционатов (роданидов) или изотиоционатов (горчичных масел); второй метод - на использовании солей или эфиров тиокарбаминовой кислоты; третий метод - на применении тиогликолевой кислоты; четвертый метод - на превращениях других производных тиазолидона-4 и псевдотиогидантоинов [11].
Тиоцианатный метод синтеза основывается на взаимодействии монохлоруксусной кислоты (15) с роданистым калием и гидролизе полученного продукта минеральными кислотами [11]:
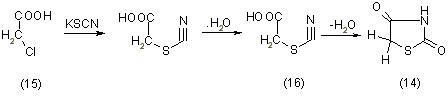
Вместо монохлоруксусной кислоты в реакцию могут быть введены её сложные эфиры, а также другие а-моногалогенкарбоновые кислоты, их сложные эфиры или амиды. В последнем случае конечными продуктами реакции являются 5-замещенные производные тиазолидиндиона-2,4.
Все промежуточные продукты синтеза тиазолидиндиона-2,4 могут быть легко выделены. Для дегидротации S-карбоминилтиогликолевых кислот (16) могут быть применены как минеральные кислоты (HCl, H2SO4), так и уксусный ангидрид.
Если в реакцию конденсации с монохлоруксусной кислотой (15) ввести горчичные масла (17) вместо роданидов, тогда конечными продуктами реакции являются 3-замещенные производные тиазолидиндионы-2,4 (18), [11]:
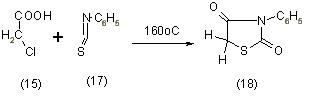
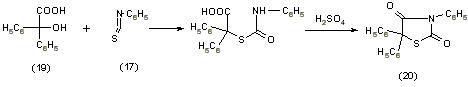
При замене монохлоруксусной кислоты бензиловой (19), в молекуле которой a-углеродный атом имеет выраженный электрофильный характер, происходит образование 3,5,3-трифенил тиазолидиндиона-2,4 (20) по схеме [11]:
Аналогично при конденсации бензиловой кислоты с другими арилизотиоцианатами были получены 3-о-толил-, 3-м-толил, 3-п-толилпоизводные 5,5-дифенилтиазолидиндиона-2.
Исходными веществами при тиокарбаминатном методе синтеза являются соли или сложные эфиры (тиоуретаны, ксантогенамиды) тиокарбаминовой кислоты (21). Этот метод был впервые применен Либерманом и Фельцковым в 1880 г. Промежуточными продуктами реакции являются, аналогично как и при тиоцианатном методе синтеза, S-карбаминилтиогликолевые кислоты [11]:
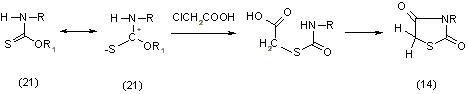
При взаимодействии аминов (или аммиака) с COS в щелочной среде образуются тиокарбаматы (22), которые легко взаимодействуют с монохлоруксусной кислотой (её солями или сложными эфирами) с образованием тиазолидиндионов-2,4 (14), [11].
Исходным веществом при тиогликолевом методе синтеза является тиогликолевая кислота (23) которую конденсируют с цианатом калия или с изоцианатами (24), [11] согласно схеме:
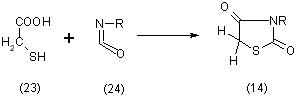
Реакция с изоцианатами имеет только теоретическое значение для доказательства строения тиазолидиндионов-2,4. В тоже время разработанный А. Е. Кретовым и А. С. Беспалым метод конденсации тиогликолевой кислоты с цианатом калия в кислой (R=H) или нейтральной (R=K) средах дает возможность получить тиазолидиндион-2,4 и его калиевую соль с выходом 96 или, соответственно, 78%, [11].
При конденсации монохлоруксусной кислоты с тиомочевиной (25) в концентрированной соляной кислоте и в присутствии ароматических альдегидов образуются в одну стадию 5-арилиден-тиазолидиндионы-2,4 (26), [11] по уравнению :
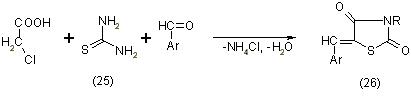
Образовавшийся первоначально в реакции псевдотиогидантоин или его 5-арилиденпроизводное подвергаются кислотному гидролизу, в результате чего конечными продуктами реакции являются 5-арилидентиазолидиндионы-2,4. Метод дает хорошие выходы. Позже был разработан препаративный метод синтеза незамещенного тиазолидиндиона-2,4 с выходом 64,7%,основанный на конденсации монохлоруксусной кислоты (15) с тиомочевиной (16) в соляной кислоте, [11]:
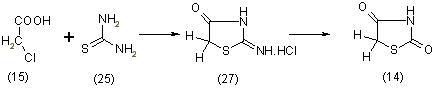
Хлористоводородный псевдотиогидантоин (27), образующийся как промежуточное соединение, подвергается медленному гидролизу уже при кипячении с водой. Принимаем данный метод синтеза для получения незамещенного тиазолидиндиона-2,4. Особый теоретический интерес представляет получение тиазолидиндиона-2,4 из хлорацетонитрила (28), [11]:
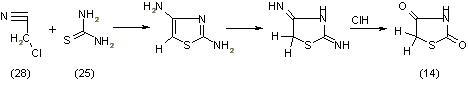
При конденсации хлорацетонитрила (28) с тиомочевиной (25) образуется хлористоводородный 2,4-диаминотиазол, который при взаимодействии с концентрированной соляной кислотой легко превращается в тиазолидиндион-2,4 (14), [11].
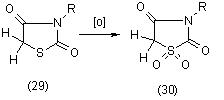
Установлено, что 3-замещенные производные тиазолидиндиона-2,4 (29) образуют при окислении в уксусной кислоте при 0oС с помощью KMnO4 сульфоны (30), [11]:
Нагревание производных 3-этилтиазолидиндиона-2,4 (31) с P2S5 в пиридине при 100оС приводят к 4-тиоаналогам (32). Дальнейшее нагревание 4-тиоаналогов с P2S5 в коллидине при 172оС ведет к образованию 4-тиороданинов (33), [11]:
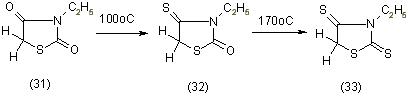
По данным патента Гаверта кипячение производных 3-этилтиазолидиндиона-2,4 в ксилоле с P2S5 в присутствии MgO приводит к смеси производных 4-тиотиазолидона-4 и тиазолидиндиона-2,4 [11].
Алкилирование тиазолидиндионов-2,4 (14) с помощью алкилгалогенидов, диазометана или диметилсульфата приводит к образованию 3-алкилпроизводных (34), [11]:
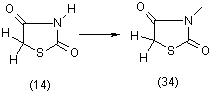
Реакция может быть проведена с выделением Ag - или К-солями тиазолидиндионов-2,4, а также в присутствии водных и спиртовых растворов щелочей, CH3ONa, K2CO3 и др. Ни в одном случае не наблюдалось замещение алкильными радикалами по положению 2. Калиевые соли тиазолидиндиона-2,4 легко вступают в реакцию с трихлорметилсульфонилхлоридом в хлороформе и образуют и образуют 3-производное (35) с хорошими выходами [11]:
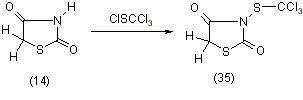
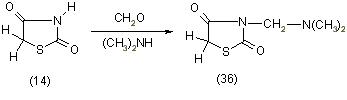
Тиазолидиндион-2,4 также легко вступает в реакцию с формальдегидом и аминами. Введение в реакцию диметиламина приводит к образованию 3-диметиламинометилтиазолидиндиона-2,4 (36), [11]:
При сплавлении тиазолидиндиона-2,4 (14) с антраниловой кислотой (37) в присутствии ацетата натрия образуется производное хинолина (38), [11] по уравнению:
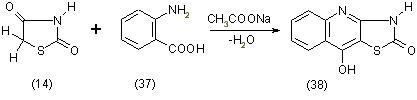
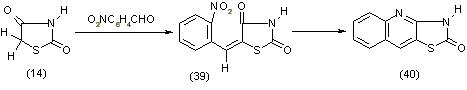
Образование производных хинолина (40) наблюдается также при восстановлении 5-о-нитробензилидентиазолидиндиона-2,4 (39), [11]:
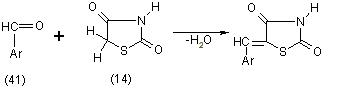
Подвижность атомов водорода в положении 5 молекул тиазолидиндионов-2,4 была установлена в 1889 году Андреашем, который проводил конденсацию с ароматическими альдегидами (41) в присутствии минеральных кислот [11]:
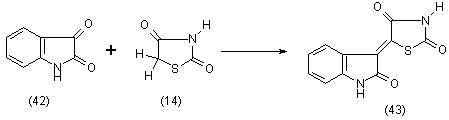
Тиазолидиндион-2,4 (14) при кратковременном нагревании с изатином (42) в ледяной уксусной кислоте образует (индол-3)-(2-оксотиазолидонил-5)-индиго (43), [11]:
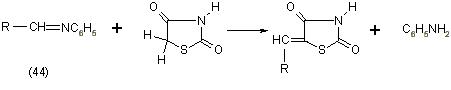
Аналогично альдегидам реагируют с тиазолидиндионами-2,4 шиффовые основания (44), [11]:
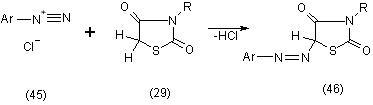
Установлено, что 3-замещенные производные тиазолидиндиона-2,4 (29), взаимодействуют с соединениями диазония (45) с образованием 5-арилазопроизводных (46), [11]:
В-хлорвинилальдегиды заслуживают чрезвычайного внимания как с теоретической , так и с практической точки зрения , долгое время подробно не исследовались, так как для их изготовления не был известен простой общедоступный способ. В настоящее время найдено несколько простых способов синтеза B-хлорвинилальдегидов, как алициклического так и гетероцикличекого рядов.
Значительный вклад в разработку методов синтеза B-хлорвинилальдегидов на основе кетонов и ацетиленов внесли З. Арнольд и И. Жемличка. Они нашли очень простой и оригинальный способ, позволяющий перейти от простых карбонильных соединений к B-хлорвинилальдегидам. Ими установлено, что карбонильные соединения, имеющие вместе с СО-группой по меньшей мере одну метиленовую или метиловую группу (47) легко реагируют с реактивом Вильсмеера, приготовленным из диметилформамида и хлорокиси фосфора POCl3 или фосгена и дают после гидролиза реакционной смеси B-хлорвинилальдегиды (48), [12]:
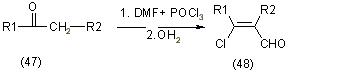
Условия гидролиза у отдельных производных значительно различаются, так, например большинство B-хлорвинилальдегидов выделяется из первоначально чистого раствора, который возникает после разложения реакционной смеси льдом при 20оС, но некоторые получают при более высоких температурах, или дистилляцией с водяным паром. Таким же образом с реактивом Вильсмаера реагируют арилацетилены (49), [12]:
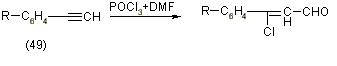
При хлорформилировании по методу Вильсмеера алилового спирта образование хлоральдегида не происходит. Вместо этого образуется 3-хлоралиловый спирт (50), который впоследствии окисляют в хлоральдегид (51), [12]:
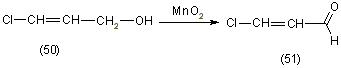
В качестве окислителей применяют оксиды марганца или хрома. При окислении 3-хлор-3-метилалилового спирта применяют смесь бихромата натрия с серной кислотой.
Впервые этот метод предложен в 1935 году Аверсом и Хуллем которые хлорированием 3-фенилпропиналя (52) получили B-хлоркоричный альдегид (53), [12] согласно схеме:
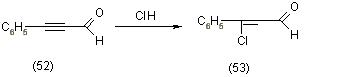
Также в эту реакцию вступают и другие алкинали с различными галогеноводородами, например 3-диметиламинопропиналь (54), [12].
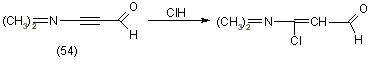
Метод предложен Арнольдом и Жемличкой и основан на галогенировании малонового альдегида (55) или его производных с образованием B-хлорвинилальдегида или, в случае производных, B-хлорвинилкетонов, а также диметиламиноакролеина (56) с получением B-хлоракролеина. В качестве галогенирующего агента предлагаются хлорокись фосфора, хлористый тионил, пятихлористый фосфор и др. Реакции протекают по следующей схеме:
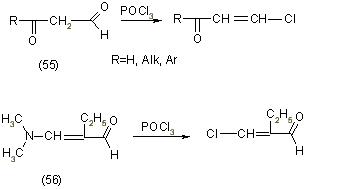
Браун и Остермеер описывают метод синтеза B-хлоркоричного альдегида (58) из имидхлорида B-хлоркоричной кислоты (57) на которую действовали хлоридом хрома в среде эфира, согласно схеме [12]:
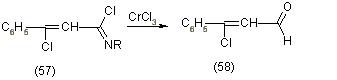
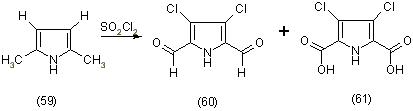
Фишер получил из диметилпиролла (59) путем окисления метильных групп и одновременным хлорированием в a-положении сульфохлоридом, 2,5-диформил-3,4-дихлорпиррол (60) и 2,5-дикарбоксильное соединение (61) т. е. их смесь [12].
Молекула B-хлорвинилальдегидов содержет два электрофильных центра атом углерода альдегидной группы и атом углерода связанный с атомом хлора, и это в значительной мере определяет химические свойства B-хлорвинилальдегидов [12].
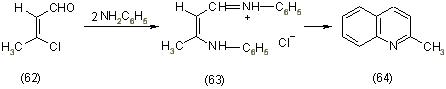
Первые сведения о взаимодействии B-хлорвинилальдегидов с первичными ароматическими аминами представлены Джулией, которая из анилина и B-хлоркротонового альдегида (62) получила метилхинолин (64). Образование метилхинолина происходит через промежуточную дианилиновую соль (63), [12].
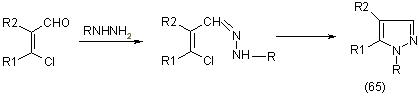
В дальнейшем по этой реакции удалось выделить промежуточные продукты. При взаимодействии B-хлорвинилальдегидов с гидразином также получают гетероциклические соединения (65), [12]:
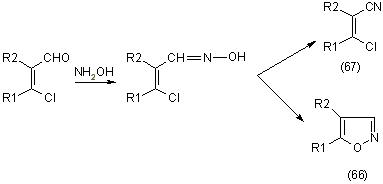
При взаимодействии B-хлорвинилальдегидов с гидроксиламином получают производные изооксазола (66) и B-галогенакрилонитрил (67), [12]:
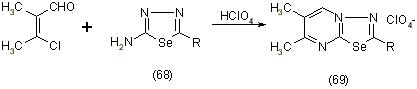
Если использовать a-аминоазотсодержащие гетероциклические соединения, то в результате получают конденсированные гетероциклы, например, при взаимодействии B-хлоракролеина с 5-фенил-2-амино-1,2,4-селендиазолом (68) приводит к образованию 1,3,4-селендиазоло(3,2-а)пиримидина (69), [12]:
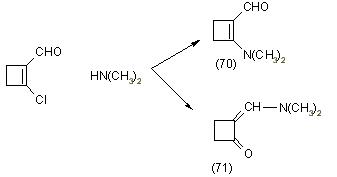
Первые результаты исследований отношения B-хлорвинилальдегидов к вторичным аминам представили Арнольд и Жемличка. Авторы описывают взаимодействие B-хлоракролеина с диметиламином. При этом в мягких условиях получается B-диметиламиноакролеин (70), а при повышенной температуре и давлении происходит образование диметиламинометиленциклонона (71), [12]:
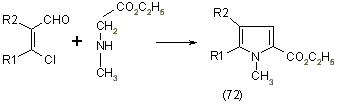
Получение производных пиррола путём взаимодействия B-хлорвинилальдегидов с эфирами в результате циклизации получают производные пиррола (72), [12]:
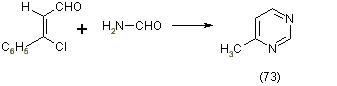
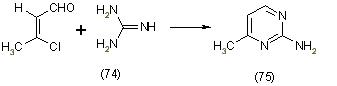
Зейгенбей и Франк изучали реакцию B-хлорвинилальдегидов с формамидом при температуре 170-180 оС в результате чего получен замещённый пиримидин (73), [12]:
3. Перечень нерешенных вопросов и задача диссертации
Задача диссертации - поиск путуй синтеза конденсированных гетероциклических соединений на базе 4-хлор-5-формилтиазолин-2-она и вторичных продуктов коксохимии.
Цель диссертации - синтез конденсированных гетероциклических соединений путем взаимодействия 4-хлор-5-формилтиазолин-2-она с содержащими азот и серу бинуклеофилами, изучение условий протекания реакций, анализ полученных соединений с применением ИК- и ПМР-спектроскопии и элементного анализа.
В данной работе рассмотрены основные пути получения и применения производных тиазола, описаны методы синтеза тиазолидиндионов-2,4 и рассмотрены их химические свойства. Произведен анализ литературных методов синтеза B-хлорвинилальдегидов и их химические свойства как очень реакционноспособных соединений. Предложены методы синтеза конденсированных гетероциклических соединений путем взаимодействия 4-хлор-5-формилтиазолин-2-она с сера- и азотсодержащими соединениями - тиомочевинами, и другими бинуклеофилами. Произведен анализ полученных экспериментальных данных, результаты подтверждаются данными ИК- и ПМР-спектроскопии. Предложены новые пути использования вторичных продуктов коксохимии в тонком органическом синтезе.
Но на данном этапе завершенности работы остается ряд нерешенных вопросов связаных с более детальным изучением химических свойств 4-хлор-5-формилтиазолин-2-она и сравнения его поведения с другими гетероциклическими В-хлорвинилальдегидами на основе азолидонов-4.
4. Методы, средства и научная новизна диссертации
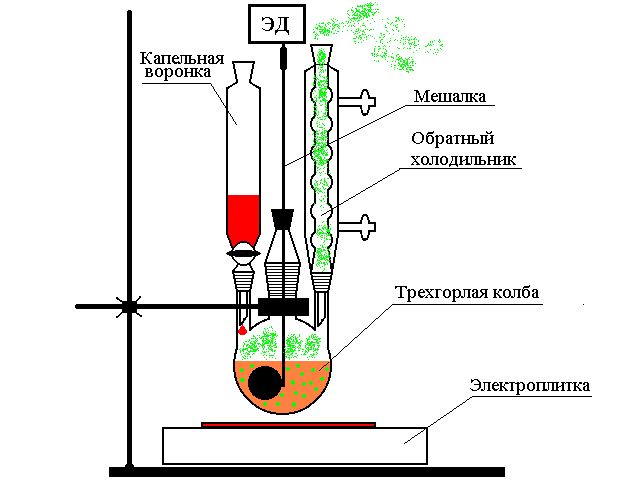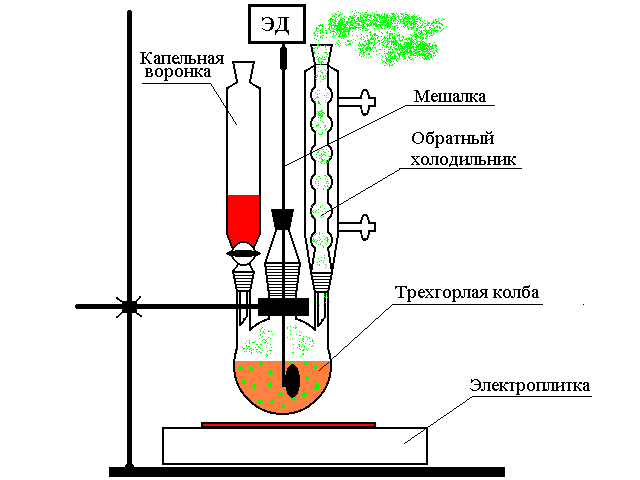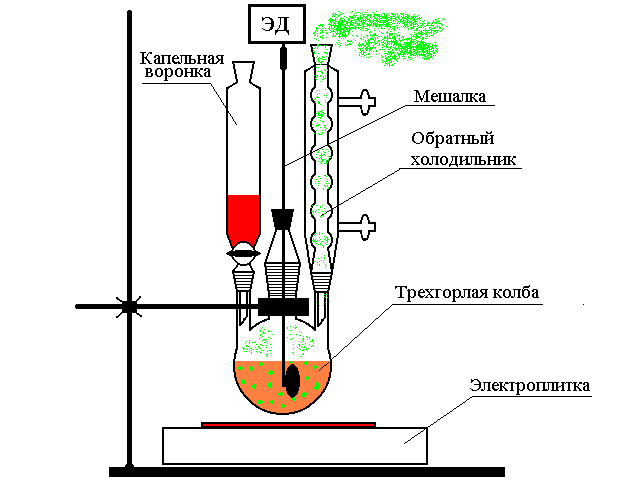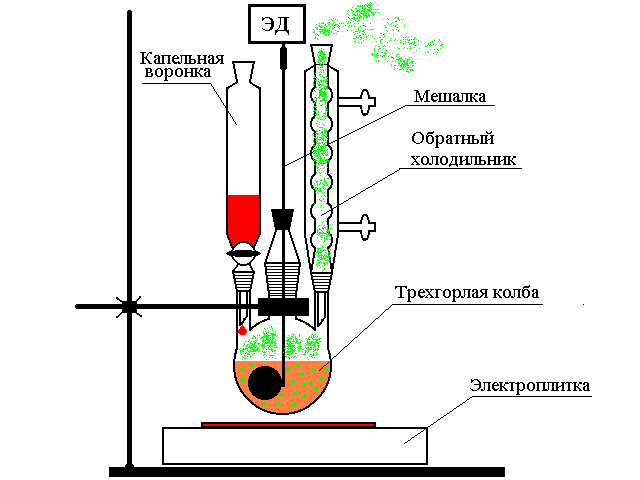
Синтез 4-хлор-5-формилтиазолин-2-она проведен по методу Вильсмеера путем взаимодействия тиазолидиндиона с комплексом Вильсмеера который получили при взаимодействии диметилформамидa c хлорокисью фосфора в установке изображенной на рисунке ниже.
Химических соединений к данному моменту синтезировано не менее 10 млн., из них большинство
- органические. Это связано с особыми свойствами углерода, из которого
практически полностью они состоят. Этот элемент способен образовывать огромное
количество различных классов соединений с почти любым атомом периодической
системы элементов, а также создавать собственные длинные, разветвленные и
неразветвленные, цепочки, многочленные кольца и другие структуры.
Поэтому
при достаточно большом количестве атомов, входящих в данное соединение,
количество только структурно изомерных ему соединений может превышать тысячи и
десятки тысяч веществ, а ведь существует не только структурная, но и другие виды
изомерии, например, оптическая. Соответственно, возможности, открывающиеся перед
химиками-органиками в деле синтеза новых веществ с различными свойствами,
практически безбрежны.
На данном этапе развития науки и техники большую роль
в поиске новых полезных свойств играет т.н. скрининговый метод. Его сущность
заключается в исследовании заданного класса соединений с различными
заместителями. Особенно часто он применяется в фармакологии. Он оправдывает себя
при относительно ограниченном количестве веществ, попадающих на анализ.
Однако, исходя из вышесказанного, можно предположить бесперспективность
этого метода в будущем, особенно при дальнейшем развитии биохимии и получении
соединений с заданными свойствами непосредственно для решения конкретной задачи,
но такие исследования пока достаточно дороги. Одним из положительных результатов
скрининга является практическое подтверждение факта,что подобные соединения
имеют похожие свойства.
При глубоком изучении темы с привлечение
сетевых технологий выяснилось, что подобные исследования для данного типа
веществ в мире практически не ведутся, хотя они обладают огромным потенциалом.
Выполняемые исследования по теоретической и прикладной ценности не уступают
зарубежным разработкам в этой области, однако материально-техническое их
обеспечение недостаточно.
5. Практическая значимость результатов и их апробация
В данной работе систематизированы методы синтеза тиазолидиндиона-2,4 описанные в научной литературе и его химические свойства; литературные методы синтеза и свойства гетероциклических B-хлорвинилальдегидов, применение производных тиазола в науке и технике.
Разработаны методы синтеза и впервые были синтезированы новые гетероциклические структуры на основе тиазолидиндиона-2,4 и а-аминоазотсодержащих гетероциклов. Полученные соединения представляют интерес как потенциальные биологически активные вещества.
Ставится вопрос о исследовании изучаемых веществ на фармакологическую активность, что
зависит от материального обеспечения исследований. Модифицированы
известные методики синтеза, прослежено влияние факторов внешней среды на синтез.
Результаты работы были представлены на международных конференциях.
На 11-й Всеукраинской научной конференции аспирантов и студентов "Охрана окружающей среды и рациональное использование природных ресурсов" (г.Донецк, Украина, 15-17 апреля 2001 года).
На 2-й Международной научной конференции аспирантов и студентов "Охрана окружающей среды и рациональное использование природных ресурсов" (г.Донецк, Украина, 16-18 апреля 2003 года).
Доклад на Международной научной конференции "Химия азотсодержащих гетероциклических соединений" (г.Харьков, Украина, 30 сентября - 3 октября 2003 года).
6.Основные исследования и результаты
В круглодонную колбу с обратным холодильником загружают 94,5 г (1,0 моль) монохлоруксусной кислоты, 83,6 г (1,1 моль) тиомочевины, приливают 250 мл соляной кислоты. Смесь кипятят в течении пяти часов. После охлаждения выпавший осадок отфильтровывают, промывают водой и высушивают. Выход 64,7 %. Белый кристаллический порошок с Тпл.119-120оС. После кристалли-зации из 150 мл воды получают 62,7 г продукта с Тпл. 123-125оС[9].
В трехгорлую круглодонную колбу емкостью 250 мл, снабженную стеклянной пяточковой мешалкой с механическим приводом, шариковым холодильником с хлоркальциевой трубкой, капельной воронкой с уравнителем давления и хлоркальциевой трубкой, при-ливают 10 мл (0,13 моль) абсолютного диметилформамида и при 0-5оС и хорошем перемешивании по каплям добавляют 17,4 мл (0,19 моль) хлорокиси фосфора. В полученный комплекс Вильсмеера вносят 11,7 г (0,1 моль) тиазолидиндион-2,4. Далее убирают охлаждающую смесь, реакционную массу помещают в масляную баню и медленно, в течении 2-х часов температуру повышают до 75оС. Синтез ведут при постоянном перемешивании до заметного уменьшения выделения хлористого водорода (контроль с помощью универсальной индикаторной бумаги), в течении около 20-ти часов. После этого температуру в бане поднимают до 100оС и выдерживают смесь в течении 15 минут. Затем еще теплую реакционную массу (температура около 40оС) порциями при хорошем перемешивании стеклянной палочкой выливают в ледяную воду, отделяя всплывающую в верхней части химического стакана смолистую часть. Выпывший осадок отфильтровывают промывают до нейтраль- Ной реакции по универсальному индикатору водой, отжимают и сушат на воздухе. Выход 5,72 г или 35%. После кристаллизации из хлорбензола Тпл. состовляет 219-221оС [9].
В круглодонную колбу емкостью 500 мл помещают 37,5 г (0,275 моль) карбоната аминогуанидина и 250 мл воды; нагревают до тем-пературы 60оС и порциями вносят 47,5 г (0,375 моль) щавелевой кислоты. Затем смесь нагревают с обратным холодильником в течении 8-ми часов на кипящей водяной бане. После охлаждения до 70оС добавляют 12 г карбоната калия и вновь нагревают в колбе с обратным холодильником в течении 8-ми часов на водяной бане. Горячий раствор фильтруют и фильтрат при энергичном перемеши-вании подкисляют 12,5 мл 10%-ой серной кислоты. Осажденную 3-амино-1,2,4-триазолкарбоновую-5 кислоту отфильтровывают, промывают холодной водой и сушат при температуре 80оС. Выход 22 г или 82%. Продукт представляет собой кристаллическое соединение содержащее 0,5 моль воды; плавится при 182-183оС с разложением [10].
Смесь 2 г дигидрохлорида аминомалондиамидина, 10 мл этил-ортоформиата и 20 мл диметилформамида нагревают с обратным холодильником 15 минут и затем упаривают досуха в вакууме. Остаток растворяют в 50 мл 1Н HCl, смешанной с углем, и фильт-руют. Фильтрат подщелачивают аммиаком (до pH8) упаривают до 15 мл, охлаждают и выделяют 1 г (72%) бесцветного аденина с Тпл. 361оС [11].
Смесь 9,1 г (0,1 моль) тиосемикарбазида и 14,8 г (0,1 моль) этил ортоформиата нагревают на водяной бане 10-12 часов. Затем смесь добавляют к 500 мл кипящего этанола, горячий раствор фильтруют, фильтрат упаривают до 100 мл и охлаждают во льду [12]. Получают 5,8 г или 58%.
В синтезе использовали каталожный 2-амино-5-метоксибензо-тиазол фирмы Acros.
Метод А.
Смесь эквимолекулярных количеств (по 0,01 моль) 4-хлор-5-
формилтиазолин-2-она (1,63 г), ацетата натрия (0,82 г) и тиомоче-вины (0,76 г) кипятят в 10 мл абсолютного этанола в грушевидной колбе на 50 мл, снабженной обратным холодильником и хлоркальциевой трубкой в течении 4 часов. По окончании реакции смесь оставляют на двое суток при комнатной температуре. Выпавший осадок отфильтровывают, промывают этанолом, водой для удаления минеральной части, затем снова этанолом, отжимают и сушат в сушильном шкафу при 105-110оС. Выход 0,67 г или 39%.
После кристаллизации из абсолютного ДМФА Тпл. 305-307оС.
Метод Б.
В коническую колбу на 50 мл помещают 0,01 моль 4-хлор-5-
формилтиазолин-2-она (1,7 г), прибавляют 8 мл метанола и при перемешивании с помощью электромагнитной мешалки добавляют 0,01 моль (1,18 мл) хинолина, выдерживают смесь 30 минут и прибавляют к ней 0,01 моль (0,76 г) тиомочевины и продолжают перемешивание в течении 2-х часов. Выпавший осадок отфильтровывают, промывают диэтиловым эфиром и сушат на воздухе. Из фильтрата при стоянии дополнительно выпадает осадок, который также отфильтровывают и промывают диэтиловым эфиром. Выход 0,77 г или 42%.
Смесь 0,04 моль (0,66 г) 4-хлор-5-формилтиазолин-2-она растворенного в 2 мл абсолютного диметилформамида и 0,008 моль (1,08 г) аденина кипятят в грушевидной колбе с обратным холодильником в течении 5 минут. Выпавший после охлаждения осадок отфильтровывают, промывают сначало диметилформ-амидом, а затем метанолом, отжимают и сушат на воздухе. Выход 0,83 г или 85%.
Смесь 0,002 моль (0,33 г) 4-хлор-5-формилтиазолин-2-она, раст-воренного в 1мл диметилформамида, и 0,004 моль (0,51 г) 3-амино- 1,2,4-триазолкарбоновой кислоты в грушевидной колбе с обратным холодильником выдерживают в течении суток в масляной бане с температурой 70-80оС. Выпавший осадок отфильтровывают, промывают сначало диметилформамидом, а затем метанолом, отжимают и сушат на воздухе. Вещество сверло-коричневого цвета. Выход 0,21 г или 45%.
Смесь 0,002 моль (0,33 г) 4-хлор-5-формилтиазолин-2-она, раст-воренного в 1мл диметилформамида, и 0,004 моль (0,40 г) 2-амино- 1,3,4-тиадиазола в грушевидной колбе с обратным холодильником выдерживают в масляной бане с температурой 70-80оС в течении суток. Выпавший осадок отфильтровывают, промывают сначало диметилформамидом, а затем метанолом, отжимают и сушат на воздухе. Выход 0,04 г или 10%.
Смесь 0,00145 моль (0,24 г) 4-хлор-5-формилтиазолин-2-она, растворенного в 0,75мл диметилформамида, и 0,0027 моль (0,48 г) 2-амино-5-метоксибензотиазола помещают в грушевидную колбу и кипятят с обратным холодильником в течении 15 минут. Выпавший через некоторое время мелкокристаллический осадок темно-коричневого цвета отфильтровывают, промывают диметилформ-амидом, а затем метанолом, отжимают и сушат на воздухе. Выход 0,15 г.
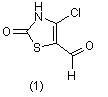
Как следует из химического строения, 4-хлор-5-формилтиазо-лин-2-он (1) содержит два электрофильных центра: С4-атом тиазольного цикла (связь С4 - Cl активирована с одной стороны амидным фрагментом, с другой стороны альдегидной группой и электронноакцепторным влиянием атома серы S1 тиазольного кольца) и атом углерода альдегидной группы.
Указанное позволит проводить достраивание шестичленного цикла в реакциях 4-хлор-5-формилтиазолин-2-она (1) с a-аминоазотсодержащими гетероциклами, тиомочевинами и другими бинуклеофилами по типу 3+3 циклоприсоединения:
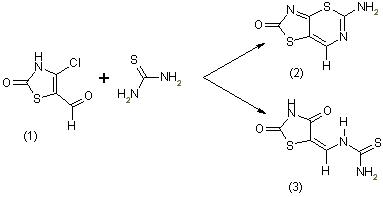
Реакция тиомочевины с 4-хлор-5-формилтиазолин-2-оном (1) может протекать в двух направлениях. Первое направление может приводить к образованию 2-окситиазоло[4,5-d]-2-аминотиазина (2), а второе направление к перегруппировке с переносом оксаниона. Причем продукт перегруппировки (3) наряду с основным продуктом образуется при непосредственном взаимодействии 4-хлор-5-фор-милтиазолин-2-она с тиомочевиной:
А при взаимодействии ионной пары, образованной путем взаимо-действия 4-хлор-5-формилтиазолин-2-она с хинолином, 1-хино-линий-4-хлор-5-формилтиазолин-2-олята (4) с тиомочевинной образуется основной продукт реакции (2):
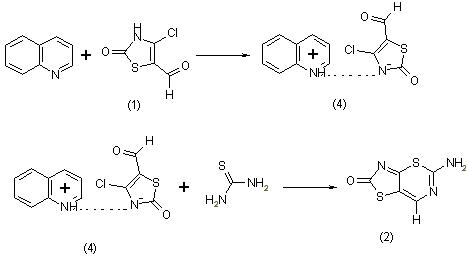
Анализ спектра ПМР продукта взаимодействия хлоральдегида с тиомочевиной подтверждает приписанную соединению (2) структуру: 9,16 м.д., с, 2Н; 8,04 м.д., с,1Н.
Спектр ПМР соединения (3) характеризуется неличием 5 резонан
сных линий: 11,97 м. д., с, 1Н; 10,43-10,37 м. д., д, 1Н; 8,82 м. д., с,
1Н; 8,49-8,43 м.д., д, 1Н; 7,64 м.д., с, 1Н.
Реакция хлоральдегида (1) с аденином (5) приводит к образова-нию 2-оксо-3,7-дигидро-2Н-[1,3]тиазоло[5',4':5,6]пиримидо[2,1-i] пурина (6):
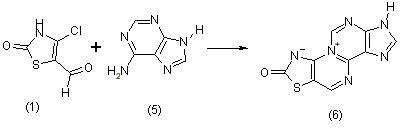
В пользу предложенной структуры свидетельствуют данные ПМР спектроскопии: 8,16 м.д., с, 1Н,; 7,31 м.д., с, 3Н.
Реакция хлоральдегида (1) с 3-амино-1,2,4-триазолкарбоновой кислотой (7) приводит к образованию 8-карбокси-2-оксо-7-гидро-
1Н-[3]тиазоло[5,4-е][1,2,4]триазоло[4,3-а]пиримидина (8):
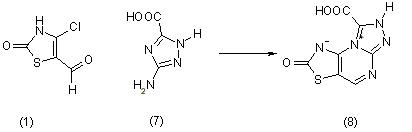
В пользу предложенной структуры свидетельствуют данные ПМР спектроскопии: 7,74 м.д., с, 1Н; 6,20 м.д., с, 1Н.
В результате взаимодействия хлоральдегида (1) с 2-амино-1,3,4-
тиадиазолом (9) нельзя однозначно судить о структуре выделен-ного соединения, однако появление уширенного сигнала в области 13,61-12,23 м.д. (рис. 2.5) позволяет предположить что полученный продукт перегруппировки с участием оксаниона представленный смесью почти равных количеств Z- и E-изомеров (10 а-б):
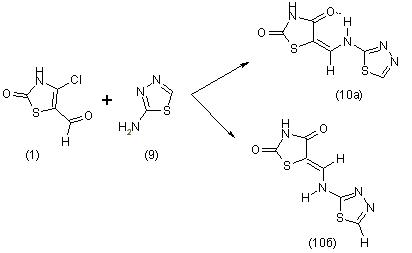
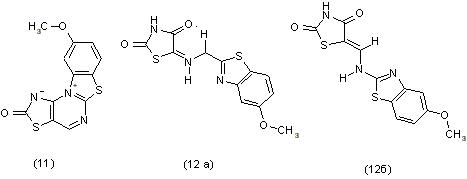
Реакция хлоральдегида (1) с 2-амино-5-метоксибензотиазолом приводит не к образованию 9-метокси-2-оксо-1,2-дигидробензо [4,5][1,3]тиазоло[3,2-а][1,3]тиазоло[5,4-е]пиримидина (11), как это следовало ожидать, а к продукту перегруппировки с участием оксаниона - 5-[(У)-1(5-метокси-1,3-бензотиазол-2-иламино)метили-ден]1,3-тиазолан-2,4-диону, в смеси Z- и Е-изомеров (12 а-б).
Данная исследовательская работа посвящена поиску пктей синтеза конденсированных гетероциклических соединений на базе 4-хлор-5-формилтиазолин-2-она. При анализе априорной информации полученной с применением Internet, а также обнаруженной в научной литературе, были выбраны методы синтеза исходных соединений: тиазолидиндиона-2,4 - путем конденсации тиомочевины с монохлоруксусной кислотой в среде соляной кислоты, 4-хлор-5-формилтиазолин-2-она - взаимодействием тиазолидиндиона-2,4 с комплексом Вильсмеера.
При взаимодействии 4-хлор-5-формилтиазолин-2-она с а-аминоазотсодержащими гетероциклическими соединениями, а также с тиомочевинами получены новые гетероциклические системы которые могут обладать биологической активностью, противовирусными, противоопухолевыми др. свойствами.
8. Нерешенные вопросы и перспективы исследований
Несмотря на то что в научной литературе имеется большой объем информации касающейся свойств В-хлорвинилальдегидов, а также информации полученной в результате проведенных исследований на данном этапе завершенности работы остается ряд нерешенных вопросов связанных с более глубоким изучением химических свойств 4-хлор-5-формилтиазолин-2-она и сравнения его поведения с другими гетероциклическими В-хлорвинилальдегидами на базе азолидонов-4. Так в перспективе планируется установить причины образования продуктов перегруппировки с переносом оксаниона при взаимодействии некоторых а-аминоазотсодержащих гетероциклов с 4-хлор-5-формилтиазолин-2-оном, а также причины образования изомеров. Также планируется провести синтез 4-хлор-5-формилтиазолин-2-она из тиазолидиндиона-2,4 через калийную соль. Использование в синтезе вторичных продуктов коксохимии (пиридина, хинолина, изохинолина и др.) позволит значительно расширить сферу их использования в хозяйственном комплексе.