Автореферат
Магистерской работы Касьянчук Олеси
Тема: Высокотемпературные самораспространяющиеся реакции утилизации некоторых солей кадмия.
Руководитель доц.Шаповалов В.В.
Проблеме очистки и более глубокой переработки промышленныхотходов в настоящее время уделяется огромное внимание во всеммире. В связи с этим, значительные результаты, полученные приизучении структуры, свойств и реакционной способностипероксидных соединений дали возможность их практическогоприменения в качестве источников химически связанного кислорода,по очистке окружающей среды от выбросов в атмосферу вредныхвеществ промышленными предприятиями, водоемов отболезнетворных бактерий, сточных вод ряда производств, отвердениярадиоактивных отходов путем закрепления их в матрице вещества .
Способность образовывать при сплавлении растворимые в водесоединения широко используется в аналитической химии и внекоторых случаях для извлечения ряда металлов из руд.Пероксидные соединения примечательны и тем, что, реагируя свлагой и газообразными соединениями углерода, серы, азота,связывают их, выделяя эквивалентное количество кислорода и темсамым выступают в качестве регенераторов состава воздуха.Практическое использование пероксидных соединений особенновозросло в настоящее время в связи с обнаруженной способностью ксамораспространяющемуся взаимодействию (СРВ) в пероксидно–солевых системах.Теоретическое и экспериментальное обоснованиесамораспространяющихся процессов, в которых освобождающаяся впроцессе химического взаимодействия энергия обеспечиваетсамостоятельное протекание превращений без подвода энергии извне,разработано достаточно полно в связи с их применением вомногих отраслях народного хозяйства и военной технике.
Самораспространяющимся взаимодействием (СРВ) называются такие процессы, которые протекают самопроизвольно после инициирования стабильной при обычных условиях системы кратковременным энергетическим импульсом. Существует два направления их использования: энергетическое и технологическое. В первом случае интерес представляет энергия взаимодействия. Технологическое использование СРВ является одним из перспективных направлений современной химии, позволяющее существенно снизить энергетические затраты при синтезе различных химических соединений или простых веществ.
Замена общепринятых способов получения ряда химических веществ на способы получения их методом СРВ позволило бы значительно сократить энергоемкость производства, снизить продолжительность процесса, отказаться от дорогостоящего оборудования. Одной из плодотворных областей применения СРВ является получение чистых газов, в частности, наиболее необходимого – кислорода. Трудно представить себе область существования или практической деятельности человека без потребления кислорода. Большие количества кислорода выделяются из воздуха или воды для реализации и интенсификации различных технологических или обеспечения жизнедеятельности человека. Известно более десяти способов получения кислорода.
Утилизация солей кадмия представляет собой большой интерес в связи с тем, что они оказывают пагубное влияние на живые организмы.Механизм токсического действия заключается в угнетении активности многих ферментов и в первую очередь ферментов, содержащих сульфгидрильные группы.
После попадания солей кадмия внутрь возникают тошнота, саливация, рвота, боли в животе, понос, мышечные боли, головная боль. Ингаляция паров кадмия приводит к появлению металлического вкуса в полости рта, поверхностному дыханию, болям в груди. У пострадавшего развивается воспаление легких. Исследование мочи обнаруживает гематурию, протеинурию. У больного развивается анемия и лейкопения, страдает функция печени. На вскрытии после ингаляционных отравлений обнаруживают воспаление и отек легких; при поражении через органы пищеварения - тяжелое воспаление желудка, кишечника и повреждения печени и почек.
В случае хронического ингаляционного отравления отмечаются кашель, одышка, похудание, раздражительность, желтое окрашивание зубов, повреждение печени, почек и поджелудочной железы.
Но изучение утилизации солей кадмия представляет также еще и химический интерес.Изучение сложных реакций, которые протикают в режиме самораспространяющегося взаимодействия или синтеза, имеет значительный интерес для развития новых нетрадиционных методов синтеза неорганических соединений или простых веществ. По этой причине поиск новых систем, способных реагировать в режиме самораспространяющегося взаимодействия является актуальной задачей.
Основной целью будующей магистерской работы является утилизация некоторых солей кадмия с помощью высокотемпературных самораспространяющих реакций. В литературе на сегодняшний день изучен сульфат кадмия, а мы планируем изучить перхлорат кадмия. Поведение перхлората кадмия с пероксидными соединениями натрия ранее не было изучено, но существуют некоторые предположения.
Перхлорат кадмия в виде Cd(ClO4)2*6H2O получен из водных растворов при взаимодействии CdO(х.ч.) с 20%-ной хлорной кислотой (х.ч.), взятых в стехиометрических количествах. Взаимодействие протекает по уравнению(1):
CdO+2HClO4=Cd(ClO4)2+H2O (1)
Расчет проводился на 100 г перхлората кадмия. Для получения 100 г вещества необходима навеска оксида кадмия, которая составляет 41,2 г. В синтезе использовалась 60%-ная хлорная кислота и поэтому для получения 20%-ной 69,6 мл кислоты разбавлялись дистиллированной водой объёмом 215 мл.
Полученный раствор перхлората кадмия упаривался на водяной бане до начала кристаллизации и охлаждался. Выпавшие кристаллы отделялись от маточного раствора и подвергались ступенчатой дегидратации в вакууме (остаточное давление около 0,5 мм.рт.ст.) в расплаве при 65-70град. до состава Cd(ClO4)2*2H2O затем в твердом состоянии при 90-120град до полного обезвоживания.
соединений натрия с перхлоратом кадмия
Методами дифференциально-термического анализа (ДТА), термогравимет-рии (ТГ), с использованием ИК-спектроскопии, рентгенофазового анализа и ка-лориметрии изучено взаимодействие Cd(ClO4)2 c NaO2 и Na2O2. Установлено, что взаимодействие между ними протекает через ряд последовательных стадий с образованием Na2O2, NaClO4 и NaClO3 в качестве промежуточных веществ и CdO, NaCl, O2 в качестве конечных продуктов. Предложено математическое описание процесса. Рассчитаны теоретические кривые ДТА и ТГ, соответствующие различным условиям эксперимента.
В работе использовалась установка для термического анализа, с автоматической записью кривых дифференциального термического анализа (ДТА) и термогравиметрического анализа (ТГ) (рисунок 1)
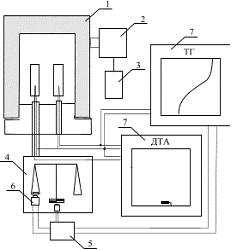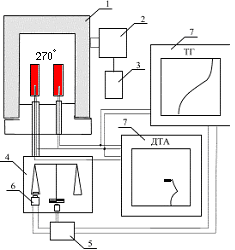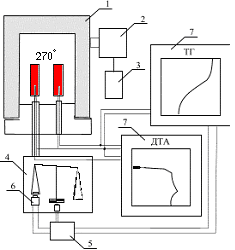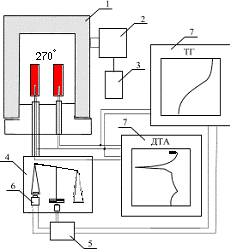
В установке применяли калиброванные хромель-алюмелевые термопары. Основным рабочим узлом установки для одновременной регистрации кривых ДТА и ТГ является печь (1), которая по направляющим опускается на тигли с исследуемым образцом и эталоном. Управление печью осуществляется высокоточным регулятором температуры ВРТ-3 (2), режим работы которого определяется задатчиком (3). В дне каждого из тиглей, изготовленных из термостойкого стекла или никеля, были предусмотрены углубления для ввода термопар. Термопары заключены в керамические трубки. Керамическая трубка с термопарой для эталона запрессована экранирующий блок. Керамическая трубка с термопарой для исследуемого образца связана с коромыслом аналитических весов (4). Сигнал разбаланса весов фиксируется дифференциальным фотосопротивлением и поступает в усилитель (5). В последнем формируется сигнал, поступающий на электромагнит (6), который возвращает весы в состояние равновесия. Напряжение, удерживающее весы в состоянии равновесия, с помощью двухкоординатного самописца типа Н307 регистрируется как изменение массы исследуемого образца. Калибровка весов осуществляется аналитическим разновесом. Скорость нагревания составляла 4 и 15 С/мин. Точность определения температуры термических эффектов составляла ±2°С.
Образцы для анализа готовили, растирая их в агатовой ступке. Масса образцов составляла от 0.2 до 0.4 г. В качестве эталона использовали Al2O3. Во избежание влияния влаги воздуха все образцы для исследований готовились в изолированном боксе с безводным перхлоратом магния в качестве осушителя.
В работе использовался перекристаллизованный перхлорат кадмия, который сушили под вакуумом по методике. Пероксид натрия с содержанием активного кислорода 20% и надпероксид натрия с содержанием активного кислорода 41% использовали без дополнительной подготовки. Композиции Cd(ClO4)2 c Na2O2 или NaO2 готовили в шаровой мельнице, снабженной предохранительной мембраной. Тепловые эффекты определялись на адиабатическом калориметре "Q-202" путем сжигания таблеток из исследуемых композиций в бомбе калориметра. ИК-спектры записывались на спектрофотометре SPECORD 75IR. Съёмку рентгенограмм проводили на дифрактометре ДРОН-УМ1. Кривые ДТА и ТГ записывались при скорости нагрева 15 град/мин с использованием стеклянных и никелевых тиглей и AI2O3 в качестве эталона. Во избежание влияния влаги воздуха образцы для исследований готовились в изолированном боксе с безводным перхлоратом кадмия в качестве осушителя. Взаимодействие безводного Cd(ClO4)2 с NaO2 в условиях ДТА начинается при температуре 270 °С и сопровождается мощным экзотермическим эффектом с разогревом смеси до нескольких сотен градусов и значительной потерей массы (рисунок 2).
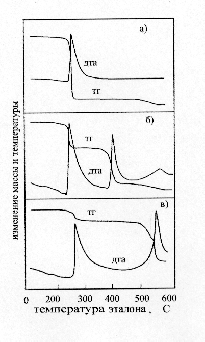
Площадь, ограниченная кривой ДТА, и, как известно, пропорциональная тепловому эффекту процесса, имеет наибольшее значение при мольном соотношении Cd(ClO4)2: NaO2 равном 1:2. Потеря массы при данном соотношении составляет 50%, что хорошо согласуется с уравнением (2):
Cd(ClO4)2 + 2 NaO2 = CdO + 2 NaСl + 5,5О2 (2)Расчетный тепловой эффект данной реакции, равный 339.4 кДж/моль, близок к экспериментально найденному 320±10 кДж/моль. Несколько меньшее значение экспериментального теплового эффекта, по всей видимости, связано с не-полнотой протекания процесса в калориметрических экспериментах. Образование в качестве основных конечных продуктов CdO и NaСl подтверждается рентгенофазовым анализом. Вместе с тем, в поверхностных слоях прореагиро-вавших таблеток ИК-спектроскопически обнаружены полосы, относящиеся к перхлорат-иону. Композиции при мольном содержании NaO2 : Cd(ClO4)2 < 2 разлагаются с выделением в газовую фазу большого количества хлора, что вполне соответствует реакции разложения избыточного Cd(CIO4)2 по уравнению (3):
Cd(ClO4)2 = CdO + Cl2 + 4.5 О2 (3)При увеличении содержания в системе NaO2 (рисунок 1б), на кривых ДТА проявляется три экзотермических эффекта при температурах 270, 400 °С и плохо разрешенный в интервале температур 500–550°С. Всем эффектам соот-ветствует потеря массы образца. ИК-спектры продуктов, образующихся после первого экзотермического эффекта, содержат отчетливо выраженные характер-ные полосы перхлорат-иона в области волновых чисел 1100 см–1, что свидетельствует об отсутствии термической деструкции перхлорат-иона. Рентгенограммы содержат рефлексы соответствующие NaClO4 и CdO. После второго экзотермического эффекта в конечных продуктах преобладает NaCl и CdO[7].
Природа третьего экзотермического эффекта не совсем ясна. Однако, поскольку он наблюдается в системах, содержащих избыточное количество пероксидных соединений натрия, то, вероятно, обусловлен их взаимодействием с материалом тигля. Первому экзотермическому эффекту предшествует незначительный эндотермический эффект при температурах 200–270 °С. Так как он сопровождается потерей массы и отсутствует на термограммах смесей Na2O2 с Cd(ClO4)2, то может быть отнесен к разложению надпероксида натрия в пероксид :
2 NaO2 = Na2O2 + О2На кривых ДТА смесей NaO2 с Cd(CIO4)2 взятых при мольном соотношении 2 : 1, но разбавленных, с целью уменьшения саморазогрева смеси одним из конечных продуктов взаимодействия – CdO, наблюдается два экзотермических эффекта в интервалах температур 260–270°С и 500–600°С и эндотермический – при температуре 200–270°С (рисунок 2в). Как и при избыточном содержании NaO2, после первого экзотермического эффекта основными продуктами взаи-модействия являются перхлорат натрия и оксид кадмия. После второго – NaCl и CdO. Смещение температуры разложения перхлората натрия с 350 °С при из-бытке пероксидных соединений натрия до 600–600 °С при их отсутствии в про-дуктах реакции, объясняется известным фактом [1] каталитического действия кислородных соединений натрия на разложение хлоратов и перхлоратов натрия.
Таким образом, исходя из вышеизложенного, а также учитывая, что перхлорат натрия разлагается через стадию образования хлората натрия ,схему взаимодействия Cd(ClO4)2 с NaO2 можно представить уравнениями (4)-(7):
2 NaO2 = Na2O2 + O2 – 9.21 кДж; (4)Cd(ClO4)2 + Na2O2 = CdO + 2 NaСlO4 + 0,5 О2 + 339.4 кДж; (5)
NaСlO4 = NaСlO3 + 0.5 O2 – 17.7 кДж; (6)
NaСlO3 Ю NaСl + 1.5 O2 + 45.7 кДж. (7)
Систему уравнений (4)–(7) представим следующим образом:
NaO2 = n1 Na2O2 + n2 O2 ; (8)
n3 Cd(ClO4)2 + Na2O2 = n5 CdO+ n4 NaСlO4 + n6 О2 ; (9)
NaСlO4 = n7 NaСlO3 + n8 O2 ; (10)
NaСlO3 = n9 NaСl + n10 O2 ; (11)
где n1 – n10 - массовые стехиометрические коэффициенты, равные соответственно: 0.709; 0.291; 3.992; 3.141; 1.646; 0.205; 0.869; 0.131; 0.549; 0.451.
Тогда уравнения сохранения вещества для системы (4)–(7) будут иметь вид:
Для NaO2: dm1/dt=–m10*k10*EXP(-E1/RT)*f(a1) (12)
Для Cd(ClO4)2: dm2/dt= –m20*k20*EXP(-E2/RT)*f(a2)*n (13)
Для Na2O2: dm3/dt= –n1*(dm1/dt) + (dm2/dt)/ n3 (14)
Для NaClO4: dm4/dt= –n4/n3*(dm2/dt) – (dm6/dt)/n8 (15)
Для NaCIO3: dm5/dt = n7/n8*(dm6/dt) – (dm7/dt)/ n9 (16)
Для O2, получаемого по реакции (12): dm6/dt = n8*k30*EXP(-E3/RT)*m4 (17)
Для NaCl: dm7/dt = n9*k40*EXP7(-E4/RT)*m5 (18)
Уравнение сохранения энергии в системе (4)–(7) для постоянной скорости нагрева цилиндрического образца, при допущении, что в образце отсутствуют значительные градиенты температуры и концентраций реагирующих веществ, а теплообмен образца с печью осуществляется конвекцией и излучением, можно представить уравнением(19):
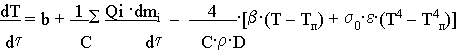 (19)
(19)
где T- текущая температура образца;
С - средняя удельная теплоемкость образца;
b - скорость нагрева;
r, D - плотность и диаметр образца;
s0 - постоянная Стефана-Больцмана;
e - приведенная степень черноты образца;
b - коэффициент конвективного теплообмена между образцом и атмо сферой печи;
Qi - тепловые эффекты, относящиеся, соответственно, к разложению единицы массы NaO2, взаимодействию Cd(ClO4)2 в реакции (5), выделению O2 в реакции (6), образованию NaCl в реакции (7);
Tп = b * t – температура печи.
Расчет системы уравнений (12-18) и построение кривых ТГ и ДТА проводился по программе "ДТА" [1]. При выполнении вычислений использовали следующие теплофизические данные: b=15 град/мин; C=1.255 кДж/(кгЧК); e= 0.75; s0=5.67Ч10–8 Вт/(м2ЧK4); r=1000 кг/м3; D = 0.01 м; b = 5 Вт/(м К); Q1 = –83.7 кДж/кг; Q2 = 1360 кДж/кг; Q3 = –1106 кДж/кг; Q4 = 777.2 кДж/кг.
Степень превращения и температура в образце могут быть легко определены из данных ДТА и ТГ, а значения производной массы по времени – путем численного дифференцирования ТГ-кривой.
Разложение NaClO4 и NaClO3 в присутствии избытка пероксидных соеди-нений натрия подчиняется кинетическому уравнению первого порядка с параметрами: для NaClO4 – Ln k30 = 31.37; E3 = 45 ± 1.3 ккал/моль; для NaClO3 – Ln k40= 29.753; E4 = 44.7 ± 2.1 ккал/моль [ 3 ]. В случае стехиометрических соотношений перхлората магния и пероксидных соединений натрия, разложение образующегося по реакции (5) NaClO4 и, в дальнейшем, NaCIO3 происходит в присутствии оксида кадмия. Так как второй экзотермический эффект (рисунок 2в) наблюдается при температурах меньших, чем для индивидуального NaClO4 то это свидетельствует о влиянии оксида кадмия на процесс разложения перхлората натрия. Одними из наилучших кинетических параметров, позволяющих вполне удовлетворительно описать как процесс разложения NaClO4, так и NaClO3 в присутствии CdO, являются значения k0 и E, равные для NaClO4 – Ln k30 = 28.6+0.4; E3 = 49.8 ± 2.4 ккал/моль; для NaCIO3 – Lnk40= 30.9+0.4; E4 = 53.2 ± 2.7 ккал/моль. Приведенные величины близки соответствующим значениям для разложения NaClO4 и NaClO3 в присутствии NaOH [5]: Результат решения системы уравнений для разложения NaClO4 и для NaClO3 при данных значениях показал (рисунок 3) , что расчетные термографические кривые практически совпадают с экспериментальными.
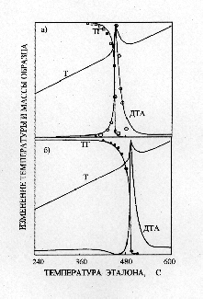
а) мольное соотношение NaClO3 : CdO равно 1:1;
б) мольное соотношение NaClO4 : CdO равно 1:1;
Сплошные линии – расчетные кривые. Точки взяты из экспериментальных кривых ТГ и ДТА.
Решение системы уравнений (12)–(18) для условий, соответствующих различным условиям эксперимента, приведено на рисунке 4.
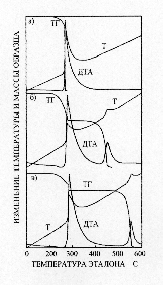
a) мольное соотношение NaO2 : Cd(ClO4)2 = 2 : 1;
б) мольное соотношение NaO2 : Cd(ClO4)2 = 5.5 : 1;
в) мольное соотношение NaO2 : Cd(ClO4)2 = 2 : 1 в присутствии 50% CdO.
При расчете систем с мольным соотношением исходных компонентов равным 2 : 1 (рисунок 4 а, в) использовались значения E и k0 для процесса разложения NaClO4 и NaClO3 в присутствии оксида кадмия. Для кривых на рисунке 3б использовались значения E и k0 процесса разложения хлората и перхлората натрия при избытке пероксидных соединений натрия. Учитывая, что расчет мог быть выполнен только при ряде допущений, можно говорить о вполне удовлетворительном соответствии расчетных термографических кривых с экспериментальными, приведенными на рисунке 1.
В работе использовали CdSO4, который высушивали при 200 градусах. Качество сушки контролировали ИК-спектроскопией. Na2O2 и NaO2 с содержанием активного кислорода 20% и 41%, соответственно, использовали без дополнительной подготовки.
Скорость самораспространяющегося взаимодействия определяли, исходя из высоты образца и времени реакции, после инициирования процесса разогретой тонкой керамической пластинкой. Термический анализ выполнен на установке с автоматической записью кривых ДТА и ТГ при скорости нагрева 15град./мин.
Взаимодействие безводного CdSO4 с Na2O2 в условиях ДТА начинается при 260-262 град. и сопровождается значительным экзотермическим эффектом и незначительной потерей массы (5,6%). Температура начала взаимодействия сульфата кадмия и NaO2 на 2-4 град. выше. Процесс также сопровождается значительным экзотермическим эффектом и потерей массы (15,1%). Более высокая температура обусловлена тем, что происходит разложение супероксида натрия. Сульфат кадмия не имеет фазовых переходов, поэтому температура начала взаимодействия, как и в случаях других сульфатов, обусловлена изменениями, которые происходят с пероксидными соединениями натрия.
При мольном соотношении компонентов CdSO4:NaO2=1:1 в продуктах взаимодействия с помощью рентгенофазового анализа найден оксид кадмия и сульфат натрия. Таким образом, данные рентгенофазового анализа, ДТА и ТГ позволяют описать процессы, которые происходят в системе CdSO4 - NaO2, такими уравнениями реакций:
2NaO2 = Na2O2 + O2, (20)
CdSO4 + Na2O2 = Cdo + Na2SO4 + 1/2 O2 (21)
В связи с этим, рассмотрение систем CdSO4 - Na2O2, NaO2 сводится к изучению взаимодействия сульфата кадмия и пероксида натрия. При стехиометрических соотношениях компонентов, соответствующих уравнениям реакций (20-21), в системе Na2O2 -CdSO4, скорость перемещения фронта горения составляет 21 мм/хв.
В условиях ДТА взаимодействие Na2Cd(SO4)2 с пероксидом натрия в мольном соотношении 1:1 начинается при 295-300 град.[4] Было сделано допущение, что Na2Cd(SO4)2 образовуется только как промежуточный продукт, апроцесс протекает по схеме, аналогичной схеме взаимодействия супероксида натрия с сульфатом меди:
2NaO2 = Na2O2 + O2 (22)
2CdSO4 + Na2O2 = Na2Cd(SO4)2 + 1/2O2 (23)
NaCd(SO4) +Na2O2 = CdO + 2Na2SO4 +1/2O2 (23).
Значения расчетных скоростей самораспространяющегося взаимодействия по схеме (22-23) значительно отличаются от данных эксперимента. РФА продуктов самораспространяющегося взаимодействия систем CdSO4 - Na2O2 при соотношении 2:1 показал наличие CdO,CdSO4, Na2SO4. ДТА показал наличие фазового перехода сулбфата натрия при 241 град. и отсутствие любых эффектов после 500 град., характерных для соли Na2Cd(SO4)2. После нагрева продуктов взаимодействия при 700 град. ДТА показал отсутствие эндоэффекта, характерного для сульфата натрия, и появление выше 500 град. эндоэффектов, которые можно отнести к фазовым переходам комплексной соли.
Итак, исходя из приведенных данных, можно сделать вывод, что взаимодействие сульфата кадмия с пероксидными соединениями натрия проходит без образования комплексных соединений.
с хлоратами и перхлоратами металлов
Пероксиды и супероксиды играют ведущую роль в качестве источника О2 при нагревании в смеси с другими генераторами кислорода . В смеси с хлоратом натрия Na2O2 используют как добавку (от 0.5 до 20 вес.%), препятствующую, по мнению И.И.Вольнова[2] , выделению Cl2. Кислородные соединения натрия катализируют разложение хлоркислородных солей натрия. В смесях с перхлоратами лития и кальция [3], цинка, кадмия, марганца, кобальта и никеля они обеспечивают протекание высокоэкзотермических реакций.
NaClO4 и NaClO3 при нагревании ускоряют распад твердого NaO2 . Супероксидный кислород полностью выделяется при 140-190°С. Объяснения причин снижения термической стабильности NaO2 не найдено. Действие NaO2 и Na2O2 на разложение NaClO4 и NaClO3 одинаково, так как NaO2 превращается в Na2O2 до термических превращений NaClO4 и NaClO3. Сильные окислители ClO4- и ClO3- - окисляют оксидный ион O2- до O2- и далее до O2-. Каталитическое действие Na2O2 на термический распад NaClO4 и NaClO3 объясняется уравнениями (24), (25) и (26):
2 NaClO4 + Na2O2 = 2 NaClO3 + 2 NaO2, (24)
2 NaClO3 + Na2O2 = 2 NaClO2 + 2 NaO2, (25)
2 NaO2 = Na2O2 + O2. (26)
Основанием послужил факт образования в смесях NaClO4–Na2O2 и NaClO3–Na2O2 значительных количеств NaO2. В чистом виде более стабилен NaClO4, но в присутствии Na2O2 он разлагается быстрее, чем NaClO3. В связи с изменением относительной стабильности NaClO4 и NaClO3 распад NaClO4 становится отчетливо двухстадийным:
NaClO4 Ю NaClO3 + 1/2 O2,
NaClO3 Ю NaCl + 3/2 O2.
В распаде NaClO3 перестает играть какую-либо роль диспропорционирование на перхлорат и хлорид. Установлено , что распад хлората натрия в составе смесей Na2O2:NaClO3 і 0.1 формально описывается кинетическим уравнением 1-го порядка вплоть до a=0.9 с параметрами Аррениуса Ea=44.7±2.1 ккал/моль и lgA=14.7±1.1 мин-1. Распад перхлората натрия в составе смесей Na2O2:NaClO4 і 0.1 описывается уравнением 1-го порядка в интервале a=0.5-0.9; Ea=45.0±1.3 ккал/моль, lgA=15.4±0.5 мин-1. Уравнение Пру-Томпкинса пригодно в более широком интервале степеней превращения: при температурах до 300°С имеются два линейных участка с границей a=0.35; выше 300°С константа скорости постоянна в интервале a=0-0.85. Для степени разложения a Ј 0.35 параметры Аррениуса Ea=51.1±2.0 ккал/моль и lgA=17.8±0.8 мин-1, для a=0.35-0.85 Ea=43.9±2.0 ккал/моль, lgA=15.1±1.2 мин-1. При разложении смесей Na2O2–NaClOn происходит накопление NaO2, обусловленное образованием твердого раствора NaO2 в NaCl, в котором стабильность NaO2 выше, чем в свободном состоянии [4]. В составе твердого раствора (»10 мол.% NaO2) разложение последнего идет лишь при 400-450°С. NaO2 в составе твердого раствора катализирует распад NaClOn, но действие его слабее, чем Na2O2.
При нагревании смесей LiClO4:NaO2 = 1:1 на кривой ДТА регистрируется экзотермический эффект с началом при 170°С , переходящий в эндотермический эффект при 190-203°С. При избытке супероксида (LiClO4:NaO2 = 1:1.3) в интервале 170-215°С выделяется весь супероксидный кислород. На кривой ДТА смеси LiClO4+0.55 Na2O2 фиксируется три максимума 175, 205 и 225°С, но выделения газа до температуры ~300°С не происходит. По мнению авторов , перечисленным превращениям в интервале 170-220°С соответствует суммарная обменная реакция(27):
LiClO4 + NaO2 Ю ? Li2O2 + NaClO4 + 1/2 O2 (27)
Первоначально возникающий LiO2 мгновенно распадается по уравнению(28):
2 LiO2 = Li2O2 + O2. (28)
Аналогичная обменная реакция протекает и с пероксидом натрия:
LiClO4 + 1/2 Na2O2 = 1/2 Li2O2 + NaClO4 (H298= -63.2 кДж)
Таким образом, до 300°С процессы, протекающие в смесях LiClO4 + NaO2 и LiClO4 + 1/2 Na2O2, не нарушают целостности аниона ClO4- и пероксид-иона – разрушается только супероксид-ион. Выше 300°С идет распад образовавшихся Li2O2 и NaClO4 до Li2O и NaCl.
Превращения в смеси Ca(ClO4)2 и NaO2 начинаются с эндотермического распада NaO2 в интервале 150-200°С, после чего газовыделение прекращается. При 270-275°С начинается экзотермический эффект, заканчивающийся около 340°С. В промежутке на кривой ДТА появляются два излома при 295-300 и 320°С. Вторая стадия газовыделения начинается около 300°С и идет до 450°С. Таким образом, обменная реакция
Ca(ClO4)2 + Na2O2 = СаO2 + 2NaC1O4 (H298= -180 кДж)
протекает полностью или в значительной степени. Вслед за основным экзотермическим эффектом следует эндотермический эффект 340-365°С плавления NaClO4 и разложения СаO2 = CaO + 1/2 O2(H298 = +26.8 кДж). После него на кривой ДТА появляются еще два максимума при 385 и 450°С обусловленные распадом NaClO4. Каталитическое действие СаO2 и CaO приводит к понижению температуры распада NaClO4 на 75°С. В смесях LiClO4+NaO2+Na2O2 и Са(ClO4)2+NaO2+Na2O2 возможно протекание самораспространяющейся реакции со значительным объемным и весовым выходом кислорода.
Самораспространяющееся взаимодействие перхлората кадмия с пероксидными соединениями натрия в литературе не изучено, т.е. в данной работе впервые затронут вопрос утилизации перхлората кадмия. В магистерской работе планируется также изучение хлорида кадмия. На данный момент работа только начата, а именно: произведен синтез перхлората кадмия, сушка, которого вызвала большие трудности, а также получены некоторые термограммы.
В литературе изучены характеристики самораспространяющегося взаимодействия между различными перхлоратами металлов и пероксидными соединениями. И среди этих данных есть предположения поведения перхлората кадмия, следовательно, в результате нашего эксперимента мы либо подтвердим эти данные, либо опровергнем.- Шаповалов В.В. определение кинетических параметров интенсивных экзотермических твердофазных реакций // Укр. хим.журн.-2000.-Т.66,-№7.-С.31-36
- Вольнов И.И. Перекисные соединения щелочных металлов. –М.: Наука, 1980. –160с.
- Никитина З.К., Росоловский В.Я. Взаимодействие пероксидных соединений натрия с перхлоратами цинка, кадмия, марганца, кобальта и никеля // Журн.неорган.химии. –1996. -Т.41. – № 7. – С.1080-1083
- Шаповалов В.В., Гороховский А.Н., Бажутина Ю.В. Кинетика и механизм самораспространяющегося взаимодействия сульфата меди с пероксидными соединениями натрия//Сб. трудов ДонГТУ. Сер. Химия и хим. технология. - 2000ю - Вып. 12 - С. 63 - 70.
- Роде Т.В., Гольдер Г.А. Физико-химическое изучение системы надперекись натрия – окись натрия // Изв. АН СССР. ОХН. –1956. – №3. -С.299-308.
Вверх