Баева Дарья Николаевна
Автореферат магистерской работы:
"Создание компьютерной системы для оценки функционального состояния клетки на примере нейтрофилов"
Научный руководитель: профессор кафедры АСУ ДонНТУ, заведующий научно-исследовательской лаборатории Института проблем семьи Донецкого государственного медицинского университета, кандидат химических наук, доктор биологических наук Герасимов Игорь Григорьевич
![]()
Цель магистерской работы
Целью данной магистерской работы является автоматизация процесса оценки функционального состояния клетки и детализация результатов оценки.
Актуальность работы
Оценка степени жизнеспособности клетки является актуальной задачей. На сегодняшний день существуют различные методы и системы для оценки функционального состояния клеток. Одним из таких методов является оценка доли включений какого-либо вещества в клетку. В отличие от других методов, в которых исследуются совокупности клеток и делается вывод по их электрическим и оптическим свойствам, данный метод основан на работе с изображениями клеток, что позволяет учитывать свойства каждой клетки в отдельности.
На данный момент все расчеты ведутся вручную. Это очень трудоемкий процесс. Оценка заполнения нейтрофила диформазаном производится специалистами визуально, что может свидетельствовать о достаточно большой погрешности в результатах исследования. Компьютеризация данного процесса может значительно расширить возможности врача-исследователя, позволяя ему рассматривать клетки не только с позиции отнесения их к одной из четырех групп активности (0, 1, 2, 3 балла).
Объект исследования
Объектом исследования (ОИ) являются нейтрофилы крови человека (рисунок 1).
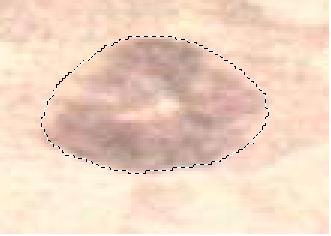
Рисунок 1. Снимок нейтрофила крови человека.
Нейтрофилы — самая большая группа белых кровяных телец, они составляют 50-75% всех лейкоцитов. Свое название они получили за способность их зернистости окрашиваться нейтральными красками. В зависимости от формы ядра нейтрофилы делятся на юные, палочкоядерные и сегментоядерные, имеющие две и более долей.
В лейкоцитарной формуле юные нейтрофилы составляют не более 1%, палочкоядерные — 1-5 %, сегментоядерные — 45-70 %.
Нейтрофилы созревают в костном мозге в течение 6-11 дней, после чего выходят в кровяное русло, где передвигаются током крови и дозревают около 10 часов. В крови циркулирует не более 1 % имеющихся в организме нейтрофилов. Основная их часть сосредоточена в тканях. Наряду с этим в костном мозге имеется резерв, превосходящий число циркулирующих нейтрофилов в 50 раз. Выброс их в кровь происходит по первому требованию организма.
Основная функция нейтрофилов — защита организма от проникших в него микробов и их токсинов. Нейтрофилы первыми пребывают на место повреждения тканей. Их появление в очаге воспаления связано со способностью к активному передвижению. Они проходят через стенку капилляров и активно перемещаются в тканях к месту проникновения микробов. Затем нейтрофилами производится активный захват и поглощение чужеродных элементов, так называемый фагоцитоз. Фагоцитоз – одна из защитных реакций организма, проявляется, главным образом, при воспалении, открыт в 1883 г. И. И. Мечниковым.
Тест восстановления нитросинего тетразолия (НСТ-тест)
Оценка состояние фагоцитарной активности нейтрофилов производится по результатам постановки спонтанного и стимулированного теста с нитросиним теразолием (НСТ-тест). Нитросиний тетразолий поглощается нейтрофилами и под влиянием их дегидрогеназной системы бесцветный НСТ восстанавливается в темно-фиолетовые гранулы диформазана. Цитоплазма окрашивается в розоватый цвет (рисунок 2).
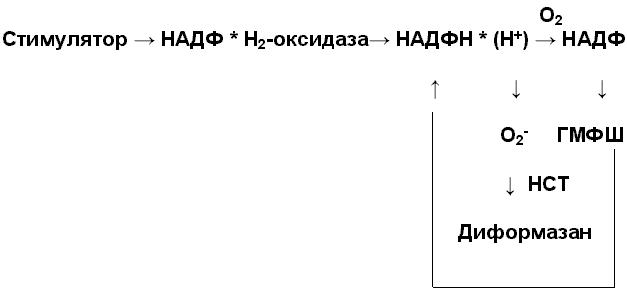
Рисунок 2. Схема событий, приводящих к образованию диформазана.
Стимуляция нейтрофилов экспресирует НАДФ * Н2-оксидазу; та в свою очередь, катализируя НАДФ * Н2 до НАДФ, активирует гексомонофосфатный шунт (ГМФШ), в процессе которого нарабатывается новая порция НАДФ * Н2 и замыкается положительная обратная связь. НАДФ * Н2 служит источником электронов, переводящим молекулярный кислород в супероксидный анион, который и восстанавливает НСТ до диформазана.
Сравнительное изучение этой реакции при спонтанном и стимулированном НСТ-тестах позволяет судить о функциональной активности нейтрофилов и потенциальных ресурсах системы фагоцитоза. По современным данным эти сведения являются одними из наиболее важных показателей состояния неспецифической защиты организма.
Оценка результатов теста
С помощью светового микроскопа исследуют каждую клетку. Для оценки результатов в 100 клетках подсчитывают долю активированных нейтрофилов (ДАН, %), содержащих включения диформазана.
Каждый из изученных нейтрофилов по интенсивности реакции (по количеству выпавшего диформазана) относят к одной из четырех групп, состоящих из клеток с активностью 0 (0% заполнения), 1 (0...30% заполнения), 2 (30…50% заполнения) и 3 (50…100% заполнения) балла. Затем рассчитывается индекс активации нейтрофилов (ИАН, усл. ед.) по формуле:
![]()
где Н0, Н1, Н2, Н3 – количество нейтрофилов с активностью 0, 1, 2, 3 балла соответственно.
В норме ДАН не должна превышать 12% и 30% для спонтанного и стимулированного НСТ-тестов соответственно. Несоответствие этого показателя предусмотренным нормам позволяет говорить о нарушениях функционирования организма и о патологиях.
Задача магистерской работы
Задача данной магистерской работы заключается в нахождении доли заполнения нейтрофила диформазаном. Она решается с помощью методов цифровой обработки изображения и представляется в виде совокупности подзадач: повышение качества введенного изображения, определение его гистограммных признаков и, наконец, нахождение порогового ограничения яркости, соответствующего участку клетки, заполненному диформазаном.
Цифровая обработка изображения
Первичная обработка изображения сводится к улучшению его качества. Снимки клеток, как правило, содержат много ненужной информации – посторонних включений. Повышения качества снимков можно добиться за счет замены лабораторного оборудования на более качественное. Однако это экономически не выгодно. Поэтому, чаще всего, используют программные методы улучшения качества изображения.
В начале, для получения более точного значения необходимого порога яркости, необходимо избавиться от шумов на снимке (сделать его более контрастным). Они хорошо видны на гистограмме.
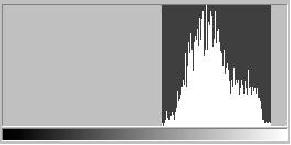
Рисунок 3. Гистограмма распределения яркости изображения.
Существуют различные методы контрастирования изображения. Их делят на линейные и нелинейные. К линейным методам, например, относятся оператор «Лапласа». Его суть состоит в том, что к снимку применяются различные маски (2), (3) и (4):
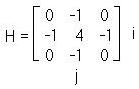 (2)
(2)
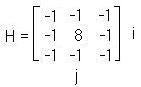 (3)
(3)
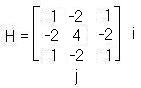 (4)
(4)
К нелинейным методам контрастирования изображения относят оператор Робертса, оператор Собеля, метод Уолеса. Каждый из них имеет свои преимущества и недостатки. Однако при анализе результатов различных методов применяемых к данному нам изображению был сделан вывод о том, что даже самые простые методы дают хорошие результаты. Поэтому использование более сложных методов контрастирования нецелесообразно.
Гистограммный пороговый фильтр
В данном случае анализируется цветной снимок (в формате RGB), на котором расположены нейтрофил, окрашенный более темным цветом, и эритроциты, окрашенные менее интенсивно. Если использовать методы фильтрации изображения, основанные на его переводе в монохромное, например пороговый метод фильтрации, то велика вероятность потери очень важных характеристик жизнедеятельности клетки. Поэтому клетку необходимо анализировать в первоначальном, исходном полученном цвете.
Для выявления области нейтрофила, содержащей включения диформазана целесообразно применить гистограммный пороговый фильтр. Данный метод основан на построении гистограммы интенсивностей по значениям интенсивности каждой составляющей цвета (красный, зеленый, синий), выявления пиков, удовлетворяющих условиям заданного порога. Результатом данного метода является битовая матрица, построенная из условия (5):
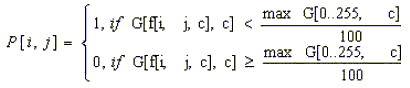 (5)
(5)
где G[k, c] – значение пика с интенсивностью k для цвета с,
f[i, j, c] – значение интенсивности i, j пикселя изображения для цвета с,
maxG[0..255, c] – максимальное значение на гистограмме для цвета с,
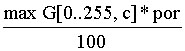 – величина
порога по гистограмме для цвета с,
– величина
порога по гистограмме для цвета с,
por – пороговое значение, задаваемое в диапазоне [1..99].
Пороговое значение выбирается после визуальной оценки гистограммы на предмет разброса значений интенсивностей цветов (контрастности) совместно с предполагаемой площадью занимаемой клеткой относительной общего размера снимка.
Данный гистограммный пороговый фильтр является очень эффективным в решении такого рода задач, так как имеет большую устойчивость к размытости границ клетки на снимке. Метод не чувствителен к неоднородностям различного характера: цвет, форма, вкрапления.
Перспективы исследований в данном направлении
После определения порога яркости, соответствующего включениям диформазана в нейтрофиле, и накоплении сведений о параметрах изображения клеток с разной активностью, можно будет судить об активности клетки по интенсивности окрашивания выделенной области.
Заключение
Методы и алгоритмы, используемы мною при решении научной задачи, являются достаточно простыми. За счет этого достигается большая скорость получения результатов. Следует также отметить и то, что программные методы анализа изображения являются более достоверными и детализированными, в отличии от ручных.
Источники
1. Гистология. Кровь. http://agat.aorta.ru/44/440003.htm
2. Нагоев Б.С., Лаб, дело, 1983, № 8, 7—11
3. Бажора Ю.И., Тимошевский В.Н., Протченко П.3., Головченко А.Н. «Лабораторное дело», 1981, № 4, с. 198—200
4. Цитохимические исследования лейкоцитов. Тест восстановления нитросинего тетразолия (НСТ-тест).
5. Прэтт У.К. "Цифровая обработка изображений". - М.: Мир, 1982. T.I.-2. 792 с.
6. Спорыхин В.Я., Адамова Е.В., Герасимов И. Г. Выбор критерия определения жизнеспособности клеток для автоматизированной системы диагностики. Наукові праці ДонДТУ, Донецьк, 2000, випуск 20, с. 224-230
