 |
|||
|
Результаты анализа Борисенков А.Д. Методика обработки полученных данных Расчет теплоты фазового перехода Итак, кристаллизация – это процесс перехода вещества из жидкого состояния в твердое. Процесс кристаллизации связан с выделением количества теплоты, равного теплоте плавления. Для химически чистых веществ процесс кристаллизации протекает при постоянной температуре, равной температуре плавления, что видно из графиков кристаллизации резорцина, представленных в приложении. В процессе кристаллизации упорядочивается движение частиц жидкости, постепенно прекращается перемещение молекул, возникают связанные тепловые колебания относительно узлов кристаллической решетки. Для начала кристаллизации необходимо, чтобы в жидкости имелись центры кристаллизации – неоднородности, вокруг которых начинается процесс образования твердой фазы. Если в жидкости отсутствуют центры кристаллизации, то она может быть охлаждена до температуры более низкой, чем температура кристаллизации, что также можно увидеть из кривых охлаждения резорцина. Количество теплоты, которое необходимо
отвести от единицы массы жидкости при температуре кристаллизации для
перехода жидкости в твердое состояние, называется удельной теплотой
кристаллизации
где Поскольку при переходе из жидкого в
твердое состояние объем резорцина практически не меняется, имеем
Энтропия – функция состояния термодинамической системы. Изменение энтропии в равновесном процессе равно отношению количества теплоты, сообщенного системе, к термодинамической температуре системы:
Энтропия определяется с точностью до постоянной величины. Разность энтропий в двух состояниях при обратимом процессе равна
где
где Из (3) и (4) следует, что
или
В процессе кристаллизации происходит упорядочивание структуры вещества, внутренняя энергия вещества уменьшается, что и приводит к убыванию энтропии системы. Простейшей моделью охлаждения тела
является охлаждение в среде с постоянной температурой Применим закон сохранения энергии к квазистатическому процессу охлаждения твердого резорцина после кристаллизации:
где Применяя закон сохранения энергии к процессу кристаллизации резорцина, можно получить уравнение
здесь Из соотношений (6) и (7) следует, что
Следовательно, для определения В принятой модели процесс охлаждения твердого резорцина от точки полной кристаллизации описывается уравнением (6). Решение этого уравнения имеет вид:
Производная данной функции, после преобразования следующая:
Подставив (11) в (8), получим:
В результате компьютерной обработки, в связи с видом уравнения (10), была получена аппроксимирующая функция охлаждения резорцина после затвердевания, подобранная при помощи программного пакета TableCurve Windows v1.10, которая имеет вид:
Производная этой функции имеет вид:
таким образом, m из (12) численно равно b из (14).
Подбор аппроксимирующих кривых Подбор аппроксимирующих кривых к полученным графикам зависимости температуры резорцина от времени осуществлялся в два этапа: подбор кривой охлаждения до начала процесса кристаллизации и подбор кривой после полной кристаллизации резорцина. В разработтаном программном обеспечении корме вывода текущей температуры на экран осуществляется также запись её в файл. Последующая обработка файла записи температуры производится в табличном процессоре Microsoft Excel. На основе значений температуры в определенные моменты времени строятся графики зависимости. Подбор аппроксимирующей кривой до начала процесса кристаллизации Как видно из графиков зависимости температуры от времени (приложение Б), все опыты сопровождались переохлаждением расплава до начала его кристаллизации в приборе Жукова. Таким образом, для подбора аппроксимирующей кривой необходимо обработать участок записей файла до начала резкого возрастания значений температуры. Для этого необходимо создать новый файл таблиц, в который скопировать описанный выше участок записей. Вновь созданный файл необходимо сохранить в текстовом формате с разделителями табуляции, для возможности открытия и последующей обработки его в программном пакете TableCurve Windows v1.10. Затем производится подбор аппроксимирующей кривой. Для описания процесса остывания резорцина, как было сказано выше, использовалось уравнение зависимости температуры вещества от времени вида:
Таким образом, подбор кривой сводится к определению в TableCurve Windows v1.10 коэффициентов a и b. Подбор аппроксимирующей кривой после полной кристаллизации вещества На графике зависимости температуры вещества от времени визуально отмечается момент полной кристаллизации вещества, и из файла записи копируется в новый табличный файл участок от отмеченного момента до окончания записи. Указанный участок аналогично сохраняется и обрабатывается в TableCurve Windows v1.10 для подбора коэффициентов a' и b', характеризующих процесс остывания кристаллического вещества. На исходные графики зависимости температуры вещества от времени наносятся графики функций полученных аппроксимирующих кривых.
Обработка полученных данных Исходные данные Масса исследуемого вещества m0=10 гр, масса прибора Жукова m1=82,6 гр. Температура кристаллизации резорцина, определенная по кривым охлаждения и усредненная из 3-х опытов – 120 С. Температура окружающей среды – 22 С. Теплоемкость резорцина 1,366 Дж/(г*К), теплоемкость стекла – 0,79 Дж/(г*К). Экспериментальные данные При подборе аппроксимирующих кривых в TableCurve Windows v1.10 было найдено несколько подходящих уравнений, описывающих зависимость температуры закристаллизовавшегося резорцина от времени, в соответствии с видом уравнения (10). Наиболее подходящие функции имеют следующий вид: а) б)
Аппроксимирующие функции, описывающие зависимость температуры вещества от времени до начала процесса кристаллизации: а) опыт №1 б) опыт №2 в) опыт №3 Расчет теплоты фазового перехода Рассчитаем значение теплоты кристаллизации для каждого опыта используя коэффициент уравнения а):
Средняя теплота фазового перехода для 3-х опытов:
Погрешность для каждого опыта:
Рассчитаем значение теплоты кристаллизации для каждого опыта используя коэффициент уравнения б):
Средняя теплота фазового перехода для 3-х опытов:
Погрешность для каждого опыта:
Расчет изменения энтропии Рассчитаем изменение энтропии, используя параметры уравнения а):
Рассчитаем изменение энтропии, используя параметры уравнения б):
1. Сивухин Р.В. Общий курс физики: В 3 т. Т.2. Термодинамика и молекулярная физика. М., 1976.
|
|||||||||||||||||
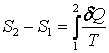 ,
(3)
,
(3) 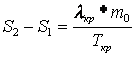 ,
,
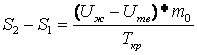 .
(5)
.
(5) 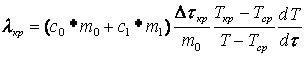 ,
(8)
,
(8) 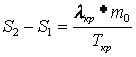 .
(9)
.
(9) 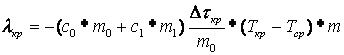 .
(12)
.
(12) 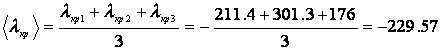 Дж/г
Дж/г
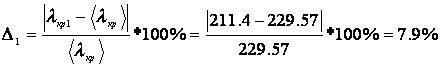
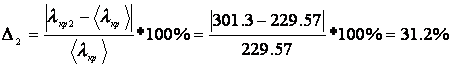
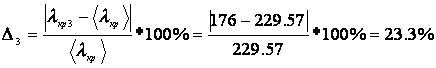
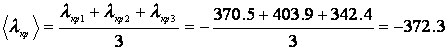 Дж/г
Дж/г
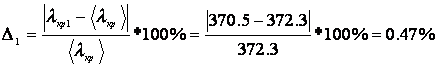
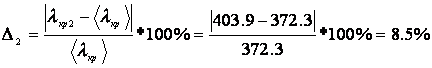
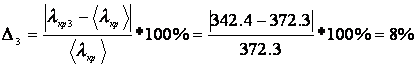
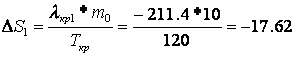 Дж/К
Дж/К
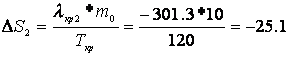 Дж/К
Дж/К
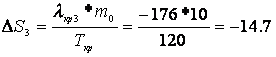 Дж/К
Дж/К
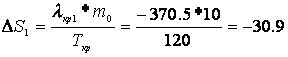 Дж/К
Дж/К
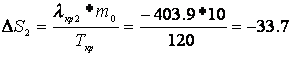 Дж/К
Дж/К
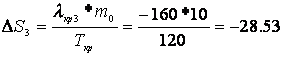 Дж/К
Дж/К