crocodile@mir.dn.ua
tigerdana@gmail.com
Литвинова Дарья Алексеевна
Донецкий национальный технический университет
Факультет информационных технологий и автоматики
Специальность: «Научные аналитические и экологические приборы и системы»
Тема выпускной работы: «Обоснование структуры экстракционного фотометра системы контроля сточных вод промышленных предприятий»
Научный руководитель: к.т.н., доцент Хламов Михаил Георгиевич

Тема магистерской работы: «Обоснование структуры экстракционного фотометра системы контроля сточных вод промышленных предприятий»
Актуальность темы
На всех стадиях своего развития человек был тесно связан с окружающим миром. Но с тех пор как появилось высокоиндустриальное общество, опасное вмешательство человека в природу резко усилилось, расширился объём этого вмешательства, оно стало многообразнее и сейчас грозит стать глобальной опасностью для человечества.
Промышленные стоки занимают первое место по объему и ущербу, который они наносят. Поэтому решать проблему сбросов их в реки нужно в первую очередь. Из-за загрязнения, вызываемого стоками, начинаются различные биогенные мутации. Из рек и озер пропадают многие виды рыбы, а те которые остаются - непригодны в пищу. Значительно скудеет флора и фауна водоемов. Из-за промышленных стоков в водоемах наблюдается избыток кислорода, поэтому можно наблюдать так называемое «цветение» водоемов.
По данным управления статистики на 2006 год объем сточных вод Донецкой области превышает 1,6 млрд.м3 на год, из которых 40% загрязнены (не отвечают установленным требованиям).
На протекание естественных процессов в воде большое влияние оказывает содержание в ней тяжелых металлов. Радченко Н.Н., Мнускиной В.В. были проведены исследования, целью которых являлась количественная оценка загрязнения реки Кальмиус тяжелыми металлами [1]. Результаты данного исследования показали, что одним из тяжелых металлов, требующих оперативного контроля, является Сr+6, поступающий в водоемы со сточными водами гальванических цехов машиностроительных, авиационных, автомобильных заводов, предприятий химической, кожевенной промышленности и пр.
В речных загрязненных и слабозагрязненных водах концентрация Сr+6 колеблется от нескольких десятых долей мг/дм3 до нескольких мг/дм3. Из-за высокой токсичности содержание Сr+6 в водоемах нормировано и не должно превышать ПДК, равной 0,05 мг/дм3 [2]. Одним из обязательных условий контроля содержания Сr+6 в природных водах является оперативность его определения, так как хранение проб невозможно в связи с переходом +6 в анаэробных условиях в Сr+3.
Связь с научными программами, планами и темами
Работа выполняется в соответствии с научными разработками кафедры «Электронная техника»:
- Гостема Г6 – 2000 «Разработка методов контроля параметров водных сред систем экологического мониторинга»;
- Гостема Д21 – 2003 «Разработка методов и средств измерения и контроля параметров воды в каналах водоснабжения».
Цель и задачи работы
Цель работы – разработать прибор для оперативного контроля содержания ионов хрома (Сr+6) в сточных водах промышленных предприятий на участке сброса вод.
Задачи работы – анализ методов и средств измерения концентрации хрома в сточных водах; выбор метода измерения, на основе которого будет разрабатываться прибор; оценка степени влияния влияющих факторов (рН и температуры) на измерение концентрации ионов хрома Сr+6 в сточных водах; разработка математической модели оптического канала измерения. Решение данных задач – основа для разработки структурной схемы экстракционного фотометра системы контроля сточных вод промышленных предприятий.
Идея работы
Для определения концентрации ионов хрома (Сr+6) выбран экстракционно-фотометрический метод, при котором концентрации ионов хрома (Сr+6) определяется по интенсивности окраски окрашенных соединений. Так как в качестве экстракта выбрана суспензия, то прошедший через нее поток быстро затухает, и поэтому в качестве информативного параметра был выбран отраженный поток, который зависит от длины волны источника излучения и концентрации ионов хрома.
Научная новизна работы
Математическая модель описывает средство измерения, воздействие влияющих факторов на процесс измерения и позволяет оценить метрологические характеристики средства измерения.
Практическая ценность
С учетом математической модели разрабатывается структурная схема средства измерения. Математическая модель обеспечивает учет влияющих факторов и повышенную точность рабочего средства измерения.
Основной материал работы
Существуют следующие методы, используемые для анализа содержания тяжелых металлов в воде: потенциометрический метод, полярографический метод, атомно-абсорбционный метод, рентгеноспектральный метод, экстракционно-фотометрический метод.
Потенциометрический анализ — метод определения концентрации ионов, основанный на измерении электрохимического потенциала индикаторного электрода, погруженного в исследуемый раствор.
Полярографический метод применяется для определения небольших количеств металлов в сплавах, рудах, шлаках и других материалах металлургического производства. Этим методом можно определять одновременно катионы разных металлов, не прибегая к предварительному их разделению, но необходимо, чтобы восстановление катионов этих металлов происходило при разных потенциалах. Полярографируя такую смесь, получают несколько полярографических волн. На рис. 1 приведена полярограмма раствора, содержащего катионы кадмия, цинка и марганца; по ней можно определить концентрацию катиона каждого металла. Для этого измеряют высоты всех трех волн и сопоставляют их с высотами волн, полученных при полярографировании смеси растворов тех же катионов с известной концентрацией.
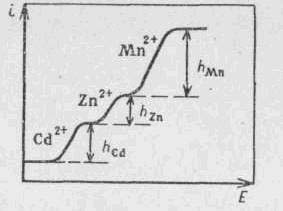
Рисунок 1 - Полярограмма смеси растворов солей кадмия, цинка и марганца
Атомно-абсорбционный анализ (ААА) является одним из наиболее распространенных методов аналитической химии. Предварительная подготовка анализируемой пробы аналогична этой операции в пламенной фотометрии: перевод пробы в раствор, распыление и подача аэрозолей в пламя. Растворитель испаряется, соли разлагаются, а металлы переходят в парообразное состояние, при котором они способны поглощать излучение той длины волны, которую могли бы сами излучать при более высоких температурах. Луч света от лампы полого катода, излучающий дуговой спектр определяемого элемента, направляется через пламя на щель спектрометра, с помощью которого выделяется аналитическая спектральная линия и измеряется степень поглощения ее интенсивности парами определяемого элемента.
Качественный анализ рентгеноспектральным методом проводят путем определения длины волны интересующих линий и их последующей идентификации. Длину волны рентгеновской линии в спектре обычно определяют с помощью известных опорных линий, являющихся своеобразными стандартами. В качестве такого стандарта может быть использована или «основа» пробы или известное вещество, специально вводимое в анализируемую пробу. Нередко для этого рядом со спектром анализируемой пробы фотографируют спектр известного стандартного вещества.
Широкое распространение получил метод фотометрического определения Сr+6 с применением дифенилкарбазида, позволяющий оперативно определять содержание Сr+6 в пробах природной воды.
Однако, согласно метрологическим характеристикам данного метода, минимально определяемая концентрация Сr+6 составляет лишь 30 мг/дм3.
Поэтому для существенного повышения чувствительности (в 30 раз) применяют экстракционно-фотометрический метод, который заключается в экстракции определяемого вещества с его последующим фотометрическим определением. Этот метод применяется при анализе сложных смесей, когда нужно определить малые количества одних веществ в присутствии больших количеств других, при определении примесей в присутствии основных компонентов, а также в тех случаях, когда непосредственное определение интересующего элемента в смеси связано с большими трудностями. При экстракции малых количеств примесей происходит не только их выделение, но и концентрирование. Поэтому экстракционно-фотометрический метод приобретает особо важное значение в связи с определением малых количеств примесей в веществах высокой степени чистоты, широко применяемых в атомной и полупроводниковой технике. Экстракционно-фотометрические методы анализа являются высокочувствительными методами, они быстро развиваются и очень перспективны.
Следовательно, экстракционно-фотометрический метод позволяет определять содержание Сr+6 в поверхностных водах на уровне 1-30 ПДК и может быть использован при оперативном контроле, в том числе в условиях работы передвижной гидрохимической лаборатории. При этом методе можно проводить измерения в потоке воды, проба может последовательно проходить несколько различных кювет, где можно измерить другие параметры, может использоваться установка на участке сброса вод, измерения могут проводится периодически, не нужен постоянный контроль, для определения концентрации хрома в воде впрыскивается избыточное количество экстракта, которое связывает почти 100% ионов хрома, что позволяет более точно провести измерения.
Для определения концентрации ионов хрома Сr+6 используется экстракционно-фотометрический метод, в котором количество вещества определяется по интенсивности окраски окрашенных соединений. Определяемый ион металла при помощи реагента переводят в окрашенное соединение, а затем измеряют интенсивность окраски его раствора.
Так как в качестве экстракта была выбрана суспензия, то прошедший через нее поток быстро затухает, и поэтому в качестве информативного параметра был выбран отраженный поток, который зависит от длины волны источника излучения и концентрации ионов хрома (рис. 2).
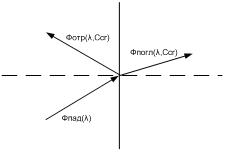
Рисунок 2 – Движение потока излучения
Так как источник излучения частотно зависим и спектр поглощения ограничен, то в качестве источника излучения выбирается светоизлучающий диод (СИД) с длиной волны l=540 нм, что соответствует максимуму спектра поглощения и обеспечивает избирательность метода. Функцию избирательности можно усилить введением дополнительно оптического фильтра на длине волны l=540 нм с полосой пропускания 25±10 нм.
Фотометр представляет собой прибор для канала измерительной автоматизированной системы контроля сточных вод (такие системы обслуживаются раз в 2 недели), в котором измеряется концентрация ионов хрома Сr+6. Также в данной системе могут быть каналы измерения других величин. Например, на измерение Сr+6 оказывает влияние уровень рН (учет данного фактора позволяет уменьшить погрешность с 6-7% до 3-4%). Для учета и оптимизации уровня рН при измерении концентрации ионов хрома Сr+6 целесообразно вводить в пробу необходимое (дозированное) количество кислоты Н2SO4. На измерение рН в свою очередь влияет температура. Поэтому уровень рН и температуры необходимо измерять. В результате имеем многоканальную систему, состоящую, как минимумом, из трех каналов измерения: рН, температуры и концентрации ионов хрома Сr+6.
Влияние рН на результаты фотометрического измерения.
При уменьшении кислотности среды, т. е. при повышении рН раствора, катионы металла, как правило, взаимодействуют с ОН-ионами, образуя в конечном счете малорастворимые гидроксиды или основные соли [3]. Окрашенное соединение при этом разрушается. Малорастворимое соединение может и не образоваться, тем не менее участие определяемых катионов в сопряженном комплексообразовании с ОН-ионами значительно уменьшает условную константу устойчивости окрашенного комплекса и, следовательно, приводит к уменьшению степени связанности определяемого иона в окрашенное соединение. Особенно сильное влияние наблюдается для малопрочных комплексов, которые при увеличении рН раствора могут быть разрушены полностью.
Поэтому реакции образования окрашенных соединений ионов металлов с анионами сильных кислот целесообразно проводить в достаточно кислых средах, где условная константа устойчивости окрашенного комплекса сохраняет свое наибольшее значение.
Окрашенные комплексы с анионами слабых кислот. Когда в качестве реагентов используют слабые органические кислоты HR (салициловая кислота, ализарин, диметилглиоксим и др.), изменение рН раствора оказывает очень сильное, хотя внешне и не всегда заметное, влияние. Полнота связывания иона М в окрашенное соединение MRn зависит от концентрации в растворе анионов реагента R– которая в свою очередь зависит от концентрации Н+ в растворе. В кислых растворах концентрация R– бывает невелика, так как равновесие ионизации слабой кислоты HR сильно смещено в сторону недиссоциированной (кислотной) формы реагента. Увеличить концентрацию R– путем повышения общей концентрации реагента не всегда удается, поскольку слабые органические кислоты часто имеют ограниченную растворимость. В этом случае концентрацию увеличивают повышением рН раствора, которое смещает равновесие ионизации кислоты в сторону его солевой формы R– .
Таким образом, реакции образования окрашенных соединений ионов металлов с анионами слабых кислот следует проводить по возможности в менее кислых средах. Однако уменьшение концентрации Н+ необходимо осуществлять очень осторожно, так как при повышении рН раствора может происходить образование основных солей или гидроксидов определяемых металлов; может изменяться состав окрашенного соединения вследствие ступенчатости комплексообразования. В некоторых случаях, когда влияние конкурирующего комплексообразования ОН-ионов преобладает над влиянием депротонирования реагента, повышение рН раствора может привести к противоположным результатам, т. е. к уменьшению степени связанности иона М в окрашенное соединение. Поэтому максимальный выход светопоглощающего комплекса будет наблюдаться только в определенном интервале значений рН раствора.
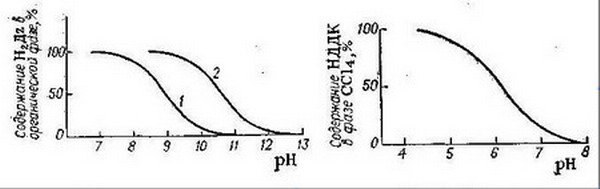
Рисунок 3 - Распределение дитизона в зависимости от рН водной фазы: 1 - CCl4; 2 - CHCl3
Рисунок 4 - Распределение диэтилдитиокарбаминовой кислоты (НДДК) в зависимости от рН водной фазы
Диэтилдитиокарбаминат натрия (Na-ДДК)
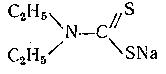
– групповой хелатообразующий реагент, хорошо растворимый в воде.
Диэтилдитиокарбаминовая кислота в кислых растворах разлагается на диэтиламин и сероуглерод, поэтому при хранении растворы Na-ДДК слегка подщелачивают (примерно до рН = 9). Распределение реагента между водной и органической фазами зависит от рН среды (рис. 4). При рН до 4 реагент в виде кислоты полностью переходит в органическую фазу, а. при рН выше 8 практически количественно остается в водном слое, что показано на рисунке 5:
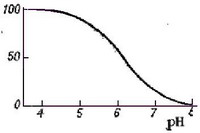
Выяснение зависимости светопоглощения раствора от времени и температуры.
Фотометрический анализ обычно проводят при одинаковой комнатной температуре, так как изменение температуры раствора во многих случаях вызывает соответствующее изменение свето-поглощения [3]. Если даже небольшое изменение температуры (на 2—3 °С) приводит к значительному изменению оптической плотности фотометрируемого раствора, то измерения последней производят после предварительного термостатирования.
Для выяснения устойчивости светопоглощения фотометрируемого соединения во времени измеряют оптическую плотность раствора через некоторые промежутки времени и строят график зависимости оптической плотности от времени. Для последующей работы выбирают такой интервал времени, в течение которого максимальное значение оптической плотности раствора сохраняется неизменным или меняется незначительно. Кроме того, на протяжении всех измерений строго выдерживают время между измерением оптической плотности и приготовлением фотометрируемого раствора.
Связь концентрации ионов хрома Сr+6 с параметрами, влияющими на ее измерение можно представить в виде системы (1).
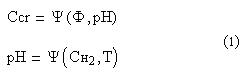
где Ссr – концентрация хрома;
Ф – отраженный поток;
рН – уровень рН;
Сн2 – концентрация водорода;
Т – значение температуры.
Чтобы обеспечить метод экстакции необходима подсистема подготовки проб, которая должна периодически, дозируя экстракт, обеспечивать дополнение его в рабочую кювету. Необходимо установить наиболее благоприятные условия образования окрашенного соединения, то есть стабилизировать температуру, расход жидкости, расход экстракта, времени. Установление концентрации происходит спустя интервал времени, равный восьмикратному обновлению жидкости кюветы (3-5 мл3). Объем пробы – не более 50 мл.
Предполагается производить измерения с интервалом в 1 час.
В результате построена конструктивная схема измерительной автоматизированной системы контроля сточных вод, имеющей 3 канала измерения:
- канал измерения температуры;
- канал измерения рН;
- канал измерения концентрации ионов хрома Сr+6.
Данная конструктивная схема представлена на рисунке 6.
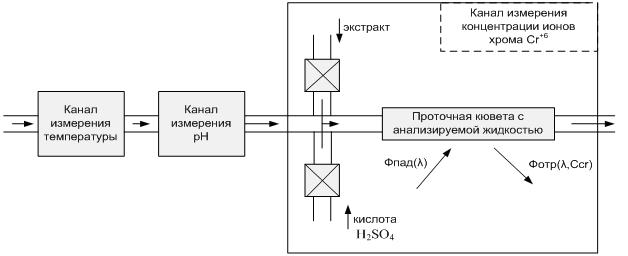
Рисунок 6 – Конструктивная схема измерительной автоматизированной системы контроля сточных вод.
Для реализации используемого метода создается световой поток (поток излучения), часть которого проходит через кювету с заранее подготовленной окрашенной жидкостью, а часть отражается и преобразуется в электрический сигнал.
Также предусмотрена возможность обработки полученного сигнала и выдачи результатов контроля объекта для их дальнейшего анализа. Вся система обеспечена питанием.
Полученные и планируемые результаты
Полученные результаты:
- изучены характеристики и свойства хрома (Сr+6);
- проанализированы методы измерения концентрации ионов хрома (Сr+6) в сточных водах;
- проанализированы средства измерения концентрации ионов хрома (Сr+6) в сточных водах;
- построена конструктивная схема измерительной автоматизированной системы контроля сточных вод.
На данный момент разрабатывается математическая модель оптического канала измерения концентрации хрома (Сr+6).
Планируемый результат – структурная схема разрабатываемого прибора, построенная на основе разработанной математической модели.
На момент написания данного автореферата магистерская работа находится в стадии разработки. Окончание и защита работы планируется в декабре 2007 года.
Литература
1. Радченко Н.Н., Мнускина В.В. Оценка загрязнения реки Кальмиус тяжелыми металлами // Охорона навколишнього середовища та раціональне використання природних ресурсів: Зб. доп. 1 міжнар. наук. конф. асп. та студ. – Донецьк, 2002. – Т.1
2. Правила приймання стічних вод підприємств у комунальні та відомчі системи каналізації населених пунктів України. (Затверджено наказом Державного комітету будівництва, архітектури та житлової політики України від 19 лютого 2002 р. N 37. Зареєстровано в Міністерстві юстиції України 26 квітня 2002 р. за N 403/6691)
3. Булатов М.И., Калинкин И.П. Практическое руководство по фотометрическим методам анализа -5-е изд., перераб.- Л.:Химия, 1986. - 432 с.
4. Булатов М.И., Калинкин И.П. Практическое руководство по фотоколори-метрическим и спектрофотометрическим методам анализа, изд. 4-е, пер. и доп., Л., «Хиимя», 1976,-376стр.
5. Пилипенко А.Т., Пятницкий И.В. Аналитическая химия. В двух книгах: кн..1 – М.: Химия, 1990,-480с.
6. Пилипенко А.Т., Пятницкий И.В. Аналитическая химия. В двух книгах: кн..2 – М.: Химия, 1990,-480с.
7. Васильєв В.П. Аналитическая химия. В 2 ч. Ч. 2. Физико – химические методы анализа: Учеб. для Химко – технол. спец. вузов. – М.: Высш. шк., 1989. – 384с.
8. Гидрохимические материалы. Том 100. Методы и технические средства оперативного мониторинга качества поверхностных вод. Л.: Гидрометео-издат, 1991. – 200с.
9. Саль А.О. Инфракрасные газоаналитические измерения: Погрешности и информационная способность инфракрасных газоанализаторов. – М.: Из-дательство стандартов, 1971. – 100с.
10. ПримакА.В., БалтерансП.Б. Защита окружающей среды на предприятиях стройиндустрии. – К.: Будівельник, 1991. – 152с.
10. ПримакА.В. Cистемный анализ контроля и управления качеством. – К.: Будівельник, 1991. – 152с.
12. Земля тревоги нашей: Донбасс // Правда Украины. -2006.
13. Лаврухина А.К., Юкина Л.В. Аналитическая химия хрома. Серия: «Аналитическая химия элементов», М.: Наука, 1979. - 214с.
14. Неорганические соединения хрома. Справочник/Сост.: Рябин В.А., Киреева М.В., Берг Н.А. и др. - Л.: Химия, 1981 - 208с.
15. Фомин Г.С. Вода. Контроль химической, бактериальной и радиационной безопасности по международным стандартам. Энциклопедический справочник. - 3-е изд., перераб и доп. - М., Издательство «Протектор», 200. - 848с.
16. Физические основы спектрального анализа. Райхбаум Л.Д., М.: Наука, 1980
17. Золотов Ю.А., Иванов В.М., Амелин В.Г. Химические тест - методы анализа. - М.: Едиториал УРСС, 2002. - 304с.
18. Справочное руководство по применению ионоселективных электродов: Пер с англ. - М.: Мир, 1986. - 231с.
19. Бейтс Р. Определение рН: теория и практика. Л.: Химия, 1972. - 398с.
20. А. Альберт, Е. Сержент Константы ионизации кислот и оснований. М.: Химия, 1964. - 178с.
21. Лурье Ю.Ю. Аналитическая химия производственных сточных вод / Ю.Ю. Лурье; М.: ХимияЮ, 1984. - 448с.





