





 ДонНТУ
Магистратура ДонНТУ
Поисковая
система ДонНТУ
ДонНТУ
Магистратура ДонНТУ
Поисковая
система ДонНТУ 

Берестовая Алина Анатольевна

ПЛАН
Введение
1. Актуальность работы
2. Описание экспериментального оборудования
2.1 Оборудование дифференциально-термического анализа
2.2 Оборудование спектрального анализа
2.3 Оборудование рентгенофазового анализа
3. Результаты исследования систем
4. Расчет систем
5. Экологические аспекты работы
Выводы
Список использованной литературы
ВВЕДЕНИЕ
Самораспространяющееся взаимодействие – мало изученный процесс технологического горения. Работы в этой области начались в 1967 году после того, как было выявлено явление распространения фронта горения в смесях порошков тугоплавких химических элементов, которые приводят к образованию тугоплавких соединений. Это новое направление, в котором в основном изучались системы простых веществ. Реакции в таких системах представляют собой сильноэкзотермичекое взаимодействие химических элементов в конденсированном виде, что протекает в режиме горения. [1]
Целью данной работы является изучить возможное взаимодействие в тройных пероксидно – солевых системах, где все компоненты в системе вступают в реакцию с пероксидом натрия. Ранее было установлено взаимодействие в системах Na2O2(Na2O) – Mex(SO4)y, где в качестве третьего компонента вводился оксид магния (MgO), но он являлся тепловым разбавителем и не вступал в реакцию с другими компонентами системы. Для изучения самораспространяющегося взаимодействия были взяты такие системы, как: Fe2(SO4)3 – ZnO - NaO2, ZnSO4 - Fe2(SO4)3 - NaO2 и Fe2O3 - ZnSO4 - NaO2. Большой интерес представляют соединения железа трехвалентного, так как эти соединения являются амфотерными и могут взаимодействовать с компонентами системы, образуя продукты, которые являются промышленно применимы.
1. АКТУАЛЬНОСТЬ РАБОТЫ
Актуальность работы лежит в следующем. Во-первых, актуальным является вопрос изучения реакций, которые протекают в режиме СРВ, и систем, в которых возможно их протекание. Кроме того, что СРВ является дешевым способом получения тугоплавких соединений, известно также, что он дает возможность получения многих газообразных веществ, которые используют для разных технических целей (H2, O2, N2, Cl2, F2, SO2, оксиды азота, оксиды хлора, а также CO, CO2 и др.) [1]. СРВ – перспективный способ получения кислорода, что позволяет убрать недостатки, которые имеют традиционные способы [2]. СРВ также можно использовать для переработки токсических отходов производства для введения новых нетрадиционных методов синтеза неорганических соединений. Так как в результате этих реакций выделяется большое количество теплоты, то их можно использовать как источник энергии (энергетические примеси). Как можно увидеть, реакции, которые протекают в режиме СРВ, имеют большое значение для народного хозяйства. Но для того, чтобы научится управлять ними, необходимо детальное изучение этих реакций и систем, в которых они протекают, особенно обращая внимание на очень маленькое количество накопленных про них знаний.
Во-вторых, ещё одним актуальным вопросом является вопрос синтеза ферритов. Ферритные материалы и изделия в настоящее время широко используются во всех отраслях техники и кибернетики. Но традиционные методы их синтеза являются сложными и многоступенчатыми, а главное – энергоёмкими. Метод СРВ теоретически дает возможность простого и быстрого их получения, а также более экономического и дешевого, так как для осуществления процесса СРВ не нужен подвод энергии извне. После инициирования процесса высокотемпературным источником он проходит за счет тепла, которое выделяется во время процесса. Нужно также обратить внимание на то, что метод СРВ, в отличии от традиционных методов получения ферритов, в результате которых образуются сточные воды, является экологически чистым.
2. ОПИСАНИЕ ЭКСПЕРИМЕНТАЛЬНОГО ОБОРУДОВАНИЯ
2.1 Оборудование дифференциально-термического анализа
В роботе использовалась установка для термического анализа с автоматическим записыванием кривых дифференциально-термического анализа и термогравиметрического анализа (ТГ). Установка позволяет в автоматическом режиме записывать кривые зависимости разницы температуры между образцом и эталоном от температуры печи (кривые ДТА) и кривые зависимости между потерей массы образца от температуры печи (кривые ТГ). Схема установки приведена на рисунке 2.1.
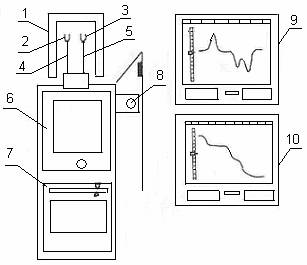
1 – печь; 2 – тигель с эталоном; 3 – тигель с веществом; 4 – термопара; 5 – термопара вещества; 6 – весы; 7 – устройство управления весами; 8 – установщик температуры; 9 – самописец ДТА; 10 – самописец ТГ.
Рисунок 2.1 – Схема установки для термического анализа
Установка состоит из: 1 – двух печей, которые
закреплены на штативе, что вращается, это позволяет при роботе одной печи
обеспечивать охлаждение другой; 2 – тигля с инертным эталлоным веществом (![]() ); 3 – тигля для
исследуемого вещества; 4 – термопары, которые измеряют температуру эталона.
Термопара подключенная к каналу Х самописцев (9, 10), что приводить при её нагревании
к перемещению каретки самописцев слева направо. Таким образом, на самописцах по
оси Х фиксируется температура печи в каждый момент времени; 5 – термопары,
которые измеряют температуру печи исследуемого вещества. Эта термопара
подключена навстречу термопаре (4). Таким образом, разница между ЭДС термопары
(4) и термопары (5) пропорциональна разнице температур между веществом и
эталоном. Эта разница выводится на канал Y самописца (9); 6 – аналитические
весы с электромагнитным корректированием положения равновесия; 7 – устройство
управлением весами; 8 – регулировщик температуры; 9 – самописец кривых ДТ; 10 –
самописец кривых ТГ.
); 3 – тигля для
исследуемого вещества; 4 – термопары, которые измеряют температуру эталона.
Термопара подключенная к каналу Х самописцев (9, 10), что приводить при её нагревании
к перемещению каретки самописцев слева направо. Таким образом, на самописцах по
оси Х фиксируется температура печи в каждый момент времени; 5 – термопары,
которые измеряют температуру печи исследуемого вещества. Эта термопара
подключена навстречу термопаре (4). Таким образом, разница между ЭДС термопары
(4) и термопары (5) пропорциональна разнице температур между веществом и
эталоном. Эта разница выводится на канал Y самописца (9); 6 – аналитические
весы с электромагнитным корректированием положения равновесия; 7 – устройство
управлением весами; 8 – регулировщик температуры; 9 – самописец кривых ДТ; 10 –
самописец кривых ТГ.
Кроме этих составляющих, установка имеет элементы управления. [3]
Основным рабочим узлом установки для регистрации кривых ДТА и ТГ является печь, что опускается на тигли с исследуемым образцом и эталоном. На дне каждого из тиглей, изготовленных из термостойкого стекла, предусмотрены углубления для введения термопар. В установке применяют калиброванные хромель – алюминиевые термопары.
Термопары уложены в керамические трубки. Керамическая трубка с термопарой для эталона запрессована в специальный блок, что экранирует, и выступает из него на 12-15см. Керамическая трубка с термопарой для исследуемого образца проходит через отверстие в специальном блоке, что экранирует, и связана с коромыслом аналитических весов, которые через электронную систему с помощью двухкоординатного самописца типа Н 307 регистрирует изменение массы исследуемого образца.
Температурный режим регулируется электронной системой, что содержит высокоточный регулятор температуры ВРТ-3.[4]
2.2 Оборудование спектрального анализа.
Для изучения спектральных характеристик вещества было использована методика регистрации ИК-спектров поглощения, что реализовалась на стандартном приборе «Specord 75IR».
Основными составляющими устройства прибора является:
А) монохроматор;
Б) источник излучения (разогретый до 1200 0С стержень), которое позволяет получить инфракрасное излучение в диапазоне длин волн 2,5-25 мкм;
В) приёмник излучения, принимающий излучение, что прошло через образец, и превращающий его в слабый электрический сигнал;
Г) система, что усиливает сигнал приёмника и руководит устройством пера самописца;
Д) кюветное отделение, которое служит для размещения анализируемых образцов.
Принципиальна схема спектрофотометра приведена на рисунке 2.2.
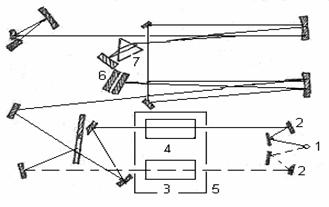
1 – источник излучения; 2 – система зеркал; 3 – образец исследуемого вещества; 4 – эталон; 5 – кюветное отделение; 6 – дифракционная решетка; 7 – призма.
Рисунок 2.2 – Оптическая схема инфракрасного спектрофотометра
Излучение, которое проходит из источника (1), с помощью системы зеркал (2) идут на исследуемую и эталонную пробы в кюветное отделение (5) спектрофотометра. Дальше оба излучения соединяются и направляются системою зеркал на вход монохроматора. Основной частью монохроматора есть дифракционная решетка (6) и призма (7), которые выделяют из общего излучения компонент с соответствующей длиной волны. Потом лучи попадают на термоэлемент, который в комплекте с усилительной системой производит сигнал, руководствующий движением пера самописца. В зависимости от угла поворота дифракционных решеток и призмы на приемник попадает монохроматическое излучение с разною длиною волн. Вращая решетку и призму, например, с помощью электродвигателя, можно обеспечить непрерывную развертку излучения по длинам волн. С помощью приёмника можно измерить интенсивные излучения, что прошло через образец, как функцию длины волны, которая и есть ИК-спектром. [3]
2.3 Оборудование рентгенофазового анализа
Рентгенофазовый аппарат ДРОН-УМІ состоит из отдельных блоков и узлов. Функциональна схема установки приведена на рисунке 2.3.
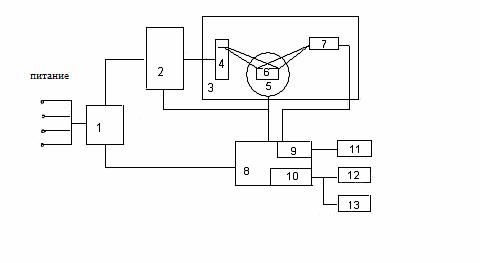
1 – блок электрического питания; 2 – питающее устройство; 3 – дифрактометрическая стойка; 4 – рентгеновская трубка; 5 – гониометр; 6 – гониометрическая приставка; 7 – блок детектирования; 8 – управляющий комплекс; 9 – блок регистрации; 10 – счетный комплекс; 11 – самопишущее устройство; 12 – печатное устройство; 13 – перфоратор.
Рисунок 2.3 – Функциональная схема дифрактометра ДРОН-УМІ
Питание дифрактометра осуществляется через блок электрического подключения 1. Основным узлом устройства является дифрактометрическая стойка 3, на которой смонтирована рентгеновская трубка 4 в защитном кожухе, гониометр 5, блок детектирования 7. Стойка 3 размещена на столе питающего рентгеновского устройства 2, которое обеспечивает питание трубки 4 стабилизированным высоким напряжением.
Управляющий комплекс 8 предназначен для обеспечения управлением гониометром и исполнительными механизмами, а также для сбора и обработки информации с последующим выводом на регистрирующее устройство (печатное устройство 12 или перфоратор 13). Упавляющий комплекс обеспечивает автоматический режим работы устройства ДРОН-УМІ за заданной оператором программой. Для этого применяется мини-ЭВМ 10.
Отображенное от исследуемого образца, размещенного в гониометрической приставке 6 гониометра, рентгеновское излучение попадает в блок детектирования 7, в котором кванты рентгеновского излучения превращаются в электрические импульсы.
В качестве детектора излучения в дифманометра используются пропорциональные счетчики. Импульсы с счетчика идут в блок регистрации 9 управляющего комплекса, усиливаются и поддаются в дискриминатор. Полученный при этом исходный сигнал записывается в виде рентгенограммы на диаграммной ленте самопишущим устройством 11 или автоматически вычисляется по программе вычислительного комплекса 10, а потом выводится на печать. [3]
3. РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ СИСТЕМ
В работе использовался супероксид натрия с количеством активного кислорода 41,5 % при содержании NaO2 – 93,6%, Na2O2 – 4,7% и сумме NaOH c Na2CO3 » 1,7% и пероксид натрия с количеством активного кислорода 20 % при содержании Na2O2 –92,2 %, NaO2 – 5,4%, NaOH < 1,4%; Na2CO3 < 1,0%. Сульфаты цинка и железа сушили при 200 0C. Качество сушки сульфатов контролировалось при помощи ТГА и ИК-спектроскопии. Термический анализ проводился на установке с автоматической записью веса и чувствительностью +0,5 мг. Использовались устойчивые к воздействию пероксидных соединений в используемом интервале температур тигли из никеля. Образцы для измерения скорости СРВ имели диаметр З0 мм и высоту 60-65 мм и изготавливались путем прессования (1000-1500 кг/см2) порошкообразных смесей сульфата кадмия с Na2O2 или NаO2. Скорость СРВ определялась исходя из длины образца и времени распространения фронта реакции, после инициирования процесса СРВ высокотемпературным источником.
Рисунок 3.1 – Измерение скорости горения.
(Технические характеристики анимации: кадров - 5, количество повторений - 15, размер - 20,8 Кб, интервал между кадрами - 5 секунд)В условиях ДТА установили, что начало температуры взаимодействия в системах при мольном соотношении составляет 250°C.
По результатам эксперимента средняя скорость распространения фронта горения по порошку в системе Fe2(SO4)3 – ZnO - NaO2 при мольном соотношении равна 92,48 мм/мин. Попытки определить скорость горения в системе Fe2O3 - ZnSO4 - NaO2 не дали результатов из-за того, что фронт горения не распространяется самостоятельно по объему смеси. Это говорит о том, что Fe2O3 разбавляет систему, в результате чего самораспространяющее взаимодействие в ней стает невозможным.
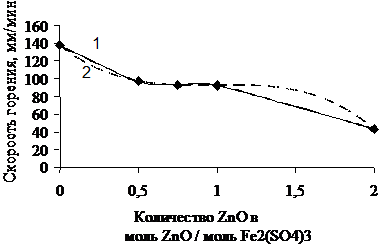
1 – экспериментальная кривая; 2 – расчетная кривая
Рисунок 3.2 –Зависимость скорости перемещения фронта горения от количества ZnO в системе Fe2(SO4)3–ZnO–NaO2
Скорость распространения фронта горения в системе ZnSO4 - Fe2(SO4)3 - NaO2 по экспериментальным данным составила 102,62 мм/мин.
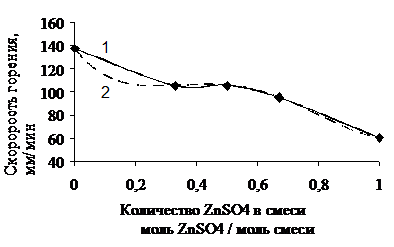
1 – экспериментальная кривая; 2 – расчетная кривая
Рисунок 3.3 – Зависимость скорости перемещения фронта горения от количества в системе ZnSO4
Спектральный анализ продуктов взаимодействия систем практически не дал никаких результатов. Удалось идентифицировать только сульфат натрия и оксиды Fe2O3 и ZnO. Для более полного определения состава продуктов взаимодействия в изученных системах остаются необходимыми результаты рентгенофазного анализа.
Результаты для продуктов взаимодействия систем Fe2(SO4)3 – ZnO - NaO2, ZnSO4 - Fe2(SO4)3 - NaO2 и Fe2O3 - ZnSO4 - NaO2 приведены на рисунке 3.
Данные РФА дают возможность утверждать, что состав продукта системы Fe2(SO4)3 – ZnO - NaO2 следующий: Na2SO4, ZnO и Fe2O3. Следует обратить внимание на то, что оксид железа в данной системе проявляется плохо, что может быть связано с возможным образованием в нём цинкового феррита ZnFe2O4 не очень интенсивные пики которого также наблюдаются не рентгенограмме. Механизм реакции образования феррита в этой системе может быть объяснен внедрением ZnO в ещё несформировавшуюся кристаллическую решетку Fe2O3 в момент её образования во время протекания реакции СРВ между Fe2(SO4)3 и Na2O2. Тогда механизм всего процесса, что протекает в системе Fe2(SO4)3 – ZnO - NaO2 сводится к схеме химических реакций:
| 2NaO2 = Na2O2 + O2 | (3.1) |
| 3Na2O2 + Fe2(SO4)3 = 3Na2SO4 + Fe2O3 + 1,5O2 | (3.2) |
| Fe2O3+ ZnO = ZnFe2O4 | (3.3) |
В продуктах взаимодействия системы Fe2O3 - ZnSO4 - NaO2 по данным РФА хорошо выявляют разные фазы Fe2O3 и Na2SO4, а также ZnO. Очень сложно делать выводы про возможность образования в ней цинкового феррита поскольку имеем лишь одно хорошее совпадение между значениями межскоростных расстояний чистого вещества и исследуемого образца. Но обращает на себя внимание факт точного выявления Fe2O3 и ZnO. Поэтому образование феррита в данной системе маловероятно, что полностью объясняется небольшим теплообразованием системы и отсутствие в ней СРВ в связи с довольно сильным её разбавлением оксидом железа. С учётом выше сказанного можно сделать вывод, что в системе Fe2O3 - ZnSO4 - NaO2 протекают две реакции:
| 2NaO2 = Na2O2 + O2, | (3.4) |
| Na2O2 + ZnSO4 = Na2SO4 + ZnO + 0,5O2 | (3.5) |
В продуктах взаимодействия системы ZnSO4 - Fe2(SO4)3 - NaO2 присутствуют разные фазы Na2SO4, а также ZnO и Fe2O3. Оксиды в этой системе проявляются плохо, что свидетельствует о наличии феррита в продуктах этой системы, пики которого хорошо видны на рентгенограмме.
Механизм реакции образования феррита объясняется образованием оксида цинка, с последующим его внедрение в несформировавшуюся кристаллическую решетку оксида железа. Этот процесс можно представить химическими реакциями:
| 2NaO2 = Na2O2 + O2 | (3.6) |
| 3Na2O2 + Fe2(SO4)3 = 3Na2SO4 + Fe2O3 + 1,5O2 | (3.7) |
| Na2O2 + ZnSO4 = Na2SO4 + ZnO + 0,5O2 | (3.8) |
| Fe2O3 + ZnO = ZnFe2O4 | (3.9) |
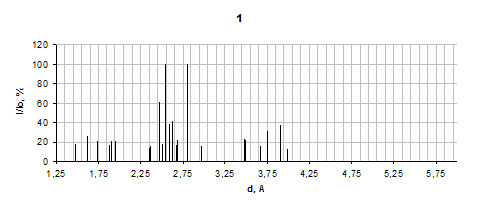
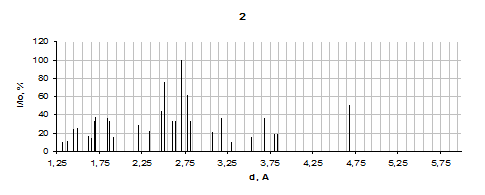
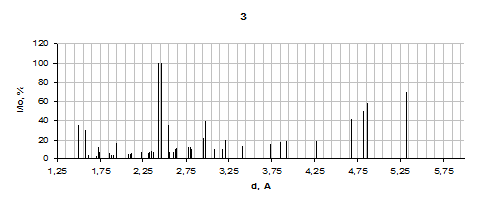
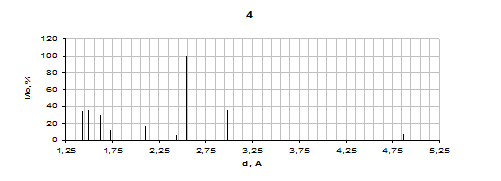
1 - Fe2(SO4)3 – ZnO – NaO2; 2 - Fe2O3 – ZnSO4 - NaO2; 3 - ZnSO4 – Fe2(SO4)3 - NaO2; 4 - ZnFe2O4
Рисунок 3.4 – Результаты рентгенофазового анализа
4. РАСЧЕТ СИСТЕМ
4.1 Расчет системы Fe2(SO4)3–ZnO–NaO2
В данной системе при нагревание имеют место такие реакции:
| 2NaO2 = Na2O2 + O2 | (4.1) |
| 3Na2O2 + Fe2(SO4)3 = 3Na2SO4 + Fe2O3 + 1.5 O2 | (4.2) |
| Fe2O3 + ZnO = ZnFe2O4 | (4.3) |
Представим уравнения в виде:
|
NaO2 = |
(4.4) |
| Na2O2 + |
(4.5) |
| Fe2O3 + |
(4.6) |
Где массовые стехиометрические коэффициенты составляют:
![]() 1 = M(Na2O2) / (M(NaO2) ×2) = 0.7091;
1 = M(Na2O2) / (M(NaO2) ×2) = 0.7091;
![]() 2 = M(O2)
/ (M(NaO2) ×2) = 0.2909;
2 = M(O2)
/ (M(NaO2) ×2) = 0.2909;
![]() 3 = М(Fe2(SO4)3) / (М(Na2O2) ×3) = 1.7094;
3 = М(Fe2(SO4)3) / (М(Na2O2) ×3) = 1.7094;
![]() 4 = М(Na2SO4)
/ (М(Na2O2) ×3) = 1.8205;
4 = М(Na2SO4)
/ (М(Na2O2) ×3) = 1.8205;
![]() 5 = М(Fe2O3)
/ (М(Na2O2) ×3) = 0.6838;
5 = М(Fe2O3)
/ (М(Na2O2) ×3) = 0.6838;
![]() 6 = М(O2) / (М(Na2O2)
×3) = 0.2051;
6 = М(O2) / (М(Na2O2)
×3) = 0.2051;
![]() 7 = М(ZnO) /
М(Fe2O3) = 0.5063;
7 = М(ZnO) /
М(Fe2O3) = 0.5063;
![]() 8 = М(ZnFe2O4)
/ М(Fe2O3) = 1.5063.
8 = М(ZnFe2O4)
/ М(Fe2O3) = 1.5063.
Тепловые эффекты реакций рассчитывают по формуле:
|
|
(4.7) |
По справочным данным [27]:
для NaО2 ![]() H0 = -261,65 кДж/моль,
H0 = -261,65 кДж/моль,
для Na2O2
![]() H0 = -513,21 кДж/моль,
H0 = -513,21 кДж/моль,
для О2 ![]() H0 = 0 кДж/моль,
H0 = 0 кДж/моль,
для Fe2(SO4)3 ![]() H0 = -2580,27 кДж/моль,
H0 = -2580,27 кДж/моль,
для Na2SO4 ![]() H0 = -1387,21 кДж/моль,
H0 = -1387,21 кДж/моль,
для Fe2O3
![]() H0 = -822,16 кДж/моль,
H0 = -822,16 кДж/моль,
для ZnО ![]() H0 = -348,11 кДж/моль,
H0 = -348,11 кДж/моль,
для ZnFe2O4 ![]() H0 = -1181,98 кДж/моль.
H0 = -1181,98 кДж/моль.
![]() Нр2 =(-1387,21×3 – 822,16) - (-2580,27 – 513,21×3) =-863,89 кДж/моль,
Нр2 =(-1387,21×3 – 822,16) - (-2580,27 – 513,21×3) =-863,89 кДж/моль,
![]() Нр3 = -1181,98 - (-822,16 – 348,11)
= -11,71 кДж/моль.
Нр3 = -1181,98 - (-822,16 – 348,11)
= -11,71 кДж/моль.
Суммарная реакция, что протекает в исследуемой системе, имеет вид:
|
Fe2(SO4)3 + 6 NaО2 + ZnО |
(4.8) |
Рассчитаем её тепловой эффект по формуле (4.7):
![]() Нсум = (-3×1387,21
– 1181,98)-(-2580,27 – 261,65×6 –
348,11)=-845,33 кДж/моль.
Нсум = (-3×1387,21
– 1181,98)-(-2580,27 – 261,65×6 –
348,11)=-845,33 кДж/моль.
Далее по справочным данным определим константы эмпирического уравнения действительной теплоёмкости по уравнению:
|
Ср
= |
(4.9) |
где ![]() , b, с/ –
константы, что определяются природой вещества и являются дополнительными
данными;
, b, с/ –
константы, что определяются природой вещества и являются дополнительными
данными;
Т– температура при которой рассчитывается теплоёмкостьтемпература.
Для продуктов взаимодействия:
для ![]() -Na2SO4
:
-Na2SO4
: ![]() = 82,32 Дж/К ,
b = 154,36×10-3 Дж/К,
= 82,32 Дж/К ,
b = 154,36×10-3 Дж/К,
для ZnFe2O4:
![]() = 146,73 Дж/К
, b = 77,23×10-3 Дж/К,
= 146,73 Дж/К
, b = 77,23×10-3 Дж/К,
для
O2:
![]() = 31,46 Дж/К,
b = 3,39×10-3 Дж/К.
= 31,46 Дж/К,
b = 3,39×10-3 Дж/К.
Дальше рассчитаем количество тепла, что выделяется при нагревании системы в интервале температур от 298 К до температуры фазового переходу Na2SO4 по формуле:
|
| (4.10) |
где ![]() – сумма констант
– сумма констант ![]() с учетом мольных коэффициентов реакций;
с учетом мольных коэффициентов реакций;
![]() –
сумма констант b.
–
сумма констант b.
![]() Н1 =
Н1 = ![]() (522 - 298) +
(522 - 298) + ![]() / 2 (5222 - 2982).
/ 2 (5222 - 2982).
Константы ![]() і
і ![]() составляют:
составляют:
![]() = 3×82,32
+ 146,73 + 4,5×31,46 = 535,26 Дж/(моль×К) ,
= 3×82,32
+ 146,73 + 4,5×31,46 = 535,26 Дж/(моль×К) ,
![]() = 10-3(3×154,36 + 77,23 + 4,5×3,39)
2 = 555,57×10-3 Дж/(моль×К).
= 10-3(3×154,36 + 77,23 + 4,5×3,39)
2 = 555,57×10-3 Дж/(моль×К).
Тогда:
![]() Н1 = 535,26(522 - 298) + (555,57×10-3) / 2×(5222
- 2982) = 170,92 кДж/моль.
Н1 = 535,26(522 - 298) + (555,57×10-3) / 2×(5222
- 2982) = 170,92 кДж/моль.
Теплота перехода 1 моля ![]() -Na2SO4
у
-Na2SO4
у ![]() -модификацию составляет 10.81 кДж/моль [27]. Тогда
суммарное количество тепла, что выделяется при нагревании системы до
температуры фазового перехода сульфата натрия и осуществление такого перехода
определяется как:
-модификацию составляет 10.81 кДж/моль [27]. Тогда
суммарное количество тепла, что выделяется при нагревании системы до
температуры фазового перехода сульфата натрия и осуществление такого перехода
определяется как:
![]() Q1
= 170,92 + 3×10,81 = 203,35 кДж/моль.
Q1
= 170,92 + 3×10,81 = 203,35 кДж/моль.
Так как ![]() Q1 <
Q1 <
![]() Нсум, то тепла реакции хватает на дальнейшее её протекание
до перехода
Нсум, то тепла реакции хватает на дальнейшее её протекание
до перехода ![]() -Na2SO4
в
-Na2SO4
в ![]() -Na2SO4,
температура которого составляет 980 К. Учтя, что константы уравнения (4.14) для
-Na2SO4,
температура которого составляет 980 К. Учтя, что константы уравнения (4.14) для
![]() -Na2SO4 составляют
-Na2SO4 составляют
![]() =145,05 Дж/К, b= 54,60×10-3 Дж/К [5], определены
=145,05 Дж/К, b= 54,60×10-3 Дж/К [5], определены ![]() и
и ![]() , которые составляют соответственно 723,45
Дж/(моль×К) і 256,29×10-3
Дж/(моль×К). Тогда
, которые составляют соответственно 723,45
Дж/(моль×К) і 256,29×10-3
Дж/(моль×К). Тогда
![]() Н2 = 723,45(980 - 522) + (256,29×10-3) / 2×(9802
- 5222) = 419,49 кДж/моль.
Н2 = 723,45(980 - 522) + (256,29×10-3) / 2×(9802
- 5222) = 419,49 кДж/моль.
Так как теплота фазового перехода 1 моля ![]() -Na2SO4
в
-Na2SO4
в ![]() -модификацию
оценена в 0,33 кДж/моль [27], то
-модификацию
оценена в 0,33 кДж/моль [27], то
![]() Q2
= 203,35 + 419,49 + 3×0,33 = 623,83 кДж/моль.
Q2
= 203,35 + 419,49 + 3×0,33 = 623,83 кДж/моль.
![]() Q1 <
Q1 <
![]() Нсум.. Тогда, реакция протекает дальше, до температуры
плавления сульфата натрия, которая по [5] равняется 1157 К. С учетом того, что
Нсум.. Тогда, реакция протекает дальше, до температуры
плавления сульфата натрия, которая по [5] равняется 1157 К. С учетом того, что ![]() -Na2SO4 имеет следующие константы:
-Na2SO4 имеет следующие константы: ![]() =142,68 Дж/К, b=59,31×10-3 Дж/К получены такие
значения
=142,68 Дж/К, b=59,31×10-3 Дж/К получены такие
значения ![]() =716,34 Дж/(моль×К) і
=716,34 Дж/(моль×К) і ![]() =270,42×10-3
Дж/(моль×К).
=270,42×10-3
Дж/(моль×К).
![]() Н2 = 716,34(1157 - 980) + (270,42×10-3)/2×(11572
- 9802) = 177,94 кДж/моль.
Н2 = 716,34(1157 - 980) + (270,42×10-3)/2×(11572
- 9802) = 177,94 кДж/моль.
Теплота плавления 1 моля сульфата натрия по [5] составляет 23,01. Тогда
![]() Q2
= 623,83 + 177,94 + 3×23,01 = 870,8 кДж/моль.
Q2
= 623,83 + 177,94 + 3×23,01 = 870,8 кДж/моль.
Получается, что ![]() Q2 >
Q2 >![]() Нсум (870,8 кДж/моль > 845,33
кДж/моль). Таким образом, расчет Тад
в системе сводится к решению квадратного уравнения:
Нсум (870,8 кДж/моль > 845,33
кДж/моль). Таким образом, расчет Тад
в системе сводится к решению квадратного уравнения:
(845,33 – 623,83)×103 = 716,34(Тад - 980) + (270,42×10-3) / 2×(Т2ад - 9802),
0,1352Т2 ад + 716,34Тад - 1053368,88 = 0.
Д = 716,342 – 4 × 0,1352 × 1053368,88 = 1082804,89.
Тад = (-716,34 + 1040,58) / (2×0,1352 ) = 1199,1 К.
Определим теплоёмкости системы Fe2(SO4)3 – ZnO – NaO2
Согласно с формулой:
|
Ср =
|
(4.11) |
Ср = 845,33 / (1199,1 - 298) = 0,938 кДж/(моль×К).
4.2 Расчет системы Fe2(SO4)3–ZnSO4–NaO2
В данной системе при нагреваниия имеют место следующие реакции:
|
2NaO2 |
(4.12) |
| 3Na2O2 + Fe2(SO4)3
|
(4.13) |
| Na2O2 + ZnSO4 |
(4.14) |
|
NaO2 |
(4.15) |
| Na2O2 + |
(4.16) |
| Na2O2 + |
(4.17) |
где массовые стехиометрические коэффициенты составляют:
![]() 1 = M(Na2O2) / (M(NaO2) ×2) = 0.7091;
1 = M(Na2O2) / (M(NaO2) ×2) = 0.7091;
![]() 2 = M(O2)
/ (M(NaO2) ×2) = 0.2909;
2 = M(O2)
/ (M(NaO2) ×2) = 0.2909;
![]() 3 = М(Fe2(SO4)3) / (М(Na2O2) ×3) = 1.7094;
3 = М(Fe2(SO4)3) / (М(Na2O2) ×3) = 1.7094;
![]() 4 = М(Na2SO4)
/ (М(Na2O2) ×3) = 1.8205;
4 = М(Na2SO4)
/ (М(Na2O2) ×3) = 1.8205;
![]() 5 = М(Fe2O3)
/ (М(Na2O2) ×3) = 0.6838;
5 = М(Fe2O3)
/ (М(Na2O2) ×3) = 0.6838;
![]() 6 = М(O2) / (М(Na2O2)
×3) = 0.2051;
6 = М(O2) / (М(Na2O2)
×3) = 0.2051;
![]() 7 = М(ZnSO4) / М(Na2O2) = 2.0641;
7 = М(ZnSO4) / М(Na2O2) = 2.0641;
![]() 8 = М(Na2SO4)
/ М(Na2O2) =1.8205;
8 = М(Na2SO4)
/ М(Na2O2) =1.8205;
![]() 9 = M(ZnO) / M(Na2O2) = 1.0385;
9 = M(ZnO) / M(Na2O2) = 1.0385;
![]() 10 = M(O2) / M(Na2O2) =
0.2051.
10 = M(O2) / M(Na2O2) =
0.2051.
Тепловые эффекты реакций рассчитывают по формуле (4.15). По справочным данным [27]:
для NaО2 ![]() H0 = -261,65 кДж/моль,
H0 = -261,65 кДж/моль,
для Na2O2
![]() H0 = -513,21 кДж/моль,
H0 = -513,21 кДж/моль,
для О2 ![]() H0 = 0 кДж/моль,
H0 = 0 кДж/моль,
для Fe2(SO4)3 ![]() H0 = -2580,27 кДж/моль,
H0 = -2580,27 кДж/моль,
для Na2SO4 ![]() H0 = -1387,21 кДж/моль,
H0 = -1387,21 кДж/моль,
для Fe2O3
![]() H0 = -822,16 кДж/моль,
H0 = -822,16 кДж/моль,
для ZnО ![]() H0 = -348,11 кДж/моль,
H0 = -348,11 кДж/моль,
для ZnSO4 ![]() H0 = -1181,98 кДж/моль.
H0 = -1181,98 кДж/моль.
![]() Нр2 =(-1387,21×3 – 822,16)-(-2580,27 – 261,65×6) =-833,62 кДж/моль,
Нр2 =(-1387,21×3 – 822,16)-(-2580,27 – 261,65×6) =-833,62 кДж/моль,
![]() Нр3 = (-1387,21 - 348,11)-(-981,36 - 261,65×2)=-230,66 кДж/моль.
Нр3 = (-1387,21 - 348,11)-(-981,36 - 261,65×2)=-230,66 кДж/моль.
Суммарна реакция, что протекает в системе, имеет вид:
|
Fe2(SO4)3
+ 8NaО2 + ZnSО4 |
(4.18) |
Рассчитаем её тепловой эффект:
![]() Нсум = (-4×1387,21 – 822,16
- 348,11)-(-2580,27 – 981,36 – 261,65×8)=-1064,28
кДж/моль.
Нсум = (-4×1387,21 – 822,16
- 348,11)-(-2580,27 – 981,36 – 261,65×8)=-1064,28
кДж/моль.
Далее по справочным данным [5] определим константы эмперического уравнения действительной теплоёмкости по уравнениям (4.17).:
для ![]() -Na2SO4
:
-Na2SO4
: ![]() = 82,32 Дж/К ,
b = 154,36×10-3 Дж/К,
= 82,32 Дж/К ,
b = 154,36×10-3 Дж/К,
для ZnO: ![]() = 48,99
Дж/К , b = 5,10×10-3 Дж/К,
= 48,99
Дж/К , b = 5,10×10-3 Дж/К,
для
O2:
![]() = 31,46 Дж/К,
b = 3,39×10-3 Дж/К,
= 31,46 Дж/К,
b = 3,39×10-3 Дж/К,
для Fe2O3:
![]() =
97,74 Дж/К, b
= 72,13×10-3
Дж/К.
=
97,74 Дж/К, b
= 72,13×10-3
Дж/К.
Далее рассчитаем количество тепла, что выделяется при нагревании системы в интервале температур от 298 К до температуры фазового перехода Na2SO4 по формуле (4.18):
![]() Н1 =
Н1 = ![]() (522 - 298) +
(522 - 298) + ![]() / 2 (5222 - 2982).
/ 2 (5222 - 2982).
Константы ![]() и
и ![]() составляют:
составляют:
![]() = 4×82,32 + 97,74 + 48,99
+ 6×31,46 = 664,53 Дж/(моль×К) ,
= 4×82,32 + 97,74 + 48,99
+ 6×31,46 = 664,53 Дж/(моль×К) ,
![]() = 10-3(4×154,34 + 72,13 + 5,10 + 6×3,39) = 715,01×10-3 Дж/(моль×К).
= 10-3(4×154,34 + 72,13 + 5,10 + 6×3,39) = 715,01×10-3 Дж/(моль×К).
Тогда:
![]() Н1 = 664,53(522 - 298) + (715,01×10-3)
/ 2×(5222 - 2982) = 214,52
кДж/моль.
Н1 = 664,53(522 - 298) + (715,01×10-3)
/ 2×(5222 - 2982) = 214,52
кДж/моль.
Теплота перехода 1 моля ![]() -Na2SO4
у
-Na2SO4
у ![]() -модификацию составляет 10.81 кДж/моль [27]. Тогда
суммарное количесвто теплоты, что выделяется при нагривании системы до
температуры фазового перехода сульфата натрия осуществление этого перехода
определяется как:
-модификацию составляет 10.81 кДж/моль [27]. Тогда
суммарное количесвто теплоты, что выделяется при нагривании системы до
температуры фазового перехода сульфата натрия осуществление этого перехода
определяется как:
![]() Q1
= 214,52 + 3×10,81 = 257,76 кДж/моль.
Q1
= 214,52 + 3×10,81 = 257,76 кДж/моль.
Так как ![]() Q1 <
Q1 <
![]() Нсум, то тепла реакции хватает на дальнейшее её протекание
до перехода
Нсум, то тепла реакции хватает на дальнейшее её протекание
до перехода ![]() -Na2SO4
в
-Na2SO4
в ![]() -Na2SO4,
температура которого составляет 980 К. Учитывая, что константы уравнения (4.14)
для
-Na2SO4,
температура которого составляет 980 К. Учитывая, что константы уравнения (4.14)
для ![]() -Na2SO4 составляют
-Na2SO4 составляют
![]() =145,05 Дж/К, b= 54,60×10-3 Дж/К [5], определены
=145,05 Дж/К, b= 54,60×10-3 Дж/К [5], определены ![]() и
и ![]() , которые составляют соответственно 915,45
Дж/(моль×К) и 315,97×10-3
Дж/(моль×К). Тогда:
, которые составляют соответственно 915,45
Дж/(моль×К) и 315,97×10-3
Дж/(моль×К). Тогда:
![]() Н2 = 915,45(980 - 522) + (315,97×10-3) / 2×(9802
- 5222) = 527,956 кДж/моль.
Н2 = 915,45(980 - 522) + (315,97×10-3) / 2×(9802
- 5222) = 527,956 кДж/моль.
Так как теплота фазового перехода 1 моля ![]() -Na2SO4
в
-Na2SO4
в ![]() -модификацию
оценена в 0,33 кДж/моль [27], то
-модификацию
оценена в 0,33 кДж/моль [27], то
![]() Q2
= 257,76 + 527,956 + 3×0,33 =
786,706 кДж/моль.
Q2
= 257,76 + 527,956 + 3×0,33 =
786,706 кДж/моль.
![]() Q1 <
Q1 <
![]() Нсум.. Тогда, реакция протекает дальше, до температуры
плавления сульфата натрия, как по [5]
равняется 1157 К. С учетом того, что
Нсум.. Тогда, реакция протекает дальше, до температуры
плавления сульфата натрия, как по [5]
равняется 1157 К. С учетом того, что ![]() -Na2SO4
имеет следующие константы:
-Na2SO4
имеет следующие константы: ![]() =142,68 Дж/К, b=59,31×10-3 Дж/К полученные такие
значения
=142,68 Дж/К, b=59,31×10-3 Дж/К полученные такие
значения ![]() =906,44 Дж/(моль×К) и
=906,44 Дж/(моль×К) и ![]() =334,81×10-3
Дж/(моль×К).
=334,81×10-3
Дж/(моль×К).
![]() Н2 = 906,44(1157 - 980) + (334,81×10-3)/2×(11572 - 9802) = 223,760
кДж/моль.
Н2 = 906,44(1157 - 980) + (334,81×10-3)/2×(11572 - 9802) = 223,760
кДж/моль.
Теплота плавления 1 моля сульфата натрия по [5] составляет 23,01. Тогда:
![]() Q2
= 786,706 + 223,760 + 3×23,01
= 1079,496 кДж/моль.
Q2
= 786,706 + 223,760 + 3×23,01
= 1079,496 кДж/моль.
Получается, что ![]() Q2 >
Q2 >![]() Нсум (1079,496 кДж/моль > 1064,28
кДж/моль). Таким образом, расчет Тад
в системе сводится к решению квадратного уравнения:
Нсум (1079,496 кДж/моль > 1064,28
кДж/моль). Таким образом, расчет Тад
в системе сводится к решению квадратного уравнения:
(1064,28 – 786,706)×103 = 906,44(Тад - 980) + (334,81×10-3) / 2×(Т2ад - 9802),
которое может быть приведен к виду:
0,167405Т2 ад + 906,44Тад - 1326660,962 = 0.
Д = 906,442 – 4 × 0,167405 × 1326660,962 = 1709992,187.
Тогда:
Тад = (-906,44 + 1307,67) / (2×0,167405 ) = 1198,4 К.
Согласно формуле (4.19) теплоємкость системы составляет:
Ср = 1064,28 / (1198,4 - 298) = 1,182 кДж/(моль×К).
5. ЭКОЛОГИЧЕСКИЕ АСПЕКТЫ РАБОТЫ
В связи с постоянным ухудшением состояния окружающей среды и обострением экологической ситуации в настоящее время очень важной и актуальной задачей является поиск новых экологически чистых технологий и замена ними устаревших и не отвечающих требованиям нового времени технологий производства. По этой причине нами была рассмотрена возможность получения методом СРВ очень расспространненых во всех отраслях техники ферритных материалов. Поскольку традиционные способы их производства вредно влияют на окружающую среду вследствии образования сточных вод, то имеет смысл переход на технологический процесс, основанный на методе СРВ.
Этот метод дает возможность получать ферритные материалы без образования сточных вод и вредных выбросов. Единственными посторонними продуктами процесса СРВ является газообразный кислород и безвредный сульфат натрия. Таким образом, получение ферритов на основе самораспостраняющего взаимодействия является экологически чистым, что выделяет его из других существующих методов их синтеза.
Кроме этого направления, вызывает интерес использование процессов СРВ для переработки токсических отходов производства. Это возможно в результате перехода токсических растворителей солей в нерастворенные оксиды, что происходит во время самораспространяющегося воздействия. Вследствии нерастворимости образующихся таким образом оксидов, во время выпадания осадков они не растворяются и не проникают в почву, не принося вреда окружающей среде.
Таким образом, реакции, которые протекают в режиме СРВ, имеют большое значение для народного хозяйства в экологическом аспекте, так как могут служить основой экологчески чистых технологий и использоватся для переработки отходов производства.
ВЫВОДЫ
В работе рассмотрено самораспространяющееся взаимодействие в тройных системах Fe2(SO4)3 – ZnO - NaO2, ZnSO4 - Fe2(SO4)3 - NaO2 и Fe2O3 - ZnSO4 - NaO2. Методами ДТА, ИК-спектроскопии и рентгенофазового анализа изучены реакции, которые протекают в них при нагревании.
Исследование СРВ в тройных системах дало следующие результаты:
1. Выявление фаз цинкового феррита в системах Fe2(SO4)3 – ZnO - NaO2 и ZnSO4 - Fe2(SO4)3 - NaO2 методом РФА позволяет сделать выводы, что методом СРВ возможно получать ферриты.
2. Температура взаимодействия во всех тройных системах составляет 2500С, что позволяет сделать вывод об отсутствии влияния солей и оксидов. Назависимо один от другого сульфаты начинают реагировать с пероксидными соединениями натрия при стандартной для них температуре 2500С.
3. Установлено, что во всех трёхкомпонентных системах изменение скорости горения от количества в системе соответствующей соли подлежит полиноминальной зависимости с коэффициентом корреляции равной 1.
Главным результатом работы является возможность получения в тройных системах ферритов методом СРВ, поскольку этот метод может служить основой новых энергосохроняющих и экологически чистых технологий. Дальнейшая работа будет проводится с никелевыми тройными системами.
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ:
1. Процесссы горения в химической технологии и металлургии /Под ред. Мержанова А.Г. Ред.-изд.отдел ОИХФ АН СССР, г. Черноголовка, 1975г.-289с.
2. Росоловский В.Я., Никитина З.К., Синельников С.М. Взаимодействие перхлората лития и перхлората кальция с супероксидом и пероксидом натрия //Журн. неорг.химии. - 1995. - Т.40. - №1. - с. 6-11
3. Методические указания к лабораторным работам по курсу "Физика твердого тела" (для студентов специальности 0830) /Сост. В.В. Шаповалов, Ю.Н. Белогуров. - Донецк: ДПИ, 1988г. - 20 с.
4. Гороховский А.Н. Самораспространяющеееся взаимодействие супероксида и пероксида натрия с сульфатами некоторых s-, p-, d-металлов: Дис...канд. хим. наук: 02.00.01. - Д., 2000. - 193 с.
5. Картотека ASTM.
6. Краткий справочник физико-химических величин. Изд. 8-е, перераб. Под ред. А.А. Равделя и А.М. Пономаревой. - Л.: Химия, 1983 - 232 с.
 alina865@yandex.ru
alina865@yandex.ru