Магістратура Донецького національного технічного университету |
 |

|
Борисенко Роман Євгенович
Факультет: екології та хімічної технології
Спеціальність: хімічна технологія високомолекулярних сполук (ТХВ)
Тема випускної роботи: розробка синтезу, фізико-хімічні дослідження заміщених солей флуорен-9-іл амонію та флуорен-9-ілідів амонію на їх основі
Керівник: Мисик Дмитро Дем'янович
|
ДонНТУ
Портал магистров
Отчёт о поиске
Перечень ссылок
Библиотека
История украинской авиации
Биография ( Рус
Укр
Eng )
Написать можно сюда: rombor2008@mail.ru
АВТОРЕФЕРАТ ( In english )
Однією з важливих задач хімічної науки в теперішній час є синтез органічних сполук з високою електропроводністю та високою фотоелектричною чутливістю [1-3].
Серед органічних полімерів найбільш високу фотоелектричну чутливість має полівінілкарбазол. Однак його чутливість у багато разів менше ніж у аморфного селену [1]. Чутливість полівінілкарбазолу може бути підвищена додаванням у полімер органічних речовин , які проявляють сильно виражені електроноакцепторні властивості та здатні за рахунок цього утворювати з карбазольними угрупуваннями комплекси з переносом заряду.
Полінітрофлуоренони привернули увагу дослідників у зв'язку із сенсибілізацією ними електрофотопроводимості карбазолмістких полімерних напівпровідників [4]. Карбазолмісткі полімери проявляють електропровідність під дією ультрафіолетового випромінювання. Введення в них добавок три- і тетранітрофлуоренонів призводить у результаті донорно-акцепторної взаємодії з карбазольними фрагментами полімерів до утворення комплексів з міжмолекулярним переносом заряду і зміщенню електрофотопроводимості у видиму область спектру. Інтенсивні дослідження композицій на основі карбазолмістких полімерів з добавками полінітрофлуоренонів були спрямовані на розробку функціональних матеріалів для запису, зберігання й відображення оптичної інформації [4, 5]. Створення й дослідження фотофізичних властивостей органічних композитних матеріалів, які мають напівпровідникові властивості, стимулювало вдосконалювання й розробку синтезу їх флуоренових компонентів [6–8]. Численні дослідження, які наведені у оглядах [1–4], показали, що найбільш ефективним сенсибілізатором полівінілкарбазолу є 2,4,7-тринітрофлуоренон. Електрографічні шари комплексу полівінілкарбазолу та 2,4,7-тринітрофлуоренону за чутливістю не поступаються селену. Однак погана адгезія до металічної підложки, крихкість плівок та висока температура склування обмежують можливість застосування полівінілкарбазолу як фотопровідного матеріалу. Більш перспективним є використання N-поліепоксипропілкарбазолу, плівки якого не мають таких недоліків. Окрім того було встановлено, що значно ефективнішими сенсибілізаторами, а ніж комплекси з міжмолекулярним переносом заряду, поліепоксипропілкарбазолу є флуоренові сполуки з внутрішнім молекулярним переносом заряду [5]. Серед них особливо активними виявилися 9-дитіолілиденполінітрофлуорени, поглинання якими електромагнітного випромінювання з довжиною хвилі 600–700нм супроводжується переносом заряду з гетероциклічного фрагменту на флуореновий [9]. Сполуки з розділеними негативним зарядом на флуореновому фрагменті і позитивним на гетероциклічному фрагменті, наприклад внутрішньо-іонні флуорен-9-ілиди піриднію, в якості сенсибілізаторів не досліджувалися. Відомості про фото-фізичні властивості композитних матеріалів, які містять внутрішньо-іонні флуоренові сполуки у літературі відсутні. Але вони могли б представити певний інтерес у розвиток уявлень про електронні переходи і механізм фотогенерації носіїв заряду в органічних напівпровідникових композитних матеріалах [5]. Метою даної роботи і є розробка та дослідження властивостей таких сполук.
Численні дослідження, які були присвячені вивченню хімічних властивостей флуоренону, дозволяють зробити висновок про можливість одержання із флуорену ряду цінних продуктів.
Введення в молекулу флуоренону нітрогруп надає їй електроноакцепторні властивості тим більше, чим більше нітрогруп у ній міститься, що є передумовою утворення комплесів з міжмолекулярним переносом заряду з карбазольними фрагментами полімерів. Про цю залежність можна судити на підставі значень напівхвиль полярографічного відновлення нітрофлуоренонів. Як видно з таблиці 1 потенціал напівхвилі 2,7-динітрофлуоренона, наприклад, на 0,395В зміщений в область від’ємних значень у порівнянні з 2,4,5,7-тетранітрофлуореноном [10]. Тому розробці методів синтезу полінітрофлуоренонів було присвячено багато робіт.
Таблиця 1 – Значення напівхвиль полярографічного відновлення полінітрофлуоренонів
| Сполука |
E1/2,В |
| 2,4-динітрофлуоренон |
-0,465 |
| 2,5-динітрофлуоренон |
-0,498 |
| 2,6-динітрофлуоренон |
-0,555 |
| 2,7-динітрофлуоренон |
-0,645 |
| 3,6-динітрофлуоренон |
-0,538 |
| 2,4,7-тринітрофлуоренон |
-0,465 |
Різні електроноакцепторні замісники в молекулу флуоренону можна ввести реакціями електрофільного заміщення. Розглянемо реакційну здатність флуоренону в цих реакціях. Для цього порівняємо будову флуоренону (I), флуорену (II) і дифенілу (III):
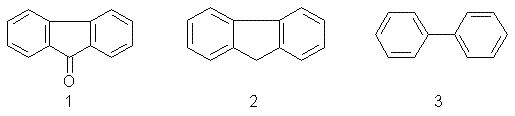
Флуоренон (1) і флуорен (2) можна розглядати як дифеніл (3), у якому два атоми водню о,о’-положень замінені на карбонільну й метиленову групи.
Електрофільне заміщення в дифенілі йде в о,п-положення до одного з фенільних радикалів, які активізують заміщення в ці положення (фактор парціальної швидкості нітрування дифенілу в пара-положення за оцінками [11] дорівнює 11), але дезактивують мета-заміщення за рахунок «-I»-ефекту.
За оцінками [12] активуючий вплив фенільного радикала на бензольне ядро в порівнянні з метильним повинен бути в 39–390 разів сильнішим, але фактично дифеніл і толуол мають порівнянну активність. Цю невідповідність можна пояснити стеричним впливом орто-атомів водню. Вони перешкоджають планарному розташуванню бензольних кілець в σ-комплексі (4), який виникає в результаті приєднання електрофіла, що дестабілізує його:
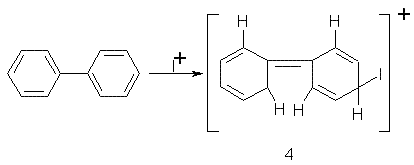
Такий дестабілізуючий ефект відсутній у σ-комплексах, які утворються із флуорену (2). Метиленова група у флуорені (2), а також карбонільна група у флуореноні фіксують фенільні радикали в одній площині. У σ-комплексах (5) і (6), що утворюються в результаті приєднання електрофільних реагентів до флуорену (2), внаслідок їх планарної будови має місце більш ефективна делокалізація заряду, ніж в σ-комплексах (4).
Тому утворення їх енергетично більш вигідне та, як наслідок цього, наприклад, швидкість бромування флуорену в оцтовому ангідриді на три порядки вища ніж дифенілу:
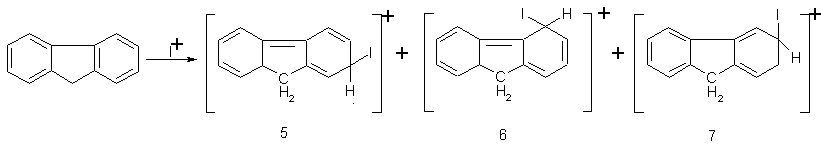
Співвідношення продуктів заміщення в різні положення, наприклад, нітрування флуорену нітратною кислотою в оцтовому ангідриді [13], узгоджується з енергетичною вигідністю утворення σ-комплексів (5–7).
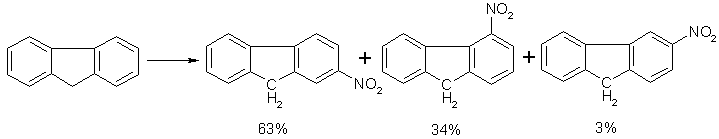
Більша енергетична вигідність утворення σ-комплексів (5–6) у порівнянні з (7) може бути пояснена делокалізацією заряду на фенільні радикали.
Деяка стабілізація σ-комплексу (7) метиленовою групою досягається за рахунок ефекту гіперкон’югації. Однак цей ефект стабілізує й комплекси (6–7). Одна із численних резонансних структур (8), за допомогою якої описують електрону будову флуорену, показує передачу електронного впливу метиленової групи в положення 2,7 [11].
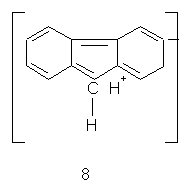
Перетворення метиленової групи в карбонільну виключає активізацію за рахунок ефекту гіперкон’югації. Сама карбонільна група діє до цього ж як електроноакцепторний замісник. Тому флуоренон проявляє меншу активність у реакціях електрофільного заміщення, ніж флуорен. Подальше зменшення активності флуоренону може мати місце в тих випадках, коли реакції проводяться в сильно кислих середовищах. На відміну від флуорену флуоренон у цих умовах піддається специфічній сольватації (9). Внаслідок відносно високої основності можливе також і утворення солі (10) [14, 15]. При розчиненні флуоренону в концентрованій сульфатній кислоті, наприклад, за рахунок утворення солі розчин забарвлюється в темно-вишневий колір.
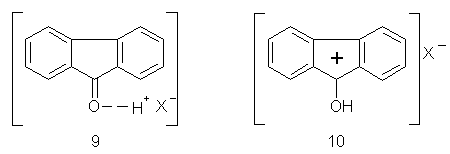
Дезактивуючий вплив карбонілу й сильно кислих середовищ не змінюють напрямок заміщення при перебігу електрофільних реакцій, оскільки при перетворенні флуорену у флуоренон зберігається плоска будова молекули. Як і у випадку флуорену заміщенню піддаються атоми водню в положеннях 2,4,5,7. Це ілюструють розглянуті нижче реакції одержання π-комплексоутворювачів і проміжних сполук для їхнього синтезу.
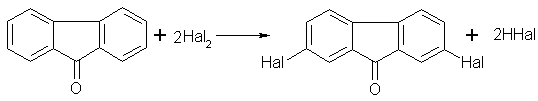
Електрофільне галогенування флуоренону бромом у водному середовищі при температурі вище 100oC дає моно- і дибромфлуоренони [16]. Йодування флуоренону здійснено в присутності азотної кислоти [18, 19]. При цьому отримані 2,7-дийодфлуоренон і 2,7-йоднітрофлуоренон, які пропонується використовувати як добавки, які підвищують фоточутливість матеріалів.
Орієнтація й послідовність вступу нітрогруп при нітруванні флуоренону описується схемою :
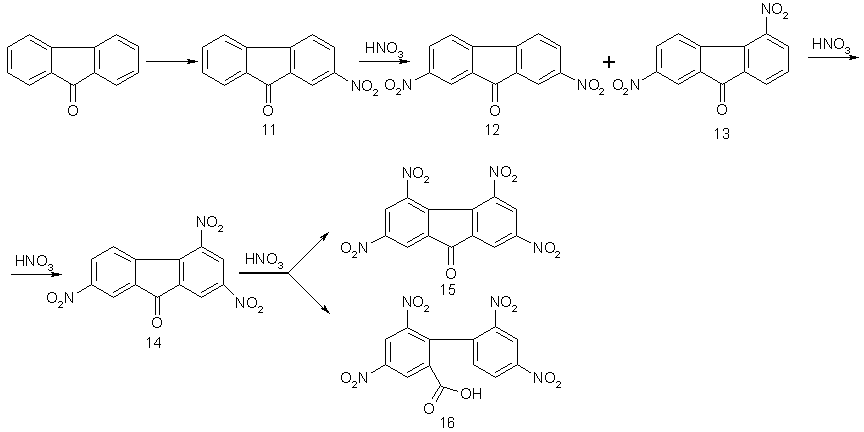
Внаслідок нітрування флуоренону нітратною кислотою, що димить, утворюється 2,7-динітрофлуоренон (12) [20]. Введення третьої нітрогрупи здійснено в киплячих розчинах суміші сірчаної та азотної кислот [20–23]. Автори роботи [20] помилково приписали будову сполуці, що утворюється, 2,3,7-тринітрофлуоренона. У більш пізніших дослідженнях [24] було показано, що 2,5-динітро- і 2,7-динітрофлуоренони (12, 13) під час нітрування дають одну й ту саму сполуку – 2,4,7-тринітрофлуоренон. Він же утворюється й при циклізації 2,4,4’-тринітро-2-карбоксидифенілу [25]. Вичерпне нітрування флуоренону закінчується на утворені 2,4,5,7-тетранітрофлуоренону (15) [26, 27]. Сполука (15) утворюється в жорстких умовах і, як показали нові дослідження [28], нітрування супроводжується частковим розкриттям п’ятичленного циклу, причому цикл розкривається на стадії перетворення тринітрофлуоренону (14) у тетранітрофлуоренон (15). Тетранітродифенілкарбонова кислота (16) циклізується в киплячому 60%-му олеумі [25]. Поряд з утворенням тетранітрофлуоренону (15) має місце також реакція декарбоксилування. Відомі й широко використовувані [23, 30] методи одержання 2,4,7-тринітрофлуоренону мають певні недоліки. Розглянемо спочатку описане нітрування флуоренону до 2,4,7-тринітрофлуоренону в киплячій суміші нітратної (d=1,59–1,63г/см3), концентрованої сульфатної (d=1,84г/см3) і крижаної оцтової кислот [23]. Процес нітрувания супроводжується рясним виділенням оксидів азоту, а використання оцтової кислоти як розчинника флуоренону й розріджувача нітруючої суміші збільшує його вибухонебезпечність. Для його реалізації в промисловості виникає необхідність у спеціальному дорогому устаткуванні. До недоліків цього методу варто віднести й застосування великого надлишку нітратної кислоти (на моль флуоренону використовується близько 100 моль нітратної кислоти, тобто більш ніж тридцятикратний надлишок).
Спосіб одержання 2,4,7-тринітрофлуоренону, який описано в американському патенті [30], позбавлений зазначених недоліків. Згідно з даними патенту нітрування флуоренону до 2,4,7-тринітрофлуоренону можна здійснити за більш низької температури й мольному співвідношенні флуоренон:нітратна кислота яке дорівнює 1:13-40 шляхом додавання флуоренону до суміші сульфатної і нітратної кислот з наступним витримуванням реакційної маси тривалий час. Перевага цього методу полягає й у тім, що нітрування фактично протікає не у трьох-, а у двохкомпонентній суміші. Однак вихід 2,4,7-тринітрофлуоренону за цим способом не перевищує 65% і майже на 15% нижчій, ніж за першим, який запропонований Вулфолком Э. і Орчином М. [23].
Ось чому виникла необхідність у розробці методики, яка позбавлена зазначених вище недоліків. У серії експериментів [29] дослідники дійшли до висновку, що технологічний процес нітрування флуоренону до 2,4,7-тринітрофлуоренону одержує більш просте й зручне оформлення, якщо нітрування флуоренону проводити в розчинах сульфатної кислоти. Вибір сульфатної кислоти у якості розчинника диктувався наступними міркуваннями:
- по-перше, розчинення флуоренону в концентрованій сірчаній кислоті легко відбувається при кімнатній температурі без істотного теплового ефекту;
- по-друге, розчини флуоренону в сірчаній кислоті достатньо стабільні, що дозволяє використовувати їх у наступній операції нітрування;
- по-третє; за рахунок сильної сольватації флуоренону сульфатною кислотою (має місце й утворення солі [14, 15, 20], про що також свідчить забарвлення розчину в інтенсивний вишневий колір), знижується його активність, що особливо важливо на сильно екзотермічній стадії мононітрування.
Використання флуоренону у вигляді розчинів у сульфатній кислоті дозволило розробити більш гнучку методику одержання 2,4,7-тринітрофлуоренону, ніж розглянуті вище [23, 30]. При додаванні концентрованої азотної кислоти (d=1,5г/см3) до розчину флуоренону в сульфатній кислоті не утворюється в початковий момент великого надлишку активного нітруючого реагенту, легко досягається регулювання температурного режиму процесу швидкістю додавання нітратної кислоти, а за рахунок ефективного перемішування швидко досягається однорідність реакційної маси. Нітрування флуоренону починається при 20–25°С, а після введення всієї нітратної кислоти завершується при температурі 60–65°С.
При мольних співвідношеннях нітратна кислота:флуоренон 6,5-24:1 нітрування флуоренону до тринітрофлуоренону при 60–65°C закінчується протягом однієї години.
Вихід 2,4,7-тринітрофлуоренону близько 80% досягається при використанні 6,5–26 моль нітратної кислоти на моль флуоренону та 15мл концентрованої сульфатної кислоти на 1г флуоренону. При цьому витрати нітратної кислоти в кілька разів нижче порівняно з кількістю, зазначеною в патенті [30]. Відповідно до патенту мольне співвідношення флуоренону та нітратної кислоти, що забезпечує високий ступінь перетворення флуоренону в тринітрофлуоренон, повинне бути не нижче 1:15, а найбільш сприятливе 1:30
Розглянуті недоліки методик синтезу тринітрофлуоренону ще в більшій мірі стосуються виготовлення тетранітрофлуоренону:
У зв'язку з викладеним представлялося цікавим дослідити можливість одержання тетранітрофлуоренону із флуорену шляхом зміни послідовності реакцій окиснення й нітрування, а саме: спочатку здійснити нітрування флуорену до тетранітрофлуорену, а потім окисненням останній перевести в тетранітрофлуоренон [20]:
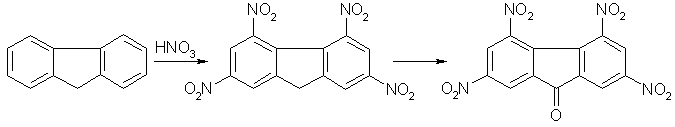
Виходячи з теоретичних уявлень слід було очікувати, що нітрування флуорену завдяки активуючому впливу метиленової групи повинне протікати легше, ніж нітрування флуоренону, у якому карбонільна група чинить дезактивуючий вплив у реакціях електрофільного заміщення. Літературні дані по нітруванню флуорену [32] і флуоренону [23] до тринітрозаміщених і наведені нижче результати по нітруванню флуорену до тетранітрофлуоренону підтверджують це припущення [29].
Дослідниками було здійснено нітрування флуорену сумішшю поліфосфатної й нітратної кислот при застосуванні п'ятикратного надлишку останньої, в умовах, близьких до описаних в роботі [32]. При цьому був отриманий не три-, а тетранітрофлуорен з виходом 60,6%. Надалі було досліджено утворення тетранітрофлуорену із флуорену при використанні в якості нітруючого реагенту суміші нітратної та сульфатної кислот. Виявилося, що при мольному співвідношенні флуорен:нітратна кислота:сульватна кислота яке дорівнює 1:22:32–48 тетранітрофлуорен може бути отриманий з виходом 68–70% [29]. Таким чином, на стадії нітрування флуорену до тетранітрофлуорену витрати азотної й сірчаної кислот становлять відповідно 18,6% і 25,6–38% від кількостей кислот, застосовуваних під час нітрування флуоренону до 2,4,5,7-тетранітрофлуоренону [26,27]. Більш м'якими умовами є й умови нітрування: тривалість реакції не перевищує трьох годин, а максимальна температура на завершальній стадії не вище 70oC.
Застосування трикомпонентних нітруючих сумішей, що складаються з нітратної, оцтової, азотної та сульфатної кислот, при широкому варіюванні їх складу не дає переваг перед описаними вище.
Будова 2,4,5,7-тетранітрофлуорену доведена окисненням його у 2,4,5,7-тетранітрофлуоренон. Окиснення триоксидом хрому протікає гладко при температурі 55–65°C і тетранітрофлуоренон утворюється з виходом 94–96%. При цьому сумарна витрата сульфатної кислоти на стадіях нітрування флуорену й окиснення тетранітрофлуорену не перевищує 47–60% від кількостей її, застосовуваних при нітруванні флуоренону [26].
Пізніше [7] було реалізовано нітрування флуорену до тетранітрофлуорену при температурі від -10 до 20оС з використанням тільки однієї концентрованої нітратної кислоти, яка після розбавлення і нагрівання до кипіння діяла вже як окислювач. Це дозволило здійснити перетворення флуорена в тетранітрофлуоренон в одну стадію зі значним скороченням витрат кислот.
Наведені дані були взяті до уваги при відпрацюванні методик нітрування перхлоратів флуорен-9-іл-піридинію.

Схема синтезу 2,4,7-тринітрофлуорен-9-іліду піридинію
Характеристика анімації: кількість повторень – 5; кількість кадрів – 13; об'єм – 47521 байт.
- Мыльников В.С. Фотопроводимость органических полимеров// Успехи химии.– 1974.– Т.43, №10.– С. 1821.
- Праведников А.Н., Котов Б.В., Тверский В.А. Полимерные материалы с особыми электрофизическими свойствами на основе ион-радикальных солей и комплексов с переносом заряда// Журнал Всесоюзного химического общества им. Д.И. Менделеева.– 1978.– Т.23, №5.– С. 524–536.
- Передереева С.Н., Орлов И.Г., Черкашин М.И. Донорно-акцепторные комплексы полимеров. “Журнал Всесоюзного химического общества им. Д.И. Менделеева”.- 1978.- Т.23, №5.- С.537-547
- Кувшинский Н.Г., Давыденко Н.А., Комко В.М.Физика аморфных молекулярных полупроводников.-Киев.-“Лыбидь”.-1994.-174с.
- Давыденко Н.А., Ищенко А.А., Кувшинский Н.Г. Фотоника молекулярных композитов на основе органических красителей.-Киев.-Наукова думка.-2005.-296с.
- Мысык Д.Д., Перепичка И.Ф., Костенко Л.И. Способ получения 2,4,5,7-тетранитрофлуоренона. Авторское свидетельство СССР, №1050249.–1983.
- Мысык Д.Д., Андриевский А.М., Перепичка И.Ф. и др., Способ получения тетранитрофлуоренона. Авторское свидетельство СССР, №1573020.–1990.
- Мысык Д.Д., Перепичка И.Ф, Эджиня А.С.,.Нейланд О.Я. Электроноакцепторы флоренового ряда. IV. Синтез и оценка по редокспотенциалам электроноакцепторных свойств нитрозамещенных 4-цианофлуоренов//Latviyas Kimiyas zurnals ( Латвийский химический журнал).– 1991.– №6.– С.727–735.
- Davidenko N.A., Ishchenko A.A., Kostenko L.I., Kuvshinskii N.G., Kulinich A.V., Melenevskii D.A., Vysyk D.D., Mysyk R.D., Pavlov V.A., and Chuprina N.G. Holographic Recording Media Based on Systems with Intramolecular Charge Transfer/ High Energy Chemistry.– 2005.– Vol. 39, No. 4.– P. 254–256.
- Mukhtrjee T.K. Elekctron affinities of polunuclear acceptors nitro derivatives of fluoren-9,2-malononitrile.
- Де ла Мар П.Б.Д. Некоторые современные данные о реакционной способности и ориентации при реакциях галогенирования в ароматическом ряду. В кн. “Теоретическая органическая химия”, Изд. ИЛ. М.– 1963.– С. 275–278.
- Stock L.M., Brown H.C. An examination of the applicability of the selectivity relationship to the electrophilic substitution reactions of biphenyl and fluorene. “j. Amer. Chem. Soc.”– 1962.– V.84, №7.– P.1242–1248.
- Dewar M.I.S., Urch O.C. Electrophilic substitution. Part XII. The nitration of diphenylmetane, fluorene, dyphenylether, dibenzofuran, diphenilamin and carbazole; relative reactivities and partial rate factors. “j. Amer. Chem. Soc.”– 1958.– №9.– P. 3079–3084.
- Bostwick D., Henneike H.F., Hopkins H.P. Relative basicities of cyclic polyenones from hydrogenbonding studies. “j. Amer. Chem. Soc.”.–1975.– V.97.– №6, P.1505–1509.
- Шелепин О.Е. Химия перициклических соединений. Изд. Ростовского университета.– 1973.– С. 67, 89.
- Schmidt J.,Baner K. Über die Einwirhung von Brom and Fluoren. “Ber.”– 1905.– B.38.– S.3764–3767.
- Верещагин А.Н. Индуктивный эффект. Константы заместителей для корреляционного анализа. М «Наука».– 1988.–с
- Слюсарчук В.Т., Новиков А.Н. Прямое йодирование фенантренхинона, флуорена и его производных. “Ж.Орг.Хим.”, 1967.– Т.3, №7.– С.1323–1325.
- Авт.св. СССР, №300456. РЖХим, 1971.– 23Н184П.
- Schmidt J.,Baner K. Über die Einwirkung von Salpetersänre auf Fluorenon und die Abkömmlinge der entstehenden Nitroderivate. “Ber.”.– 1905.– B.38.– S.3758–3763.
- Orchin M., Woolfolk E., Molecular Complexes with 2,4,7-Trinitrofluorenone. “J. Amer. Chem. Soc.”– 1946.– V.68.– P.1727–1729.
- Orchin M., Reggel L., Woolfolk E.O. Molecular Complexes with 2,4,7-Trinitrofluorenone. II. “J. Amer. Chem. Soc.”– 1947.– V.69, №5.– P.1225–1227
- Вулфолк Э., Орчин М. 2,4,7-тринитрофлуоренон. В кн. ”Синтез органических препаратов”, ИЛ. М.–1953.– Сб.4.– С.490.
- Ray F.E., Franeis W.C. Polynitro compounds of Fluorene. “J. Org. Chem.”–, 1943.– V.8, №1.– P.52–59.
- Андриевский А.М., Поплавский А.Н., Дюмаев К.М. Действие олеума на нитрозамещённые 2-карбоксибифенила. “Журнал Всесоюзного химического общества им.Д.И. Менделеева”.– 1979.– Т.24, №4.– С.391–392.
- Newman M.S., Lutz W.B. α-(2,4,5,7-Tetranitro-9-fluorenylideneaminooxy)-propionic Acid, a new Reagent for Resolution by Complex Formation. “J. Amer. Chem. Soc.”.– 1956.– V.78, №11.– P.2469–2473
- Newman M.S., Bode H. 2,4,5,7-Tetranitrofluorenon. “Organic Synthesis”, 1962.– V.42.– P.95–96.
- Андриевский А.М., Сидоренко Е.Н., Поплавский А.Н., Дюмаев К.М. К вопросу о нитровании флуоренона. “ЖОрХ”.– 1979.– Т.15, №9.– С.2007–2008
- Мысык Д.Д., Перепичка И.Ф., Семёнов Н.С., Сивченкова Н.М. Разработка методов получения сенсибилизаторов для светочувствительных материалов.– 1980., 83с.
- Пат. США, №3721713; РЖХим, 1974, 1Н158П.
- Dorset D.L., Hybl A., Ammon H.L. The crystal structure of 2,4,7-trinitro-9-fluorenone. “Acta crystallogr.”– 1972.– B28, №11.– P.3122–3127.
- Козлов Н.С., Клейн А.Г., Пулина М.Ш. Нитрование нафталина и флуорена смесью азотной и полифосфорной кислот. “Изв. Высших учебных заведений. Хим. и хим. технология”.– 1974.– Т.17, №7.– С.1043–1046
©ДонНТУ Борисенко











