|
|
|
|
| Русский язык | Українська мова | English language |
| ДонНТУ |
|
Портал магистрів ДонНТУ |
| Автобіография |
| Бібліотека |
| Посилання |
| Звіт про пошук |
| Мої кактуси |
|
ЗМІСТ
Цілі і задачі Актуальність роботи Наукова новизна Плановані практичні результати Огляд досліджень і розробок за темою Хімічний метод знефенолення Синтез и реакційність сульфохлоридів анілідів сульфокислот ВИСНОВКИ ЛІТЕРАТУРА Посилання на інтернет джерела | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Автореферат |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Цілі і задачі | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Цілі і задачі, які вирішуються в даній роботі, - виявлення кінетичних закономірностей реакції нейтрального гідролізу ряду сульфохлоридів анілідів сульфокислот у водно-органічному середовищі залежно від температури і структурних особливостей субстрату, для обгрунтування запропонованої технології хімічного очищення стічних вод коксохімічних підприємств хімічним методом. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Актуальність роботи | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Проблема утилізації промислових стічних вод і їх очищення від наявних в них токсикантов є однією з найважливіших проблем екології. Феноли, які є одним з найбільш поширених токсичних забруднювачів, є в той же час важливими і дефіцитними компонентами органічного синтезу. Тому з концентрованих фенольних стічних вод вигідніше витягувати феноли або переводити їх в малотоксичні продукти, які можуть знайти подальше застосування, а не просто знищувати їх, піддаючи деструкції шляхом біохімічного окислення, термічного розкладання і ін. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Наукова новизна | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Наукова новизна роботи полягає в синтезі нових похідних ароматичних сульфохлоридів, дослідженні їхньої реакційності при нуклеофільному заміщенні, виявленні наявності зони ізокінетичної температури в робочому діапазоні, запропонованому варіанті практичної реалізації методу хімічного очищення стічних вод. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Плановані практичні результати | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
В результаті роботи, що виконується по даній темі, планується розробити і обгрунтувати техніку і технологію для проведення процесу очищення стічних вод коксохімічних підприємств хімічним методом. Надалі планується патентування схеми і апаратів, промислові випробування і впровадження у виробництво. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Огляд досліджень і розробок за темою | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Одним з поширених токсичних забруднювачів стічних вод хімічних виробництв є феноли. Основні джерела фенольного забруднення природних вод - коксохімічні, сланцепереробні, лісохімічні підприємства, виробництва фенолфталеїну, фенолформальдегідних смол, саліцилової кислоти і салолу, шпалопропіточні заводи, підприємства нафтохімії. Для знефенолювання промислових стоків найчастіше застосовуються пароциркуляційний, екстракційний, адсорбційний, біохімічний методи. Слід зазначити, що феноли є в той же час важливою і дефіцитною сировиною органічного синтезу і утилізувати їх шляхом деструкції не завжди економічно доцільно [1,2]. Паровий метод знефенолювання стічних вод у поєднанні з мокрим гасінням коксу і замкнутим циклом фенольних вод або з біологічною доочисткою набув на вітчизняних коксохімічних заводах широкого поширення. Знефенолююча установка призначена для видалення основної частини фенолів з надсмольной води і сепараторної води смолоперегінного цеху (за наявності цього цеху на заводі), що пройшла обробку в аміачній колоні, з отриманням фенолятов встановленої якості відповідно до вимог технічних умов. Ступінь знефенолювання стічних вод на установці повинен бути не менше 85%, залишковий вміст фенолів в обробленій воді повинен складати не більше 0,2 г/л. Суть цього методу полягає в тому, що із стічної води, нагрітої до 100—102° С, феноли видуваються великою кількістю гострої водяної пари, а потім суміш пари і фенолів пропускають через нагрітий до 102—103° С поглинювальний розчин лугу, який взаємодіє з фенолами з утворенням фенолятів. Основним апаратом парової установки є знефенолюючиий скрубер, що складається з верхньої випарної частини з дерев'яною хордовою насадкою, в якій з води видуваються феноли, і нижньої поглинювальній частини, що має металеву спіральну насадку, в якій з пари розчином їдкого натра феноли і крезоли зв'язуються у феноляти і крезоляти натрію за рівняннями:
C6H6OH + NaOH → C6H6ONa +Н2О; (у малій кількості утворюються крезоліти і інші солі натрію). Ця суміш фенолятів і крезолятів називається фенолятами.
Очищена водяна пара знову використовується для знефенолювання води у верхній частині скрубера, тобто знаходиться в замкнутому циклі. Екстракційний метод знефенолювання
Екстракційні методи знефенолювання стічних вод придатні для витягання фенолів з досить концентрованих вод, що містять більше 2 г/л фенолів. Суть методів полягає в тому, що фенолвмістна вода змішується з будь-яким рідким розчинником, в якому феноли розчиняються легше, ніж у воді, сам же розчинник у воді не розчиняється, внаслідок чого після обробки рідини розпадаються на два шари, що легко розділяються декантацією. Один шар складається зі знефеноленної води, другий є розчинником з поглиненими з води фенолами, звідки вони витягуються або відгоном розчинника, або перетворенням фенолів у феноляти шляхом обробки розчину їдким лугом. У обох випадках звільнений від фенолів розчинник знову йде на промивку—екстракцію води від фенолів.
Біохімічні методи знефенолювання
Біохімічні методи засновані на здатності мікроорганізмів окисляти феноли. Кінцевими продуктами біохімічного розкладання домішок, що містяться в стічних водах, є з'єднання вищого ступеня окислення — діоксид вуглецю (СО2) і вода. Ці методи забезпечують глибоке очищення стічних вод в результаті розкладання фенолів. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Хімічний метод знефенолення | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Існуючі методи знефенолювання мають ряд обмежень в своєму застосуванні і не завжди забезпечують необхідний ступінь очищення, а також є високовитратними [3]. У зв'язку з цим перспективним представляється хімічний метод очищення фенольних стоків шляхом сульфохлорування.
ArSO2Cl + РhOH → ArSO2OPh +HCl (1)
Безумовно, від ступеня вірогідності протікання процесу (2) залежить глибина і ефективність знефенолювання, сама можливість застосування цього методу. Ускладнюючим чинником є підвищення розчинності субстрату при збільшенні частки органічною складовою стоків, що забезпечує зростання швидкості обох реакцій не однаковою мірою.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Синтез и реакційність сульфохлоридів анілідів сульфокислот | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Зроблено синтез і проведено дослідження особливостей швидкості і механізму гідролізу (2) ряду знов отриманих сульфохлоридів. Всього отримано 7 неописаних у літературі з'єднань по методиці [5]. Синтез N–бензолсульфонил–2,6-діметиланіліну
Реагенты: Алкилірування N–бензолсульфоніл–2,6-діметиланіліну
Реагенты: Сульфохлорування N–метил–N–бензолсульфоніл–2,6-діметиланіліну
Реагенты:
Очищення сульфохлоридів анілідів сульфокислот
Субстрати,що були отримані по вищезгаданій методиці достатньо чисті (див. нижче) для кінетичних вимірювань, але з'єднання серії 5-[N(XАrSO2)–N-Me]-2,4-Me2-C6H2SO2Cl додатково очищають перекристалізацією з діоксану.
Підтвердження структури отриманих з'єднань
Структура отриманих з'єднань підтверджена методом визначення молярної маси субстрата за допомогою кислотно-основного титрування, перевіркою наявності вільного хлору по методиці [6], а також аналізом спектрів ПМР.
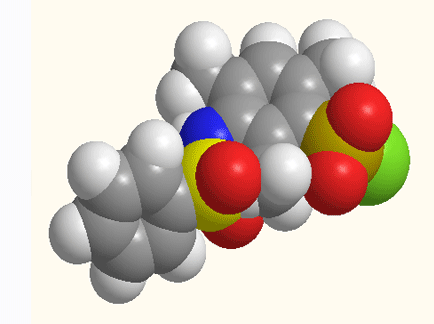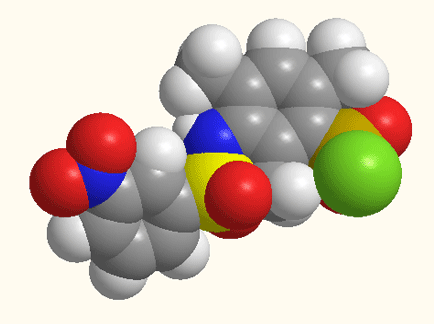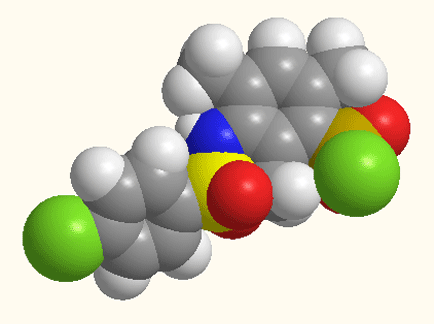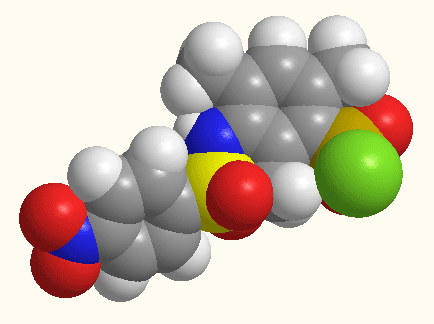
Малюнок 1 - Структурна будова 5-[N(ХArSO2)-NMe]–2,4,6-(CH3)3ArSO2Cl,
Кінетика нейтрального гідролізу синтезованих субстратів
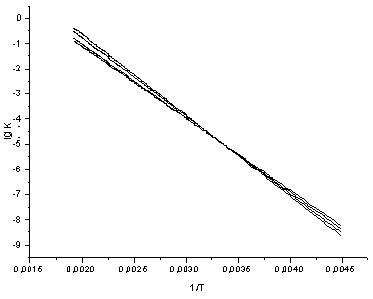
Об'єкти дослідження: N-аренсульфоніл-N-метиламінобензолсульфохлориди загальної формули 5-[N(ХArSO2)-NMe]–YArSO2Cl, где Х= 4-Ме, Н, 4-Сl,4-F, 3-NO2, 4-NO2; Y = 2,4-Ме2, 2,6-Ме2, 2,4,6-Ме3. Середовище: 70% водний діоксан (в.д.). Інтервал температур 303-323К. Вибір умов експерименту визначався можливостями проведення аналогії з складом і температурними характеристиками стічних вод коксохімічних виробництв ( табл.1-3).
Таблиця 1. - Ефективні константи швидкості kaефф • 104 (с-1) і параметри активації ПС для гідролізу 5-[N(ХArSO2)-NMe]–2,4-Me2С6 Н2SO2Cl в 70% в.д. (серія I)
а. Примітка. Погрішність у визначенні kефф перевищує 3%
Таблиця 2. - Ефективні константи швидкості kaефф • 104 (с-1) і параметри активації ПС для гідролізу 5-[N(ХArSO2)-NMe]–2,6-Me2С6 Н2SO2Cl в 70% в.д. (серія II)
Таблиця 3. - Ефективні константи швидкості kaефф • 104 (с-1) і параметри активації ПС для гідролізу 5-[N(ХArSO2)-NMe]–2,4,6-Me3С6 Н2SO2Cl в 70% в.д. (серія III)
У всіх серіях швидкість реакції зростає при збільшенні температури і наростанні електроноакцепторних властивостей замісника Х, тобто процесу сприяє низька електронна щільність у сульфонильного центру. Заміщаючі групи Х розташовані достатньо далеко від атома сірки сульфогруппи, і їх електронні і стеричні властивості відбиваються лише в незначному ступені на швидкості процесу (табл. 1-3).
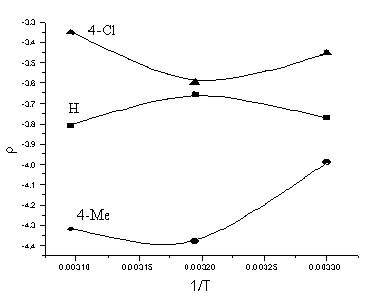
Зміна положення і кількості метильних груп Y в амідній частині субстрату викликає значні коливання його реакційності. Так, якщо при переході від Y=2,4-Me2 (серія I) до Y=2,6-Me2 (серия II) відношення kII/kI складає 1,1 ÷ 1,7, то для субстратів III значення kIII/kII досягає 2,7 ÷ 3,5. Селективність субстрату по заступниках Y характеризується дуже високими значеннями (табл. 4).
Таблиця 4. - Параметри коррелляціі по рівнянню Гаммета для 5-[N(ХArSO2)-NMe]–YArSO2Cl в 70% в.д. при варіюванні Y
З величини ρ <0 витікає, що реакція інгібіруеться акцепторними замісниками, і означає, що дія груп Y протилежно впливу заступників Х в аренсульфонильном фрагменті молекули. Компенсаційний ефект не досягається унаслідок віддаленості Х від реакційного центру. Накопичення метильних груп поблизу сульфонильної сірки, і пов'язане з цим прискорення реакції, що наголошувалося раніше [8,9] для аренсульфогалогенідів і пояснено формуванням «рихлого» перехідного стану (ПС) SN2 – типу.
Таблиця 5. – Теоретичне значення Тізо для серій I-III, отримане за методом Екснера [5] для гідролізу 5-[N(XArSO2)-NMe]-YArSO2Cl у 70% в.д.
Таким чином, при гідролізі сульфохлоридів анілідів сульфокіслот спостерігається досить рідкісне явище – ізокінетична температура знаходиться в реально досяжній області. Низьке значення Тізо указує на те, що ПС визначається в основному стеричними чинниками, а не електронною природою заступників X і Y. І отже, інтерпретація структурних ефектів як критерію механізму даного процесу повинна враховувати наявність ентропійного контролю в ході реакції.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ВИСНОВКИ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
1. Був проведений синтез ряду нових похідних сульфохлоридів анілідів сульфокислот. 2. Вперше досліджена кінетика нейтрального гідролізу ряду отриманих субстратів у водно-органічному розчиннику залежно від температури і структурних особливостей фрагментів молекули. 3. Показано, що відносно низька реакційність в умовах нейтрального гідролізу дає можливість використання сульфохлоридів анілідів сульфокіслот для знефенолювання стічних вод. 4. Підтверджений ефект прискорюючої дії орто-алкільних груп на процес нуклеофільного заміщення при атомі сульфонільної сірки. 5. Показано, що для інтерпретації впливу структурних ефектів субстрату на реакційну здатність доцільно проводити дослідження при декількох температурах з метою оцінки місцеположення робочої області щодо значення Тізо і, відповідно, однорідності експериментальних даних в реакційній серії. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ЛІТЕРАТУРА | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
1. Рублева Л.И., Попова Л.А. Фениларенсульфонаты - продукты химической очистки фенолсодержащих промстоков: реакционность и применение// Збірка доповідей II Міжнародної наукової конференції аспірантів та студентів "Охорона навколишнього середовища та раціональне використання природних ресурсів", том 1, Донецк: 2003 - С. 35-36. 2. Языков Н.А., Рублева Л.И., Левандовский В.Ю. Эффекты структуры субстрата при гидролизе сульфохлоридов анилидов сульфокислот – химических агентов дефеноляции в водноорганических средах // Збірка доповідей VI Міжнародної наукової конференції аспірантів та студентів "Охорона навколишнього середовища та раціональне використання природних ресурсів", том 1, Донецк: 2005 - С. 126-127. 3. Лейбович Р.Е. Технология коксохимического производства. М.: Металлургия, 1982. - 360с. 4. Языков Н.А., Рублева Л.И., Левандовский В.Ю. Установка промышленной очистки фенолсодержащих сточных вод// Збірка доповідей VII Міжнародної наукової конференції аспірантів та студентів "Охорона навколишнього середовища та раціональне використання природних ресурсів", том 1, Донецк: 2006 - С. 126-127. 5.Мысык Д.Д., Бурмистров С.И.// Журн. орган. химии. – 1967.-Т.3. – С.1667–1669. 6.Алексеев В. Н. Количественный анализ. – М.: Просвещение, 1974.- 505 с. 7. Мысык Д.Д., Рублева Л.И., Крутько И.Н., Левандовский В.Ю. Влияние структуры N-аренсульфонильного фрагмента на реакционность сульфохлоридов анилидов сульфокислот в условиях нейтрального гидролиза//Вопросы химии и химической технологии.-2004.- № 4.- С.39-42 8. Рублева Л.И., Максименко Н.Н. VII. Общая математическая модель каталитического сульфонилирования фенола// Журнал органической химии. – 2000. – т.36, вып.9.- С. 1338 – 1340. 9. Визгерт Р.В., Максименко Н.Н., Рублева Л.И. Особенности реакционной способности стерически затрудненных ароматических сульфохлоридов в реакциях нуклеофильного замещения// Укр. хим. журнал, 1993. – Т.59, №11.- С. 1219 – 1230. 10. Шмид Р., Сапунов В.Н. Неформальная кинетика. В поисках путей химических реакций. – М.: Мир, 1985. – 264 с. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Посилання на інтернет джерела | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
© ДонНТУ 2009 Язиков М.О. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||