СИНТЕЗ І РЕАКЦІЙНА ЗДАТНІСТЬ 3-(N-МЕТИЛ-N-АРЕНСУЛЬФОНІЛАМІНО) -4-МЕТОКСИБЕНЗЕНЕСУЛЬФОХЛОРИДІВ В РЕАКЦІЇ НЕЙТРАЛЬНОГО ГІДРОЛІЗУ
Донецький національний технічний університет
Вопросы химии и хим.технологии.-2008.- №6.- С 25. (0,5 у.п.л.)
| ДонНТУ |
|
Портал магистров ДонНТУ |
| Автобиография |
| Автореферат |
| Ссылки |
| Отчёт о поиске |
| Мои кактусы |
|
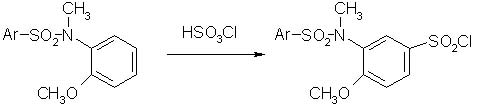
УДК 547.541.51:543.878:541.124-145:542.938 Досліджено процес гідролізу ряду 4-метоксипохідних N-аренсульфоніл-N-метиламінобензенсульфохлоридів в середовищі 70% (об’єм) водного діоксану і інтервалі температур 303-323 К. Показано наявність складного характеру впливу замісника Х в субстраті на швидкість реакції при вариюванні температури. Виявлено, що при интерпретації кінетичних закономірностей процесу треба спиратися на оцінку положення величини температури дослідів щодо ізокінетичної температури. Визначено σ-константи для 3-N-метил-N-аренсульфоніламідного замісника. Раніше [1,2] вивчено вплив структурних факторів в аренсульфоніламідному і бензенесульфохлоридному фрагментах молекули на нуклеофільне заміщення у атома сірки за типом SN2 на прикладі реакцій нейтрального гідролізу сульфохлоридів анілідів сульфокислот. Виявлено істотне прискорення реакції в присутності 2,6- и 2,4,6-метильних замісників в бензенсульфохлоридної частині. Викликає інтерес вплив на кінетичні закономірності процесу, що досліджується наявності метокси-угрупування в орто-положенні відносно N-метил-N-аренсульфоніламідного замісника. З метою дослідження впливу структури 3-(N-метил-N-аренсульфоніламіно)-4-метоксибензенесульфохлоридів (2) на їх реакційну здатність в реакції гідролізу, виконано синтез субстратів сульфохлоруванням 2-(N-метил-N-аренсульфоніламіно)-анізолів (1)
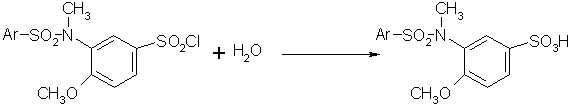
Сульфохлорування N-метил-N-аренсульфоніламіно-аренів може бути успішним, якщо в орто-положенні до аміно-угрупування знаходиться метил [3] . При його відсутності сполуки типу 1 розщеплюються під дією хлорсульфонової кислоти по зв’язку S-N. Встановлено, що стеричний орто-ефект метоксигрупи також перешкоджає розщепленню сполук 1 по зв’язку S-N та спрямовує сульфохлорування в пара-положення. Це свідчить про те, що ефект спряжіння метокси-групи більшою мірою сприяє напрямку заміщення, ніж такий же ефект N-метил-N-аренсульфоніламіноугруповання, який залежить від наявності та об’єму замісника в орто-положенні. Це узгоджується зі значенням σ-констант N-метил-N-аренсульфоніламіноугруповання, що знайдені з кінетичних вимірів (табл. 1). Гідроліз сполук 2 а-д досліджено в середовищі 70% (об’єм) водного діоксану та інтервалі температур 303-323 К.
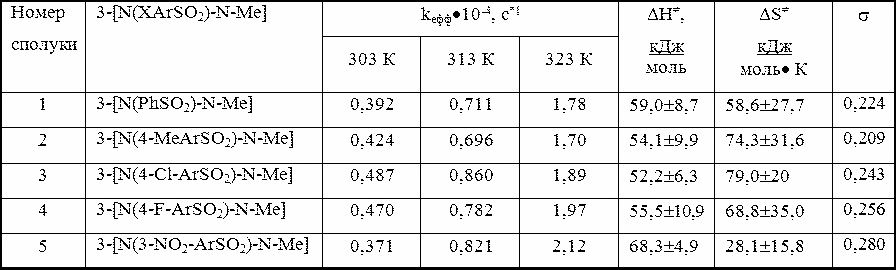
Вибір умов експерименту визначався можливістю проведення аналогії з процесами нуклеофільного заміщення за даними [4,5]. Ефективні константи швидкості і параметри активації перехідного стану (ПС) приведені в табл. 1. Таблиця 1 - Ефективні константи швидкості kaефф • 104 (с-1) і активаційні параметри ПС для гідролізу 3-[N(ХArSO2)-NMe]–4-CH3O-С6 Н3SO2Cl в 70% (об’єм) водному діоксані
Примітка. Похибка при вимірюванні kефф складає не більше 2%.
Реакційна здатність сполук 2 а-д підвищується з ростом температури.
Вплив характеру замісника Х в субстраті неоднозначний і не залежить від температури.
Так, для X=NO2 швидкість змінюється від найменшої в представленному ряді при 303К
до найвищої при 323К. Такими ж суперечливими кінетичними закономірностями характеризуються
і інші сполуки представленного набору. Наприклад, для 2 б,в маємо протилежні залежності –
зменьшення реакційності в даному ряді при збільшенні температури.
В цілому електронна природа замісника Х ,що
віддалений від центра нуклеофільної атаки - атома сірки сульфохлоридної групи,
істотно не впливає на реакційність субстрату , незначно змінює Δ H≠ , але відображається на
значеннях ентропійного фактору Δ S≠.
При порівнянні кінетичних даних 2 а-д(табл. 1)
з аналітичними для реакціі гідролізу 4 – метоксибензенсульфохлориду [5],
для якого kефф змінюється від 0,524 (303К) до 2,31 (323К) і параметри активаціі
ПС дорівнюють 57,7 кДж/моль і –136Дж/моль•К для Δ H≠ і Δ S≠ відповідно, бачимо незначні
відмінності у швидкості процесу, близькі значення ентальпіі активаціі, але досить велику
різницю в значннях ентропіі активаціі. Звертаючись до сполук
ряду N–аренсульфоніл-N-метіламіно–2,4–диметилбензенсульфохлоридів,
5–[N(XArSO2)-NMe]-2,4–Me2C6H2SO2Cl [1,2], наблюдаємо меньшу подібність кінетичних даних
і ще більшу відмінність величини ентропійного фактору, (Δ S = -(160 ÷ 140) Дж/моль•К ).
Таким чином 4- метоксильна група є основним структурним чинником, що впливає не тільки
на перебіг сульфохлорування, а і на швидкість процесу гідролізу. Приведені в табл. 1
дані для σ N – аренсульфонільного фрагменту молекули, що розраховані на основі даних [4]
для великого набору аренсульфохлоридів підтверджують це. Правомочність такого підходу з
дотриманням відповідних критеріїв єдинства механізму реакціі, в обох серіях показана в [1].
Крім того в якості допоміжного критерія єдності механизму гідролізу в наборі 2 а-д може бути
наявність залежності Δ S≠=ƒ(Δ H≠), яка виконується з великою точністю (k=0.999; s=0.0001).
тобто розбіжність і неоднозачність кінетичних даних в серіі метокси – похідних може бути
пов’язана з особливостями ПС SN2 типу , на що вказують значення параметрів Δ H≠ і Δ S≠ .
Взаємозв’зок структура – реакційність оцінювали за классичним рівнянням Гаммета:
lgk = lgk0 + ρ Σ σ
(1)
де ρ - коефіціент чутливості реакції до електронних ефектів замісників Х
в аренсульфаніламідній частині молекули.
Одержані значення наведені в таблиці 2. Там же показані аналогічні
параметри для гідролізу 5 – [N(XArSO2)- NMe]- 2,4 – Me2C6H2SO2Cl [2].
Таблиця 2 - Кореляційні параметри рівняння (1) для гідролізу сульфохлоридів амідів сульфокіслот
Примітка стаистичні параметри (1) :
для 2,4 диметил-похідних: S 0,023 ÷ 0,025; R 0,990;
для метокси-похідних при 323 К: S 0,0005 ÷ 0,025; R 0,9995;
для Т= 303 і 313 наведені оціночні величини, залежності за (1) не існує.
Зменьшення селективності субстратів 5 – [N(XArSO2)- NMe]- 2,4 – Me2C6H2SO2Cl
при зниженні температурисвідчить про наближення до ізокінетичної температури
(294К , що для цієї серіі підтвержено експерементольно [1].
Досить складний взаємозв’язок температура – реакційність для 2 а-д
відображається практичною відсутністю залежності в координатах рівняння (1)
для 303 і 313К. Але наведені дані (табл. 2) дозволяють зробити припущення про
незвично низьку чутливість до електронних ефектів Х, тобто маємо фактично відсутність
селективності субстрату до зміни температури. Про це ж свідчить теоретично розраховане за
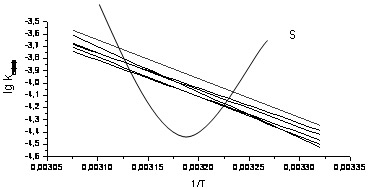
методом [6] значення ізокінетичної температури 314 К тобто кінетичні дослідження проводились
фактично в ізокінетичній області (рис. 1) незначно нижче (303К) і вищеТізо.
Цим пояснюється неоднозначність кінетичних даних і значення параметрів активації
Δ H≠ і ΔS≠. Серії реакцій, для яких Тізо знаходиться в інтервалі температур дослідів
дуже рідкі і тому є предметом особливого інтересу. Варіювання замісників у цьому випадку
мало змінює швидкість реакції, але істотно впливає на параметри активації, що маємо
експеріментально (табл. 1). Найбільш цікавий наслідок із співвідношення між ентальпійним
й ентропійним факторами – зміна послідовності реакційної здатності субстратів в серії
при проходженні Тізо (рисунок 3).
Для гідролізу 2 а-д при Т<Тізо реалізується ентальпійний контроль, при Т<Тізо –
ентропійний. Звісно, інтерпретація структурних особливостей ПС повинна бути різною
за температурами вище і нижче 314 К. За низьких температур (303 К) превалють електронні
взаємодії в ПС, за більш високих (323 К) – кінетичні закономірності визначаються більшою
мірою стеричними ефектами в перехідному стані (табл. 1).
Таким чином, для даної серії недостатньо використовувати інтерпретацію реакційної здатності в електронних термінах. Вочевидь, метокси-група в орто-положенні відносно 3-(N-метил-N-аренсульфаніламідного угрупування сприяє реалізації ПС з більшою кількістю ступенів свободи внаслідок змінення просторової конформації і зняття стеричного напруження, про що свідчить зростання ентропії перехідного стану (табл. 1).
Отже, реакційність системи в межах досліджуваного набору субстратів можна
пояснити двома різними факторами: меншою величиною ентальпії активації Δ H≠ (Т<Тізо )
та близькою до вихідного стану ентропією ПС (Т>Тізо ).
Наявність подібного ефекту спостерігалася нами раніше [7] для заміщення в просторово утруднених аренсульфохлоридах.
Експеріментальна частина
Загальна методика синтезу 3-(N-метил-N-аренсульфоніламіно)-4-метоксибензене-сульфохлоридів (2).
До 20 мл хлорсульфонової кислоти, охолодженої нижче 50С, додають 0,01
моль 2-(N-метил-N-аренсульфоніламіно)-анізолу (1). Витримують в холодильнику
при цій температурі протягом трьох діб. До розчину додають 20 мл дихлорметану і
виливають на 300 мл криги. Органічний шар відокремлюють, промивають двічі по 40 мл
води, сушать Na2SO4, фільтрують. Розчинник вилучають в вакуумі. Залишок розтирають з 5 –
10 мл 2-пропанолу. Вихід сульфохлоридів наведено в таблиці 2. Сполуки розчиняють в 10 дихлорметану.
Додають, уникаючи перемішування, 20 мл октану. Про повільному випаровуванні дихлоретану відбувається
кристалізація сульфохлоридів (табл. 3).
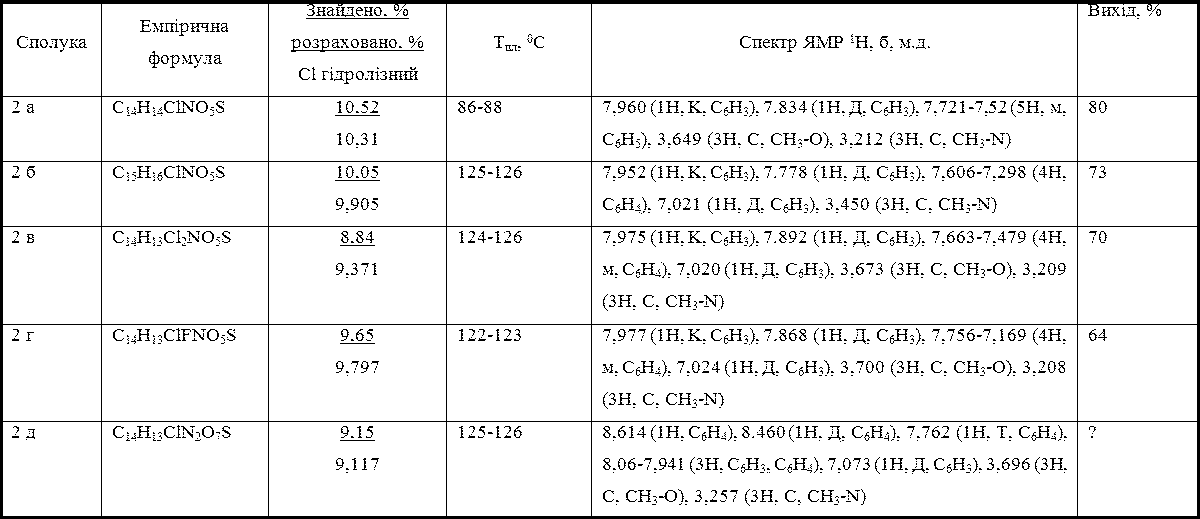
Таблиця 3 -Список отриманих 3-(N-метил-N-аренсульфоніламіно)-4-метоксибензене-сульфохлоридів
Спектри ЯМР сульфохлоридів 2 записані з розчинів в дейтерохлорофомі на приладі Varian VXR-300.
Досліждення швидкості реакцій гідролізу проводили в умовах псевдопершого порядку. Контроль швидкості здійснювали метожом отбору проб. Вміст продукта визначали кислотно-лужним титруванням.
Список літератури
1. Д. Д. Мысык, Л.И. Рублева, И. Н. Крутько, В.Ю.Левандовский. Влияние структуры
N-аренсульфонильного фрагмента на реакционность сульфохлоридов анилидов сульфо-кислот
в условиях нейтрального гидролиза// Вопросы химии и химической технологии.
— 2004. — № 4. — С.39-42
© ДонНТУ 2009 Языков Н.А.
|