ВЛИЯНИЕ ЭФФЕКТОВ СТРУКТУРЫ СУБСТРАТА В УСЛОВИЯХ НЕЙТРАЛЬНОГО ГИДРОЛИЗА СУЛЬФОХЛОРИДОВ АНИЛИДОВ СУЛЬФОКИСЛОТ С ЭКРАНИРОВАННЫМИ СУЛЬФАНИЛАМИДНЫМИ ЗАМЕСТИТЕЛЯМИ
Донецкий национальный технический университет
Mеждународная конференция молодых ученых «МОЛОДЕЖЬ В НАУКЕ – 2009»
| ДонНТУ |
|
Портал магистров ДонНТУ |
| Автобиография |
| Автореферат |
| Ссылки |
| Отчёт о поиске |
| Мои кактусы |
|
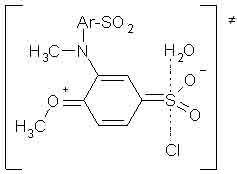
УДК 547.541.51:543. 878:541.124-145:542.938 Ранее [1] выявлены «положительные» отклонения в реакционности стерически затрудненных аренсульфохлоридов в условиях нуклеофильной атаки на атом сульфонильной серы. Показано, что наблюдаемое ускорение реакции сольволиза не связано с изменением механизма процесса [1-4] и регистрируется только при наличии метильных групп вблизи реакционного центра. Данный эффект необъясним с точки зрения электронных факторов. Природа проявления стерических факторов в этом случае неясна. С целью изучения влияния структурных эффектов в амидном и сульфохлоридном фрагментах молекулы исследовался нейтральный гидролиз сульфохлоридов анилидов сульфокислот с экранированными сульфониламидными заместителями. РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ Объекты исследования - соединения общей формулы: 5-[N-(XArSO2)-N-Me]-YArSO2Cl (серии I – III) и 3-[N-(XArSO2)-N-Me]-4-MeO-C6H3SO2Cl (серия IV), где X =4-Me, H, 4-Cl, 4-F, 3-NO2, 4-NO2; Y=2,4-Me2 (серия I), 2,6-Me2 (серия II), 2,4,6-Me3 (серия III). Среда: 70% (объем) водный диоксан (в.д.). Интервал температур 303-323К (табл. 1). Методы исследования: кислотно-основное титрование, элементный анализ, ПМР-спектроскопия. Во всех сериях наблюдается тенденция увеличения скорости реакции с возрастанием электроноакцепторного характера заместителя Х в субстрате. В пределах каждой серии влияние заместителя Х неоднозначно и зависит от температуры. В сериях I,III наблюдается тенденция сближе-ния значений констант скорости kэфф при снижении температуры для различных субстратов. В сериях II,IV (табл.1) – напротив, изменяется характер влияния Х на скорость процесса в исследуемом интервале температур. Так, для X=3-NO2 (серия IV) скорость изменяется от наименьшей в ряду при 303К к наивысшей при 323К (табл.1) Для X=4-Cl имеем противопо-ложные закономерности: уменьшение относительной реакционности при повышении температуры. Варьирование заместителя Х существенно не изменяет Δ H≠, в значительной степени сказывается на величине энтропийного фактора Δ S≠ переходного состояния (ПС) (табл.1). Абсолютное значение энтропии активации |Δ S≠| понижается при увеличении электроноакцепторного характера Х (табл.1). Изменение положения и количества метильных групп Y в аренсульфохлоридной части субстрата вызывает значительные колебания его реакционности (табл.1). Таблица 1 - Эффективные константы скорости kaэфф • 104 (с-1) и параметры активации ПС для гидролиза сульфохлоридов анилидов сульфокислот в 70% в.д.
Примечание. Погрешность в определении kэфф во всех сериях не превышает 3 % Попытка оценить взаимосвязь структура субстрата – реакционность по уравнению Гаммета: lgk = lgk0 + ρx Σ σ, (1) где ρx – коэффициент чувствительности реакции к электронным эффектам заместителей Х в аренсульфониламидном фрагменте молекулы, показала незначительную чувствительность реакции к электронным эффектам заместителей для серии I (табл. 2) и фактическое отсутствие зависимости для серий II и III с оценочным значением ρx=0,03 ÷ 0,07, что может говорить о нахождении исследуемого температурного интервала вблизи изопараметрической области. Для субстратов IV имеем аналогичную картину практического отсутствия селективности к Х в рабочем диапазоне температур. Таблица 2 - Корреляционные параметры уравнения (1) для гидролиза сульфохлоридов анилидов сульфокислот
Примечание. Cтатистические параметры (1): для 2,4-диметилппроизводных S 0,023 ÷ 0,025; R= 0,990; для метоксипроизводных при T=323 К; S=0,0005 ÷ 0,025; R=0,9995; для Т= 303 и 313 приведены оценочные величины, зависимости по (1) не существует. Расчет по уравнению (1) селективности субстрата по заместителям Y (серии I-III) дает очень высокие значения (табл. 3). Из величины ρY<0 следует, что реакция ингибируется акцепторными заместителями, и означает, что действие алкильных групп Y противоположно влиянию заместителей X в аренсульфониламидном фрагменте молекулы. Компенсационный эффект не достигается вследствие удаленности Х от реакционного центра. Накопление метильных групп вблизи сульфонильной серы, и связанное с этим ускорение реакции отмечалось ранее [1,5] для аренсульфогалогенидов модельного ряда и объяснено формированием «рыхлого» ПС SN2 типа. Таблица 3 - Параметры коррелляции по уравнению Гаммета для 5-[N(ХArSO2)-NMe]–YArSO2Cl в 70% в.д. при варьировании Y (серии I – IV)
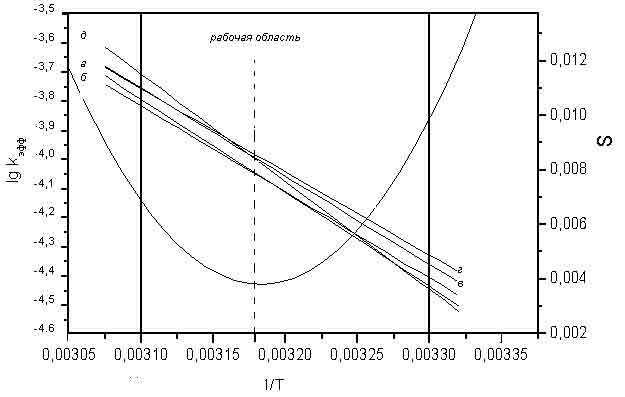
Примечание. n – количество экспериментальных точек Данные расчета изокинетической температуры Тизо для серий I – IV (табл. 4) по методу Экснера [6] показывают, что рабочая область температуры находится выше (I, III) или в изокинетической зоне (II, IV). Пример расчета Тизо для серии IV представлен на рис. 1. Значения Тизо для серий I и II проверены экспериментальным путем и практически совпадают с теоретически рассчитанными величинами.
Рисунок 1 - Пример расчета Тизо для серии IV Таким образом, при гидролизе сульфохлоридов анилидов сульфокислот наблюдается довольно редкое явление – изокинетическая температура находится в реально достижимой области. Этим объясняется неоднозначность кинетических данных и параметров активации ПС. Таблица 4 - Теоретическое значение Тизо для серий I-IV, полученное по методу Экснера [6] для гидролиза сульфохлоридов анилидов сульфокислот в 70% в.д.
Варьирование заместителей в этом случае мало изменяет скорость реакции, но существенно сказывается на значениях Δ H≠ и Δ S≠. Наиболее интересно следствие из соотношения между энтальпийным и энтропийным факторами – изменение последовательности реакционной способности субстратов при прохождении через Тизо (рис. 1). Конечно, объяснение структурных особенностей ПС должно быть разным при температурах выше и ниже Tизо. При более низких температурах превалируют электронные взаимодействия в ПС, при более высоких – кинетические закономерности определяются в большей степени стерическими эффектами в переходном состоянии. Возможно, накопление метильных групп в сульфохлоридной части молекулы способствует незначительному облегчению стерических взаимодействий при нуклеофильной атаке и менее плотной «упаковке» пере-ходного состояния, связанной с отклонением от тригонально-бипирамидальной структуры [8], что отражается на снижении величин свободной энергии активации Δ G≠ для соединений III (табл. 1). Для субстратов IV ограничение свободного вращения метокси-группы N-метил-N-аренсульфониламидным заместителем, возможно, способствует проявлению эффекта сквозного сопряжения с реакционным центром при ее размещении в плоскости бензольного кольца со значительно меньшим изменением количества степеней свободы при образовании ПС, что благоприятствует реакции.
Выводы 1) Для выявления влияния структурных эффектов субстрата на реакционность целесообразно проводить исследования при нескольких температурах с целью оценки местоположения рабочей области относительно Тизо и, соответственно, однородности экспериментальных данных в серии соединений. 2) Стерически затрудненные сульфонильные системы имеют реально достижимые низкие значения Тизо, и интерпретация структурных факторов заместителей как критерия механизма процесса должна учитывать наличие энтропийного контроля в ходе реакции. 3) Природу влияния заместителей в затрудненных системах нельзя объяснить электронными факторами, а следует рассматривать комплекс стерических взаимодействий в ПС. Литература
1. Визгерт Р.В., Максименко Н.Н., Рублева Л.И. // Укр. хим. журнал, 1993. т.59, №11 С. 1219 – 1230 © ДонНТУ 2009 Языков Н.А. |