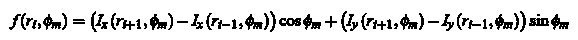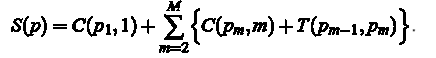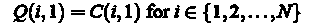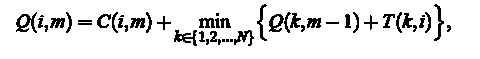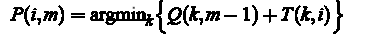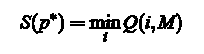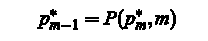РЕФЕРАТ
Введение
Цели и задачи
Объект и предмет исследования
Предполагаемая научная новизна
Обзор существующих систем
Методы исследования
Заключение
Источники
ХХI век принес неоспоримый прогресс во все сферы человеческой жизни, начиная созидательными космическими открытиями в поисках новых безопасных источников энергии и заканчивая новыми видами разрушительных неизученный заболеваний. Поэтому главной проблемой медиков является как можно более ранняя диагностика патологий с целью придания врачам времени для проведения исследований и правильного лечения. А наиболее ранняя диагностика – диагностика на низшем уровне организации, а именно на клеточном.
Но, как известно, самые важные задачи сложно выполнимы. Каждый день в мире появляются новые методики по обработке изображений гистологических срезов и изучению морфологических признаков разнообразных клеток, усовершенствуются микроскопы и программное обеспечение для работы с изображениями на персональных компьютерах. Работа ученых биохимиков также не заставляет себя долго ждать, и беспрерывно продолжается процесс усовершенствования иммуногистохимического анализа - метода выявления и точной локализации того или иного клеточного или тканевого компонента (антигена) in situ с помощью иммунологических и гистохимических реакций.
Основной проблемой при создании автоматизированной системы диагностики заболеваний человека на основе иммуногистохимического анализа является точность выявления клетки и определения ее параметров.
Поэтому разработка такой КС, которая сможет помогать врачам в постановке максимально точного диагноза, сокращая при этом затраты времени, является важной и актуальной задачей.
Целью данной работы является разработка автоматизированной подсистемы диагностирования различных заболеваний человека на изображениях гистологических срезов, полученных с помощью цифрового микроскопа и дальнейшего проведения иммуногистохимического окрашивания.
Для достижения поставленной цели необходимо решить следующие задачи:
Поиск и оценка точности существующих методов обработки изображений гистологических срезов;
Разработка алгоритма определения патологических признаков клеток на изображениях гистологических срезов;
Выбор наиболее подходящего метода для реализации поставленной задачи;
Реализация выбранных методов на ЭВМ.
Исследования направлены на обработку и распознавание объектов на изображении. Объектом исследования являются цветные изображения гистологических срезов, полученных при помощи цифрового микроскопа и проведения иммуногистохимического окрашивания. Предметом исследования являются алгоритмы сегментации, морфологических операций и выделения объектов на гистологических срезах.
Основным нововведением работы является использование различных алгоритмов и методов обработки изображений гистологических срезов для наиболее точного анализа, используются методы зарубежных ученых, ранее не применяемых в нашей стране. Сравнение полученных результатов позволит сделать вывод о состоянии исследуемого участка ткани и оценить точность и скорость каждого из подходов.
Разработанное ПО предполагается использовать в клинической лаборатории «Новая диагностика» при ИНВХ им.Гусака для диагностирования заболеваний человека, в основном новообразований различных органов.
ФемтоСкан Онлайн – пакет программного обеспечения для управления сканирующим зондовым микроскопом и обработки изображений зондовой микроскопии. Программа запускается под операционными системами семейства Windows. Для соединения с сервером используется протокол TCP/IP, что позволяет подключаться к серверу не только по локальной сети, но и через Интернет. Все параметры сканирования, заданные пользователем, передаются в сервер и далее – в микроскоп и другим пользователям, подключенным в режиме client. После запуска процесса сканирования открываются окна, в которых в реальном режиме времени показываются результаты – получаемые изображения, их размеры, режим сканирования, параметры обратной связи, текущее положение зонда, скорость сканирования. Одновременно пользователь может обрабатывать полученные данные, используя широкий набор различных функций, включенных в состав программы. Программа-клиент имеет множество различных функций, предназначенных для обработки и анализа изображений зондовой микроскопии: инверсия, фильтр Винера, транспонирование, анализ шероховатости, пороговая фильтрация, выделение зерен, выделение границ, морфологические фильтры и др.
Результат подсчета клеток показан на рис. 1.
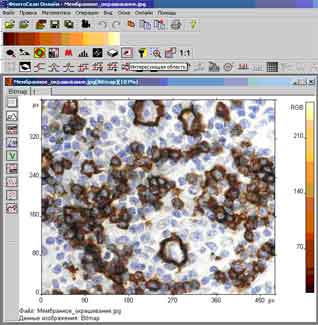 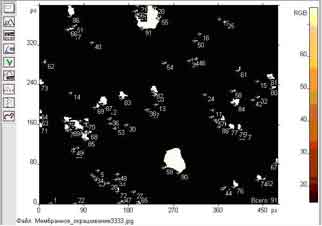
Рис.1. Оконтуривание и подсчет клеток на гистологическом срезе.
AnalySIS - программный продукт компании analySIS Five обеспечивает проведение анализа изображения. Интерфейс программы показан на рис.2.
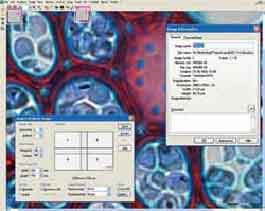 
Рис. 2. Вид окна программы AnalySIS
В программе analySIS Five реализована концепция Документа - единого файла (окна) в окне программы, который содержит начальные изображения, результаты анализа (таблица измерений, гистограммы).
Программа позволяет автоматизировать захват изображений, все установки камеры, сделанные пользователем при настройке, автоматически сохраняются и используются на следующих изображениях, которые снимаются. Реализована поддержка TWAIN совместных приборов введения. Программное обеспечение позволяет наносить графические элементы на изображения и проводить ручные измерения в режиме живого видео. Все возможности редактирования изображений (нанесение графики и текста, нанесения калибровочного маркера) и все стандартные функции преобразования изображений входят в программу. Производитель заявляет также о наличии в программе уникальных возможностей фильтрации, таких як, например, фильтр дифференциального усиления контраста (DCE - Differential Contrast Enhancement) для оптимизации контрастности изображения (полутонового или цветного). Еще одна из полезных возможностей программы: сшивания изображений, что позволяет, сняв смежные поля зрения на большом увеличении, объединить их в одно изображение. А также функция, позволяющая получать резкое изображение из серии полей зрения, снятых с разной глубиной фокуса (функция Extended Focal Imaging). Вся история обработки изображения сохраняется и может быть просмотрена.
1. Иммуногистохимические методики исследования. Бурное развитие иммунологии привело к разработке нового метода гистологического исследования – иммуногистохимического.
Иммуногистохимия – это метод выявления и точной локализации того или иного клеточного или тканевого компонента (антигена) in situ с помощью иммунологических и гистохимических реакций. Авторами этого метода по праву считается группа исследователей под руководством Альберта Кунса, которые впервые получили меченные флюоресцеином антитела и применила их в диагностических целях, также были разработаны методики прямой и непрямой иммунофлюоресценции. Однако метод не получил высокого распространения из-за большой сложности получения антител, сложности их визуализации и низкой воспроизводимости результатов. Последующие годы были отмечены не только совершенствованием самого метода, но и расширением сфер его применения. Были открыты авидин и биотин, образующие стойкий комплекс, разработаны методы конъюгации антител с биотином, авидина – с ферментами, новые методы получения очищенных антител. Все это привело к повсеместному внедрению данной методики сначала в исследовательских центрах, а затем и в практической медицине. Иммуногистохимические методики исследования на сегодняшний день являются обязательной частью любых исследований, т.к. только они обеспечивают специфическую визуализацию тех или иных веществ.
С помощью данной методики можно определять локализацию в тканях различных клеточных продуктов (гормонов, ферментов, иммуноглобулинов), компонентов клеток (рецепторов, сократительных и промежуточных филаментов) и даже отдельных генов.
Таблица 1. Системы визуализации антигенов наиболее известных фирм
| Метод | Фирма/система | Примечания |
| Первично-меченные антитела (ферментами или флюорохромами) |
Многие |
Количество таких антител велико. Используются редко в иммуногистохимии, но широко в проточной цитометрии. |
|
PAP- и APAAP-метод
|
DAKO PAP kit
DAKO APAAP kit
|
Метод основан на пероксидазно-антипероксидазном комплексе или фосфатазно-антифосфатазном комплексе.
|
|
ABC-метод
|
Novocastra Novostain Super ABC kit
VextorLab VectraStain ABC kit
|
Метод основан на комплексе авидин-биотин-фермент
|
|
SaBC-метод
|
DACO LSAB, LSAB+, LSAB2
Biogenex Super Sentitive Link-Label IHC
Detection Systems (Biotin Based)
Zymed Histostain-SAP Kit
Zymed Histostain-Plus Detection Kit
Chemicon IHC Select Detection Kits
|
Метод основан на комплексе стрептавидин-биотин-фермент
|
|
Полимерная технология с первичными антителами
|
DAKO EPOS
|
Метод основан на декстрановой молекуле, связывающей до 20 первичных антител и до 100 молекул фермента
|
|
Полимерная технология со вторичными антителами
|
DAKO EnVision, EnVision+
Biogenex Super Sensitive Polymer-HRP IHC
Non-Biotin Detection System
ImmunoVision PowerVision
Zymed SuperPicTure Polymer Detection Kit
|
Метод основан на декстрановой молекуле, связывающей до 20 первичных антител и до 100 молекул фермента
|
|
Метод амплификации с тирамид-биотином
|
DAKO CSA
ImmunoVision ImmunoMax
|
Метод основан на комплексе стрептавидин-биотин-фермент и усилении комплексом тирамид-биотин
|
|
Метод амплификации с тирамид-флюоресцином
|
DAKO CSA II
|
Метод основан на комплексе стрептавидин-биотин-фермент и усилении комплексом тирамид-флюоресцеин
|
Обработка изображений гистологических срезов используется для иммуногистохимического анализа, а именно определения тканевых компонентов с помощью неконтролируемой классификации и кластеризации. Используя пространственное распределение пикселей, связанных с позитивно и негативно заряженными клетками, определяются окрашенные модели. В то же время, анализируется и пространственное распределение ДНК-содержащих пикселей.

Рис.3. Этапы обработки изображений гистологических срезов (анимация объемом 143 КБ, состоящая из 105 кадров, цикл повторений бесконечный, реализована в ImageReady).
2. Методы обработки изображений.
2.1. Адаптивный метод установления порогов и сегментация.
Сегментированное изображение вычисляется через порог на градиентном изображении, который вычисляется из первоначального изображения.
Градиент изображения вычисляется с использованием метода Прюита.
Первоначальное изображение фильтруется с помощью двух масок, по одной на каждое направление, где каждая маска усиливает различия в соответствующем направлении.
Фильтр Прюита задается матрицей

Фильтры, приближающие оператор производной по y-координате
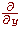 , получаются путем транспонирования матриц. , получаются путем транспонирования матриц.
Это приводит к двум новым изображениям, Iх и Iy, каждое из которых является границей пиксельных вариаций в X и Y направлениях, соответственно. После этого, мы положим, что
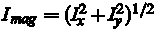
для расположения каждого пикселя. Пиксели с градиентом значения выше определенного порога 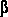 теперь будут помечены, как области переднего плана. теперь будут помечены, как области переднего плана.
Решающая роль в шаговой сегментации заключается в том, чтобы автоматически найти порог 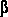 . .
Градиентные значения устанавливаются Релеевой функцией распределения,
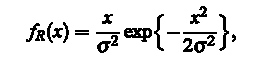
где  является параметром, который варьирует, пока наиболее подходящий не будет найден, а X - значение пикселя. Смысл этой процедуры заключается в том, что градиентные значения пикселей изображения будут распределены по закону Релея в соответствии с предположениями о том, что такие значения Iх и Iy являются идентичными, независимыми, и, как правило нормально (по закону Гаусса) распределены. Чтобы получить окончательные сегментированные изображения, мы применяем морфологические открытия и закрытия с круговой структурой элементов радиусом 4 пикселя. Результат проиллюстрирован на рис. 4. является параметром, который варьирует, пока наиболее подходящий не будет найден, а X - значение пикселя. Смысл этой процедуры заключается в том, что градиентные значения пикселей изображения будут распределены по закону Релея в соответствии с предположениями о том, что такие значения Iх и Iy являются идентичными, независимыми, и, как правило нормально (по закону Гаусса) распределены. Чтобы получить окончательные сегментированные изображения, мы применяем морфологические открытия и закрытия с круговой структурой элементов радиусом 4 пикселя. Результат проиллюстрирован на рис. 4.
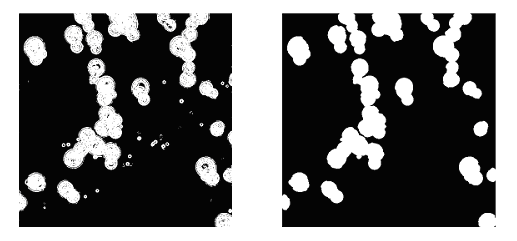
Рис.4. Результат сегментации изображения
2.2. Медианный фильтр
Медианный фильтр реализует нелинейную процедуру подавления аддитивного и импульсного шумов на изображении. Медианный фильтр представляет собой скользящее по полю изображения окно W, охватывающее нечетное число отсчетов. Центральный отсчет заменяется медианой всех элементов изображения, попавших в окно. Медианой дискретной последовательности x1 , x2 , ..., xL для нечетного L называют такой ее элемент, для которого существуют (L - 1)/2 элементов, меньших или равных ему по величине, и (L - 1)/2 элементов, больших или равных ему по величине. Другими словами, медианой является средний по порядку член ряда, получающегося при упорядочении исходной последовательности. Например, med(20, 10, 3, 7, 7) = 7. Двумерный медианный фильтр с окном W определим следующим образом:
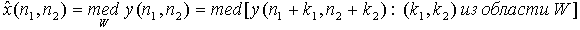
Среди медианных фильтров размерностью 3х3 наиболее распространены следующие:
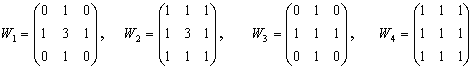
2.3. Поиск предполагаемого центра клетки
Поскольку каждая связная компонента в сегментированном изображении представляет собой предполагаемую совокупность клеток, эти совокупности должны быть разъединены на отдельные клетки. Это достигается с помощью функции поиска по сегменту окружности вдоль внешних контуров объектов в сегментированном изображении, используя вариации кругового преобразования Хоу. Этот принцип показан на рис.5.
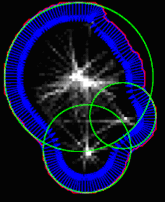
Рис.5. Результат применения преобразования Хоу.
При обходе внешней границы связных областей в сегментированном изображении аппроксимирующая нормаль к границе вычисляется в каждой точке. Вдоль каждой нормали, мы поэтапно идем внутрь и регистрируем расстояния до точки соответствующей границы. Таким образом, накопленная матрица сформирована так, где каждый элемент включает число "попаданий" на нормаль к границе и отслеживает соответствующие расстояния. Когда каждая точка вдоль границы совокупности клеток была пройдена, мы ищем расположение максимума в этой накопленной матрице. Результирующие окружности на рис. 5 отображаются зеленым цветом. Центры кругов будут выступать в качестве кандидата на центры клеток для получения окончательного контура.
2.3.1. Круговые преобразования Хоу.
Клетки имеют округлую форму. Круг может быть представлен как
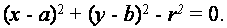
Эта модель состоит из трех параметров: двух параметров в центре круга, а один параметр для радиуса окружности. Если есть угол уклона по краям, то это служит сдерживающим фактором, что снижает количество степеней свободы и, следовательно, требуется размер пространства параметров. Направление вектора от центра окружности к краю каждой точки определяет угол уклона, в результате чего получаем значения радиуса, как только неизвестного параметра.
Таким образом, параметрические уравнения окружности в полярных координатах:
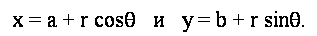
Решая для параметров окружности, мы получаем уравнения:
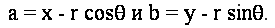
Теперь, учитывая угол уклона 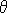 на краю точки (X, Y), мы можем вычислить cos на краю точки (X, Y), мы можем вычислить cos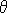 и sin и sin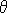 . Но эти значения могут быть распространены в качестве побочного продукта края обнаружения. Мы можем устранить вылет из пары уравнений следующим образом: . Но эти значения могут быть распространены в качестве побочного продукта края обнаружения. Мы можем устранить вылет из пары уравнений следующим образом:
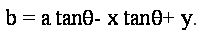
2.4. Получение контура клетки с использованием динамического программирования
Каждая замкнутая последовательность связных пикселей вокруг предполагаемого центра клетки и, следовательно, пространство возможных
контуров огромно. Для того, чтобы урегулировать эту проблему, в данном методе представлена система отсчета в виде полярных участков
по отношению к каждому кандидату на центр клетки. На рисунке 6 показаны производные по направлению Iх и Iy в виде М = 32 лучей,
выходящих из предполагаемого центра клетки, где каждый луч отобран на N = 30 равномерно распределенных радиальных точках. Истинная
граница клеток гранично прилегает к темной «бахроме» вокруг клетки. Формально F(R, 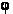 ) обозначает точку контура критерия функции,
т.е. на расстоянии R и под углом ) обозначает точку контура критерия функции,
т.е. на расстоянии R и под углом 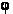 будет точка контура. Угол будет точка контура. Угол 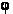 откладывается против часовой стрелки. откладывается против часовой стрелки.
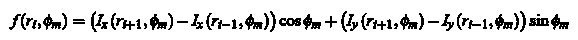
Косинус и синус операции соответствуют проекции вдоль данных лучей.
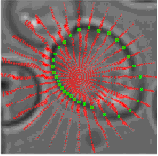
Рис.6. Контур клетки, полученный с помощью динамического программирования.
Стоимость S (P) для контура или путь P = (P1, P2,...,), найденный слева направо, равен:
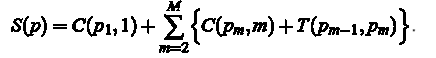
Оптимальный путь P*, это путь, который минимизирует сумму S(P). В ходе алгоритма необходимо провести следующие вычисления:
Инициализация (M = 1): 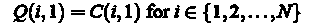 рекурсии (М = 2, M): Для каждого i = 1,. . . , N рассчитать оптимальную кумулятивную стоимость
рекурсии (М = 2, M): Для каждого i = 1,. . . , N рассчитать оптимальную кумулятивную стоимость 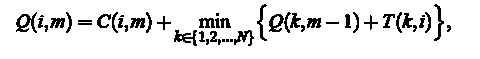
и сохранить указатель к соответствующей переменной минимизации:
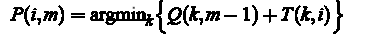 Прекращение: Минимальная стоимость
Прекращение: Минимальная стоимость
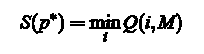
и последнее состояние соответствующего пути
 отслеживание: Полный оптимальный путь найти на заднем фоне с помощью указателя матрицы P: Для M = M,. . . , 2
отслеживание: Полный оптимальный путь найти на заднем фоне с помощью указателя матрицы P: Для M = M,. . . , 2
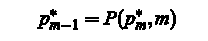
Из вышеописанного материала можно сделать заключение о перспективности использования современных КС в области медицины. Разработка и применение в диагностических системах новых алгоритмов работы позволит повысить скорость и точность обработки информации в таких системах на несколько порядков.
1. Основы иммуногистохимии
http://www.newdiagnostics.dn.ua/index.php?option=com_content&task=view&id=18&Itemid=17&&lang=ru
2. Automated recognition of cell phenotypes in histology images based on membrane- and nuclei- targeting biomarkers
http://www.biomedcentral.com/1471-2342/7/7
3. Image analysis algorithms for cell contour recognition in budding yeast
http://www.opticsinfobase.org/DirectPDFAccess/351802CD-BDB9-137E-C9C3F4794EF34E6D_170494.pdf?da=1&id=170494&seq=0&CFID=37376861&CFTOKEN=71773669
| |







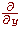 , получаются путем транспонирования матриц.
, получаются путем транспонирования матриц.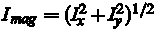
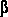 теперь будут помечены, как области переднего плана.
теперь будут помечены, как области переднего плана. 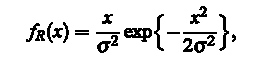
 является параметром, который варьирует, пока наиболее подходящий не будет найден, а X - значение пикселя. Смысл этой процедуры заключается в том, что градиентные значения пикселей изображения будут распределены по закону Релея в соответствии с предположениями о том, что такие значения Iх и Iy являются идентичными, независимыми, и, как правило нормально (по закону Гаусса) распределены. Чтобы получить окончательные сегментированные изображения, мы применяем морфологические открытия и закрытия с круговой структурой элементов радиусом 4 пикселя. Результат проиллюстрирован на рис. 4.
является параметром, который варьирует, пока наиболее подходящий не будет найден, а X - значение пикселя. Смысл этой процедуры заключается в том, что градиентные значения пикселей изображения будут распределены по закону Релея в соответствии с предположениями о том, что такие значения Iх и Iy являются идентичными, независимыми, и, как правило нормально (по закону Гаусса) распределены. Чтобы получить окончательные сегментированные изображения, мы применяем морфологические открытия и закрытия с круговой структурой элементов радиусом 4 пикселя. Результат проиллюстрирован на рис. 4.

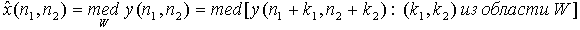
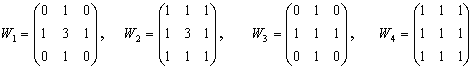

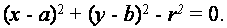
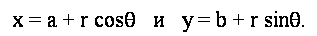
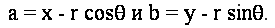
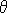 на краю точки (X, Y), мы можем вычислить cos
на краю точки (X, Y), мы можем вычислить cos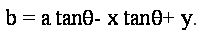
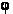 ) обозначает точку контура критерия функции,
т.е. на расстоянии R и под углом
) обозначает точку контура критерия функции,
т.е. на расстоянии R и под углом