Реферат за темою випускної роботи
Зміст
- Вступ
- 1. Актуальність, мета та задачі дослідження та заплановані результати
- 2. Загальні характеристики глауконіту
- 3. Фізико-хімічні основи процесу адсорбції
- 4. Методика експерименту
- Висновки
- Перелік посилань
Вступ
Забруднення природних водойм в результаті господарської діяльності людини на сьогодні є однією з найбільш актуальних проблем, вирішення якої вимагає згуртованих зусиль світової наукової спільноти. Сучасні темпи зростання народонаселення в світі неодмінно спричинять подальше нарощування обсягів промислового виробництва, енергетичної галузі, збільшення площ, зайнятих у землеробстві, розбудову міських інфраструктур. Розвиток всіх цих галузей потребує інтенсивної експлуатації водних ресурсів що невідворотно пов’язано зі збільшенням навантаження на водні об’єкти через скидання стоків. Недбале відношення до цієї проблеми провокує катастрофічні наслідки, які набувають планетарного масштабу [1].
Водні ресурси Донецького регіону формуються за рахунок транзитного притоку поверхневих вод, в основному по річці Сіверський Донець за рахунок Харківської області, місцевого річкового стоку, стічних, шахтних і кар'єрних вод, а також експлуатаційних запасів підземних вод (1067 тис. куб. м на добу). Свіжу воду використовують підприємства металургійної, вугільної промисловості, енергетики, комунального та сільського господарства. Основними забруднювачами водних об'єктів є підприємства гірничої та металургійної промисловості. Щорічно вони скидають близько 500 млн. куб. м шахтних вод, забруднених мінеральними солями, завислими речовинами і бактеріальними домішками. У малі річки Донецькій області щорічно надходить близько 1,5 млн. тонн солей, що призвело до обміління річок за останні роки на один метр [2].
До категорії основних підприємств – забруднювачів металургійної промисловості слід віднести наступні: металургійний комбінат ім. Ілліча і Азовсталь
у Маріуполі, металургійний і коксохімічний заводи в Єнакієвому, Алчевський металургійний комбінат, Алчевський і Стахановський коксохімічні заводи. Необхідно також відзначити, що з-за частих аварійних ситуацій на об'єктах каналізаційного господарства, їх санітарно–епідеміологічний стан залишається незадовільним [3].
Таким чином, використання протягом значного періоду часу класичних технологій водоочищення, призвели до зростання обсягів забруднень гідросфери, що вимагає нових стратегій та технологій очистки стічних вод [4].
1.Актуальність, мета та задачі дослідження та заплановані результати
При очищенні стоків сорбційними методами як адсорбент використовують активоване вугілля. Доцільно та раціонально замінити його на природні сорбенти, які з одного боку є недорогими і доступними матеріалами, а з іншого – дозволяють досягнути високого ступеня очищення. Актуальним є використання природного сорбенту – глауконіту[4].
Метою роботи є експериментальне вивчення сорбційних властивостей, якісних і кількісних характеристик природного мінералу – глауконіту Амвросіївського родовища.
Для досягнення мети поставлені наступні задачі:
1 – провести технічний аналізу глауконіту;
2 – дослідити експериментально сорбційну активність глауконіту за стандартними методиками по відношенню до метилового оранжевого, метилового червоного та метиленового блакитного;
3 – визначити сорбційні властивості глауконіту відносно важких металів та неорганічних іонів;
4 – дослідити сорбційні властивості глауконіту відносно органічних речовин.
2.Загальні характеристики глауконіту
Глауконіт відноситься до групи алюмосилікатів. Алюмосилікати – група природних і синтетичних силікатів, комплексні аніони яких містять кремній і алюміній. Як катіони виступають Na+, K+, Mg2+, Ca2+, а іноді Ba2+ і Li+. Природні алюмосилікати є найбільш поширеними мінералами, на їх частку припадає до 50 % маси земної кори. До них відносяться польові шпати (альбіт, ортоклаз, анортит), глинисті мінерали та слюди. Алюмосилікати не розчиняються у воді. Природні алюмосилікати не містять гідроксильної групи і кристалічної води, є тугоплавкими, термічно стійкими сполуками. Глауконіт є натуральний природний мінерал, що міститься в осадових породах. Сучасна екотехнологія виявила, що глауконіт має низку універсальних корисних властивостей, які можна використовувати в різних сферах життя.
Унікальність цього мінералу полягає в його високих іонообмінних, буферних та сорбційних властивостях.
Глауконіт (від греч. Glaukos – світло–зелений
) – мінерал, водний алюмосилікат заліза, кремнезему і oксідa калію непостійного складу. Хімічна формула (K, H2O) · (Fe3+, Al, Fe2+, Mg) ·2 [Si2AlO10](OH)2 · nH2O. Елементи, які знаходяться у складі мінералу легко замінюються у формі змінних катіонів. Цією властивістю, а також шаруватою структурою, пояснюються високі сорбційні властивості по відношенню до нафтопродуктів, важких металів, радіонуклідів. У той же час для глауконіту характерний низький відсоток десорбції (видалення з рідин або твердих тіл речовин, поглинених при адсорбції або абсорбції), висока теплоємність, пластичність.
Хімічний склад дуже мінливий:
оксид калію (К2О) 4,4 – 9,4 %,
оксид натрію (Na2O) 0 – 3,5 %,
оксид алюмінію (Al2O3) 5,5 – 22,6 %,
оксид заліза (Fe2O3) 6,1 – 27,9 %,
діоксид заліза (FeO) 0,8 – 8,6 %,
оксид магнію (MgO) 2,4 – 4,5 %,
діоксид кремнію (SiO2) 47,6 – 52,9 %,
вода (H2O) 4,9 – 13,5 %.
Глауконіт існує у вигляді маленьких, округлених зеленуватих зерен. Поширений у всіх геологічних системах – в пісках, пісковиках, глинах, мергелях і вапняках, надає забарвлення у зеленуваті кольори. Утворення глауконіту відбувається і в даний час на дні морів за участю дрібних організмів. Твердість за мінералогічною шкалою 2–3, щільність 2,2 –2,8 г/см3.
Глауконіт є перспективною корисною копалиною багатопрофільного застосування. Виявлено чотири форми знаходження його в палеогенових відкладах, п'ять типоморфних і три генетичні різновиди (аллотігенний дальнепріносной, аллотігенний реліктовий і аутігенний). В аутігеному глауконіту визначено понад 50 хімічних елементів, співвідношення яких відображають палеогеографічні умови глауконітізаціі.
Встановлено, що при фільтрації через нього забруднених вод практично повністю видаляються сполуки заліза та аміаку, на порядок знижується вміст у воді нафтопродуктів, в 25–50 разів знижується вміст радіоактивних ізотопів цезію–137 та стронцію –90. Глауконіт негорючий, нетоксичний, нелеткий, не розчиняється у воді, кислотах і розведених лугах. Область хімічної стійкості рН = 1–10. Термін придатності природного сорбенту глауконіту не обмежений. Глауконіт має високі адсорбційні та іонообміні властивості. Мінерал має властивість виборчого поглинання катіонів і довгоживучих радіоізотопів [5].
Здатність глауконіту сорбувати важкі метали з розчинів складає (у % від вихідного вмісту) Pb–99, Hg–64, Co–97, Cu–96, Cd–96, Mn–95, Cr–92, Ni–90 Zn–90, Fe–99. Сорбент має добрі експлуатаційні показниками і, як наслідок, не вимагає додаткових заходів по промивці колонки і її перевантаження.
Оскільки глауконіт має велику активну поверхню, він виражено і селективно сорбує аміак, сірководень, метан, вуглекислий газ, вуглеводні, феноли, екзо– і ендотоксини, важкі метали, радіонукліди, деякі мікроорганізми. Глауконіт здатний сорбувати і виводити з організму деякі катіони, будучи при цьому додатковим джерелом мінеральних елементів. Метали, що мають велику атомну масу, десорбуються значно гірше, ніж легкі. Отже, глауконіт може виводити з організму солі важких металів [6].
Переваги його, як сорбенту:
- широкий спектр сорбуємих речовин (нафтопродукти, важкі метали, пестіциди, радіонукліди);
- вартість набагато нижче аналогів;
- можливість використання в будь–який час року;
- на відміну від синтетичних, поролонових, нетканих сорбентів, вугільних глауконіт не горить;
- не руйнується структура сорбенту (в порівнянні з полімерними, синтетичними, поролоновими сорбентами) при взаємодії з нафтопродуктами;
- працездатний в широкому інтервалі температур від – 20 до + 100 0С.
Одним із напрямків використання глауконіту є застосування його на твердих поверхнях і ґрунтах, які зазнали тривалого забруднення нафтопродуктами, важкими металами. Перевага глауконіту в тому, що після очищення забруднених об'єктів, певною кількістю сорбенту, шкідливі речовини по концентрації досягають рівня ГДК, тобто клас небезпеки відходів знижуються до безпечного. Оброблені таким чином площі, не треба санувати. При цьому очищений сорбентом грунт залишається на місці, а не переміщується на полігон небезпечних відходів, що виключає додаткові витрати на її утилізацію. Таким чином, глауконіт доцільно використовувати, як адсорбент для вилучення із природних і стічних вод різних забруднювачів [7].
3. Фізико–хімічні основи процесу адсорбції
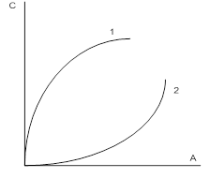
Сорбційні методи дуже ефективні для вилучення зі стічних вод цінних розчинених речовин з їх подальшою утилізацією та використання очищених стічних вод в системах зворотного водопостачання промислових підприємств. Основні відомості про сорбційних властивостях матеріалу і характер адсорбції на ньому певних речовин можуть бути отримані з ізотерм адсорбції, що характеризують залежність сорбційної здатності від концентрації (або тиску) компонента, який сорбується, при постійній температурі. Брунауер, Еммет і Теллер [8] виділили п'ять основних типів ізотерм сорбції, так званих ізотерм по БЕТ (рисунок 3.1). Опуклі ділянки ізотерм І, II і IV типів вказують на наявність в сорбентах мікропор, але, крім того, сорбенти II і IV мають ще й макропори. Ізотерми III і V типів зустрічаються рідше і описують сильну міжмолекулярну взаємодію в речовині сорбата. Крутизна ізотерми I типу характеризує розмір мікропор сорбентів: а – ультрамікропористих, б – мікропористих.
І – наявність в сорбентах мікропор, II і IV мають мікропори ще й макропори, III і V – описують сильну міжмолекулярну взаємодію в речовині сорбата
Рисунок 3.1 – Типи ізотерм сорбції по БЕТ
Чим крутіше ізотерма, тим дрібніше мікропори. Граничне значення такої адсорбції відповідає покриттю поверхні мономолекулярним шаром. Увігнуті ділянки вказують на наявність макропор. Ізотерма мономолекулярної адсорбції на мікропористих сорбентах зазвичай має вигляд, показаний на рисунку 3.2. Ця крива має дві прямолінійні ділянки – при малих і великих значеннях рівноважної концентрації адсорбату. Як адсорбція парів, так і адсорбція з розчинів здійснюється в області пор з радіусом 0,5 – 1,6 нм.
Для аналітичного опису ізотерми мономолекулярної адсорбції найчастіше використовують рівняння Ленгмюра:
А = Агран · С / (1 + кС),
де А – питома адсорбція, ммоль/г;
Агран – гранична адсорбція, ммоль/г;
С – рівноважна концентрація адсорбату, ммоль/дм3;
к – адсорбційна константа.
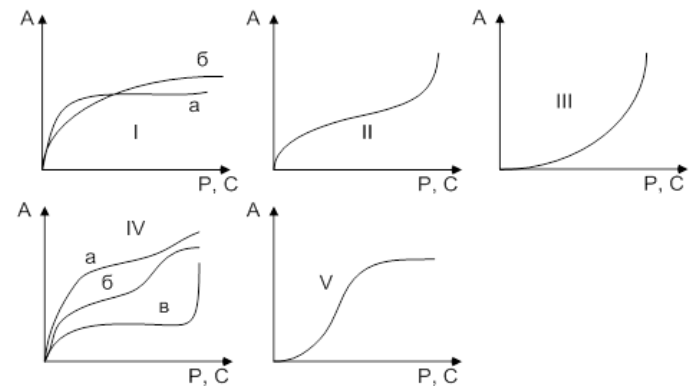
Графічне вираження цього рівняння наведено на рисунку 3.3. На ізотермі можна виділити три характерних ділянки. Початкова лінія має прямолінійну ділянку, яка вказує на те, що при малих концентраціях величина питомої адсорбційної здатності прямо пропорційна цим концентраціям. Це, в значній мірі, відповідає ще вільної поверхні адсорбенту.
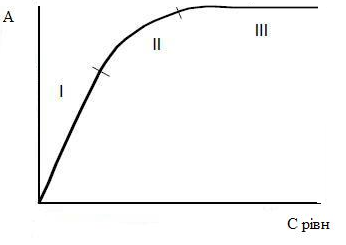
Рисунок 3.3 – Ізотерма адсорбції Ленгмюра
Майже горизонтальна ділянка, яка відповідає великим концентраціям, відповідає поверхні адсорбенту, повністю насиченим адсорбтивом. Величина питомої адсорбційної здатності в цьому випадку не залежить від рівноважної концентрації адсорбтива в розчині, що свідчить про утворення на поверхні мономолекулярного шару. Середня ділянка ізотерми відповідає проміжним ступеням заповнення поверхні. Рівняння Ленгмюра описує ізотерму адсорбції у всіх областях рівноважних концентрацій. При малих концентраціях формула спрощується набуває вигляду:
А = А гран · кС
Межа адсорбції відповідає кількості адсорбтіва, що припадає на одиницю поверхні при граничній упаковці її молекул в мономолекулярному шарі. Як було зазначено раніше, між концентрацією адсорбтіва в розчині і на поверхні адсорбенту існує рівновага, тобто коли число адсорбованих молекул в одиницю часу дорівнює кількості десорбуємих. Цілком очевидно, що співвідношення між величинами питомої адсорбційної здатності і рівноважної концентрації для одного і того ж виду адсорбтива і адсорбенту буде визначатися температурою.
Так, величина А зі збільшенням температури буде зменшуватися, оскільки при цьому збільшується десорбція молекул з поверхні адсорбенту за рахунок збільшення швидкості теплового руху. Тому ізотерма адсорбції для більш високих температур буде лежати нижче, ніж для низьких (рисунок 3.4). Однак, при підвищенні температури межа адсорбції не повинен змінюватися, так як кількість активних центрів на адсорбенті не змінюється, як не змінюються розміри молекул. Отже, ізотерми, що відповідають різним температурам при досягненні певних рівноважних концентрацій повинні зливатися в одну.
1 – ізотерма адсорбції, що відповідає більш низькій температурі; 2 – ізотерма адсорбції, що відповідає більш високій температурі
Рисунок 3.4 – Вид ізотерм при різних температурах [9].
В області проміжних рівноважних концентрацій (на невеликих ділянках зміни концентрації адсорбату) залежність адсорбції від концентрації часто може бути описана рівнянням Фрейндліха, в основі якого лежить припущення, що ізотерма адсорбції є параболою:
А = к · С1/n ,
де к і 1/n – константи.
У логарифмованному вигляді рівняння Фрейндліха представляється прямою (рисунок 3.4). Має вигляд:
lg A = lg к + 1/n lg C
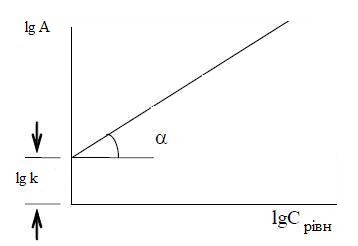
Рисунок 3.4 – Схема визначення констант в рівнянні Фрейндліха
Відрізок, що відсікається на осі ординат, дорівнює lg К, tg = 1/n. У практиці зустрічаються й інші, більш складні види ізотерм, що відповідають індивідуальним властивостям адсорбенту і адсорбтива [5]. Таким чином, адсорбція є складним гетерогенним процесом, ефективність якого залежить від багатьох чинників.
4. Методика експерименту
Для визначення сорбційної активності глауконіту було проведено ряд експериментів за стандартною методикою [10]. Згідно [10] визначали сорбційну активність глауконіту фракції (1 – 3)мм по відношенню до метилового червоного, метилового оранжевого та метиленового синього.Зразок глауконіту масою 0,1 г поміщали до колби 100 мл та додавали 25 мл розчину барвника концентрацією 1500 мг/дм3. Потім відокремлювали глауконіт від розчину і знаходили оптичну густину для метилового оранжевого 400 нм та червоного при довжині хвині 490 нм, для метиленового синього 590 нм. Залишкову концентрацію барвника визначали колориметричним методом за допомогою калібрувального графіка. Адсорбційну активність за барвником (Х) в міліграмах на 1 грам продукту розрахували за формулою:
Х = (С1 – С2 · К) · 0,025 / m
де С1 – масова концентрація вихідного розчину індикатора, мг/дм3;
С2 – масова концентрація розчину після взаємодії с глауконітом, мг/дм3;
К – коефіцієнт розбавлення розчину, взятого для аналізу, після взаємодії з глауконітом;
m – маса наважки, г;
0,025 – об’єм розчину індикатора, що використаний для освітлення, дм3.
Дослідження проводилися в статистичних умовах, результати наведені в таблиці 1.1
Таблиця 1.1 – Експериментальні дані сорбційної активності глауконіту
| Барвник | Маса глауконіту, г | Вихідна концентрація, мг/дм3 | Залишкова концентрація, мг/дм3 | Адсорбційна ємність, мг/г |
| Метиленовий блакитний | 0,1 | 1500 | 990 | 127,5 |
| Метиловий оранжевий | 0,1 | 1500 | 780 | 181,5 |
| Метиловий червоний | 0,1 | 1500 | 840 | 164,5 |
Для одержання ізотерм адсорбції та знаходження констант в рівнянні Фрейндліха було проведено ряд досліджень. Отримані дані наведені в таблицях 1.2 – 1.4. Адсорбційну активність розраховували за формулою наведеною вище. При К = 1 та V = 25 мл.
Таблиця 1.2 – Експериментальні дані визначення концентрації метилового оранжевого у розчині
| Вихідна концентрація, мг/дм3 | Маса глауконіту, г | Залишкова концентрація, мг/дм3 | Адсорбційна ємність, мг/г | lg Г | lg Cзал |
| 30 | 0,1 | 0,01 | 4,99 | 0,69 | -2 |
| 60 | 0,1 | 8 | 26 | 1,41 | 0,90 |
| 120 | 0,1 | 19,0 | 50,5 | 1,70 | 1,27 |
| 180 | 0,1 | 21,5 | 79,25 | 1,89 | 1,33 |
| 210 | 0,1 | 24,7 | 92,65 | 1,96 | 1,39 |
Таблиця 1.3 – Експериментальні дані визначення концентрації метиленового блакитного у розчині
| Вихідна концентрація, мг/дм3 | Маса глауконіту, г | Залишкова концентрація, мг/дм3 | Адсорбційна ємність, мг/г | lg Г | lg Cзал |
| 30 | 0,1 | 12 | 7,47 | 0,87 | 1,07 |
| 60 | 0,1 | 17,6 | 14,96 | 1,17 | 1,24 |
| 120 | 0,1 | 38 | 20,5 | 1,31 | 1,57 |
| 150 | 0,1 | 59 | 22,75 | 1,35 | 1,77 |
| 210 | 0,1 | 122 | 23,45 | 1,37 | 2,08 |
| 240 | 0,1 | 137 | 25,75 | 1,41 | 2,13 |
Таблиця 1.4 – Експериментальні дані визначення концентрації метилового червоного у розчині
| Вихідна концентрація, мг/дм3 | Маса глауконіту, г | Залишкова концентрація, мг/дм3 | Адсорбційна ємність, мг/г | lg Г | lg Cзал |
| 5 | 0,1 | 1 | 1 | 0 | 0 |
| 10 | 0,1 | 5 | 1,25 | 0,096 | 0,69 |
| 25 | 0,1 | 7 | 1,75 | 0,24 | 1,25 |
| 50 | 0,1 | 35 | 3,75 | 0,57 | 1,54 |
| 100 | 0,1 | 60 | 10 | 1,0 | 1,77 |
За отриманими даними побудували ізотерми адсорбції в логарифмічних та натуральних координатах, представлені на рисунках 4.1 – 4.3
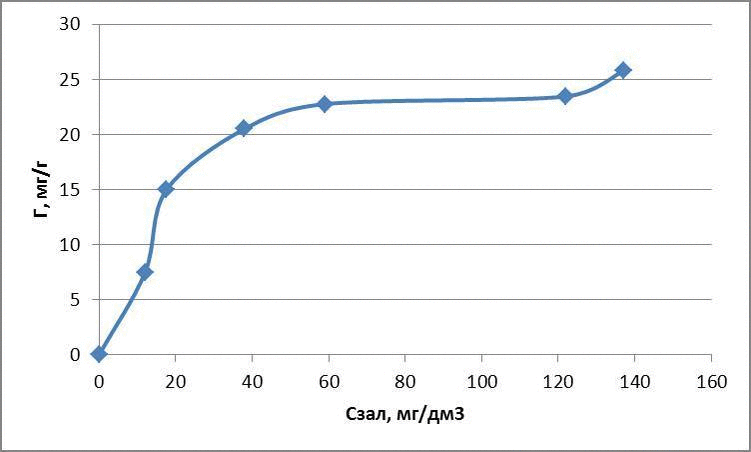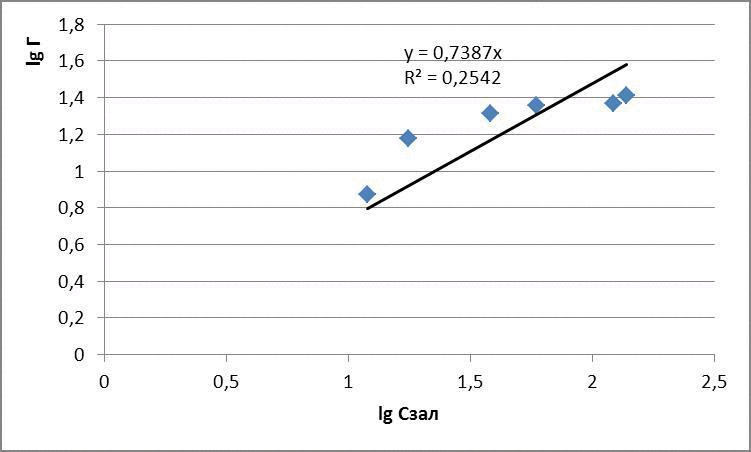
Рисунок 4.1 – Ізотерми адсорбції метиленового блакитного
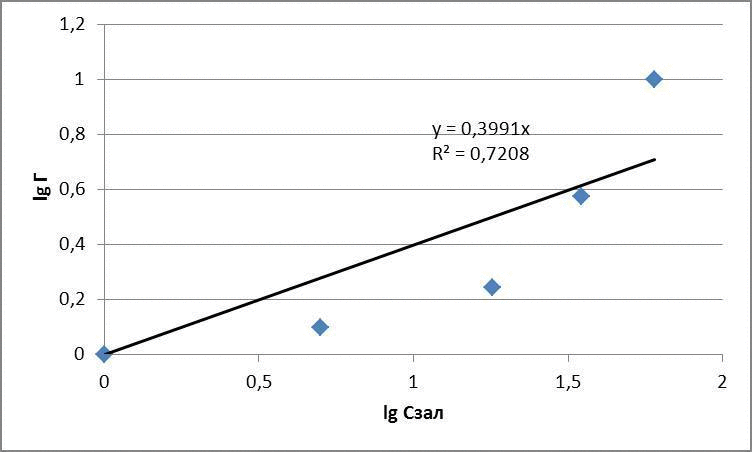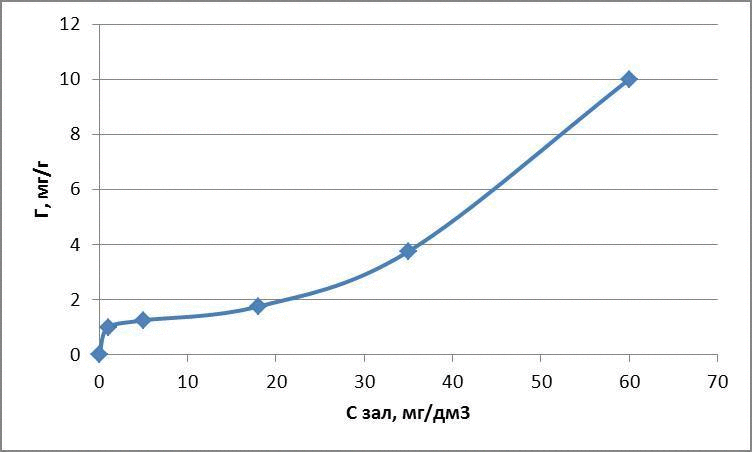
Рисунок 4.2 – Ізотерми адсорбції метилового червоного
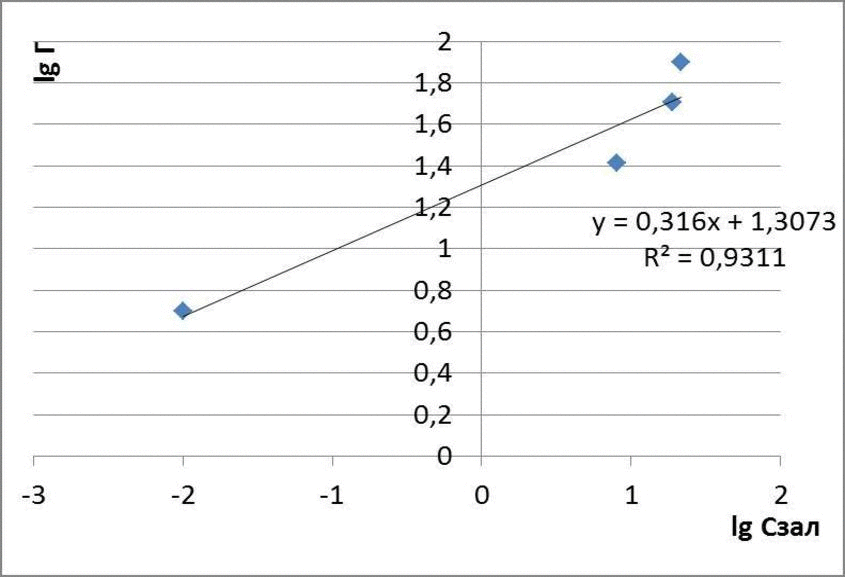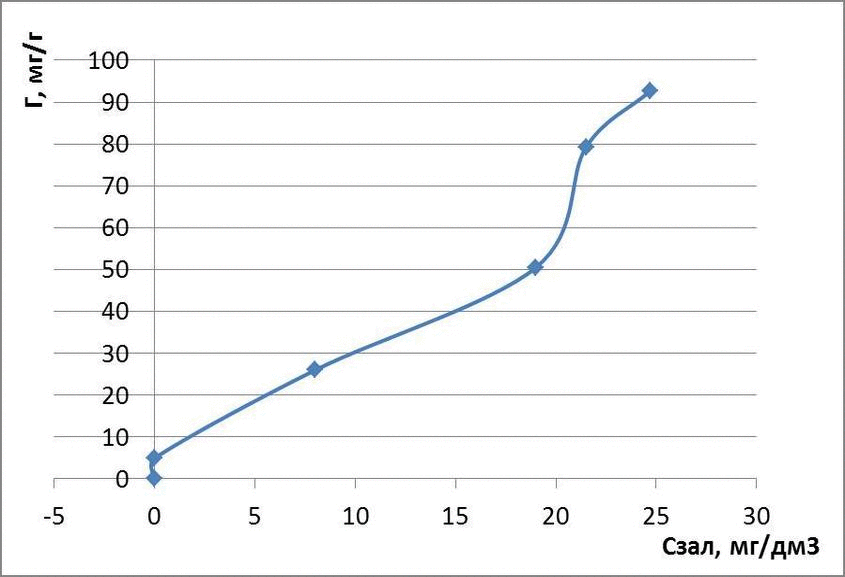
Рисунок 4.3 – Ізотерми адсорбції метилового оранжевого
Таким чином, в результаті проведених дослідів були отримані рівняння Фрейндліха:
для метилового оранжевого: Г = 0,11 · С1,05
для метилового червоного: Г = 0,096 · С0,44
для метиленового синього: Г = 1,31 · С0,7
Висновки
За результатами виконанної роботи зроблені наступні висновки:
1 – розглянуто загальну характеристику глауконіту, наведені основні фізико–хімічні властивості мінералу. Доведено універсальність застосування в різноманітних галузях промисловості.
2 – розглянуті фізико–хімічні основи процесу адсорбції, наведені основні рівняння, з яких знаходимо адсорбційні константи, фактори які впливають на процес адсорбції.
3 – експериментально вивчені сорбційні властивості глауконіту по відношень до барвників. Отримано сорбційнну активність глауконіту у порівняні з активованім вугіллям від 60 до 80 %. Знайдені рівняння Фрейндліха свідчать про високу міжмолекулярну залежність між адсорбентом і адсорбатом.
4 – доведено перспективність та ефективність використання природних сорбентів, зокрема глауконіту для очищення стічних вод підтверджується його перевагами у порівнянні з іншими, а саме: собівартості, в можливості багаторазового використання та без регенерації.
В подальшому планується вивчити сорбційнну активність глауконіту по відношенню до важких металів та органічних забруднювачів.
Перелік посилань
- Івченко, В.Д. Очищення стічних вод від іонів амонію та феруму глинистими мінералами Сумської області: Автореф. канд. техн. наук: 21.06.01 / Сумський національний аграрний університет – С., 2012. – 35 с.
- Зубков Р.M., Матлак Е.С. Екологічна обстановка в донецькій області / / Одеський гідрометеорологічний інститут. Матеріали III Всеукраїнської наукової студентської конференції "Екологічні проблеми регіонів" (м. Одеса, 25-26 квітня 2001 р.) - с. 30-32.
- Зубков Р.M., Редько А. Л. Екологічні проблеми донецько-макіївської промислово-міської агломерації // Вісник Донбаської державної академії будівництва та архітектури. Збірник наукових праць. Випуск 99-4 (18). Матеріали XXV студентської науково-технічної конференції студентів (27-28 квітня 1999 р.) - с. 78.
- Литвин, Т.С. Сорбційна активність глауконіту Амвросіївського родовища / О.А. Трошина, І.В. Качур, Т.С. Литвин // Матерiали ХХIIІ Всеукраїнської наукової конференцiї аспiрантiв і студентів. – Т.1 – Донецьк: ДонНТУ, 2013. – С. 80 - 81
- Запольський, А.К. Водопостачання, водовідведення та якість води: Підручник / А. К. Запольський. – К.: Вища школа, 2005. – 671 с.
- Таубаева Э.С. Сорбционные свойства глауконита / Э.С. Таубаева, У.Ж. Джусипбеков, С.М. Жунусов
- Фізико-хімічні основи технології очищення стічних вод / За редакцією А.К. Запольського. - Київ: Лібра, 2000. – 549 с.
- Смирнов, А.Д. Сорбционная очистка воды / А.Д. Смирнов. – Л.: Химия, 1982. – 168 с.
- Когановский, А.М. Адсорбция и ионный обмен в процессах водоподготовки и очистки сточных вод. / А.М. Когановский. – К.: Наукова думка, 1983. – 240 с.
- ГОСТ 4453 – 74. Уголь активный осветляющий древесный порошкообразный. Технические условия. М.: Государственный комитет стандартов, 1974. –11 с.