Реферат по теме выпускной работы
Содержание
- Введение
- 1. Актуальность, цель и задачи исследования и запланированные результаты
- 2. Общая характеристика глауконита
- 3.Физико–химические основы процесса адсорбции
- 4. Методика эксперимента
- Выводы
- Перечень ссылок
Введение
Загрязнение природных водоемов в результате хозяйственной деятельности человека на сегодня является одной из наиболее актуальных проблем, решение которой требует сплоченных усилий мирового научного сообщества. Современные темпы роста народонаселения в мире непременно повлекут дальнейшее наращивание объемов промышленного производства энергетической отрасли, увеличение площадей занятых в земледелии, развитие городских инфраструктур. Развитие всех этих отраслей требует интенсивной эксплуатации водных ресурсов необратимо связано с увеличением нагрузки на водные объекты из-за сброса стоков. Небрежное отношение к этой проблеме провоцирует катастрофические последствия, которые приобретают планетарного масштаба [1].
Водные ресурсы Донецкого региона формируются за счет транзитного притока поверхностных вод, в основном по реке Северский Донец за счет Харьковской области, местного речного стока, сточных, шахтных и карьерных вод, а также эксплуатационных запасов подземных вод (1067 тыс. куб. м на сутки). Свежую воду используют предприятия металлургической, угольной промышленности, энергетики, коммунального и сельского хозяйства. Основными загрязнителями водных объектов являются предприятия горной и металлургической промышленности. Ежегодно они сбрасывают около 500 млн. куб. м шахтных вод, загрязненных минеральными солями, взвешенными веществами и бактериальными примесями. В малые реки Донецкой области ежегодно поступает около 1,5 млн. тонн солей, что привело к обмелению рек за последние годы на один метр [2].
К категории основных предприятий - загрязнителей металлургической промышленности следует отнести следующие: металлургический комбинат им. Ильича и Азовсталь
в Мариуполе, металлургический и коксохимический заводы в Енакиево, Алчевский металлургический комбинат, Алчевский и Стахановский коксохимические заводы. Необходимо также отметить, что из-за частых аварийных ситуаций на объектах канализационного хозяйства, их санитарно-эпидемиологическое состояние остается неудовлетворительным [3].
Таким образом, использование в течение длительного времени классических технологий водоочистки, привели к росту объемов загрязнений гидросферы, что требует новых стратегий и технологий очистки сточных вод [4].
1. Актуальность, цель и задачи исследования и запланированные результаты
При очистке сточных вод сорбционными методами как адсорбент используют активированный уголь. Целесообразно и рационально заменить его на природные сорбенты, которые с одной стороны являются недорогими и доступными материалами, а с другой - позволяют достичь высокой степени очистки. Актуальным является использование природного сорбента - глауконита [4].
Целью работы является экспериментальное изучение сорбционных свойств, качественных и количественных характеристик природного минерала - глауконита Амвросиевского месторождения.
Для достижения цели поставлены следующие задачи:
1 – провести технический анализ глауконита;
2 – исследовать экспериментально сорбционную активность глауконита по стандартным методикам в отношении метилового оранжевого, метилового красного и метиленового голубого;
3 – определить сорбционные свойства глауконита относительно тяжелых металлов и неорганических ионов;
4 – исследовать сорбционные свойства глауконита относительно органических веществ.
2. Общая характеристика глауконита
Глауконит относится к группе алюмосиликатов. Алюмосиликаты - группа природных и синтетических силикатов, комплексные анионы которых содержат кремний и алюминий. Как катионы выступают Na+, K+, Mg2+, Ca2+, а иногда Ba2+ и Li+. Природные алюмосиликаты являются наиболее распространенными минералами, на их долю приходится до 50% массы земной коры. К ним относятся полевые шпаты (альбит, ортоклаз, анортит), глинистые минералы и слюды. Алюмосиликаты не растворяются в воде. Природные алюмосиликаты не содержат гидроксильной группы и кристаллической воды, является тугоплавкими, термически устойчивыми соединениями. Глауконит является натуральный природный минерал, содержащийся в осадочных породах. Современная экотехнология обнаружила, что глауконит обладает рядом универсальных полезных свойств, которые можно использовать в различных сферах жизни. Уникальность этого минерала заключается в его высоких ионообменных, буферных и сорбционных свойствах.
Глауконит (от греч. Glaukos – светло–зеленый
) – минерал, водный алюмосиликат железа, кремнезема и oксидa калия непостоянного состава. Химическая формула (K, H2O) · (Fe3+, Al, Fe2+, Mg) · 2[Si2AlO10] (OH)2 · nH2O. Элементы, которые находятся в составе минерала легко заменяются в форме переменных катионов. Этим свойством, а также слоистой структурой, объясняются высокие сорбционные свойства по отношению к нефтепродуктам, тяжелых металлов, радионуклидов. В то же время для глауконита характерен низкий процент десорбции (удаление из жидкостей или твердых тел веществ, поглощенных при адсорбции или абсорбции), высокая теплоемкость, пластичность.
Химический состав очень изменчив:
оксид калия (K2О) 4,4 – 9,4 %,
оксид натрия (Na2O) 0 – 3,5 %,
оксид алюминия (Al2O3) 5,5 – 22,6 %,
оксид железа (Fe2O3) 6,1 – 27,9 %,
диоксид железа (FeO) 0,8 – 8,6 %,
оксид магния (MgO) 2,4 – 4,5 %,
диоксид кремния (SiO 2) 47,6 – 52,9 %,
вода (H2O) 4,9 – 13,5 %.
Глауконит существует в виде маленьких, округленных зеленых зерен. Распространен во всех геологических системах - в песках, песчаниках, глинах, мергелях и известняках, придает окраску в зеленоватые цвета. Образование глауконита происходит и в настоящее время на дне морей с участием мелких организмов. Твердость по минералогической шкале 2 - 3, плотность 2,2 - 2,8 г/см3. Глауконит является перспективным полезным ископаемым разносторонего применения. Выявлено четыре формы нахождения его в палеогеновых отложениях, пять типоморфных и три генетические разновидности (аллотигенный дальнеприносной, аллотигенный реликтовый и аутигенный). В аутигеном глауконите определено более 50 химических элементов, соотношение которых отражают палеогеографические условия глауконизации.
Установлено, что при фильтрации через него загрязненных вод практически полностью удаляются соединения железа и аммиака, на порядок снижается содержание в воде нефтепродуктов, в 25 - 50 раз снижается содержание радиоактивных изотопов цезия-137 и стронция -90. Глауконит негорючий, нетоксичный, нелетучий, не растворяется в воде, кислотах и разбавленных щелочах. Область химической стойкости рН = 1 - 10. Срок годности природного сорбента глауконита не ограничен. Глауконит обладает высокими адсорбционными и ионообменными свойствами. Минерал обладает свойством избирательного поглощения катионов и долгоживущих радиоизотопов [5].
Способность глауконита сорбировать тяжелые металлы из растворов составляет (ви% от исходного содержания) Pb - 99, Hg - 64, Co - 97, Cu - 96, Cd - 96, Mn - 95, Cr - 92, Ni - 90 Zn - 90, Fe - 99. Сорбент имеет хорошие эксплуатационные показателями и, как следствие, не требует дополнительных мер по промывке колонки и ее перегрузки. Поскольку глауконит имеет большую активную поверхность, он выражено и селективно сорбирует аммиак, сероводород, метан, углекислый газ, углеводороды, фенолы, экзо-и эндотоксины, тяжелые металлы, радионуклиды, некоторые микроорганизмы. Глауконит способен сорбировать и выводить из организма некоторые катионы, являясь при этом дополнительным источником минеральных элементов. Металлы, имеющие большую атомную массу, десорбируются значительно хуже, чем легкие. Также, глауконит может выводить из организма соли тяжелых металлов [6].
Преимущества его как сорбента:
- широкий спектр сорбуемих веществ (нефтепродукты, тяжелые металлы, пестициды, радионуклиды);
- в отличие от синтетических, поролоновых, нетканых сорбентов, угольных глауконит не горит;
- не разрушается структура сорбента (по сравнению с полимерными, синтетическими, поролоновыми сорбентами) при взаимодействии с нефтепродуктами;
- работоспособен в широком интервале температур от -20 до + 100 0С.
Одним из направлений использования глауконита является применение его на твердых поверхностях и почвах, подвергшихся длительного загрязнения нефтепродуктами, тяжелыми металлами. Преимущество глауконита в том, что после очистки загрязненных объектов, определенным количеством сорбента, вредные вещества по концентрации достигают уровня ПДК, т.е. класс опасности отходов снижаются до безопасного. Обработанные таким образом площади, не надо санировать. При этом очищенная сорбентом почва остается на месте, а не перемещается на полигон опасных отходов, исключает дополнительные затраты на ее утилизацию.
Таким образом, глауконит целесообразно использовать, как адсорбент для извлечения из природных и сточных вод различных загрязнителей [7].
3. Физико–химические основы процесса адсорбции
Сорбционные методы очень эффективны для извлечения из сточных вод ценных растворенных веществ с их последующей утилизацией и использования очищенных сточных вод в системах оборотного водоснабжения промышленных предприятий. Основные сведения о сорбционных свойствах материала и характер адсорбции на нем определенных веществ могут быть получены из изотерм адсорбции, характеризующие зависимость сорбционной способности от концентрации (или давления) компонента, сорбируется, при постоянной температуре. Брунауэр, Эммет и Теллер[8] выделили пять основных типов изотерм сорбции, так называемых изотерм по БЭТ (рисунок 3.1). Выпуклые участки изотерм I, II и IV типов указывают на наличие в сорбентах микропор, но, кроме того, сорбенты II и IV имеют еще и макропоры. Изотермы III и V типов встречаются реже и описывают сильное межмолекулярное взаимодействие в веществе сорбата. Крутизна изотермы I типа характеризует размер микропор сорбентов: а - ультрамикропористих, б - микропористых.
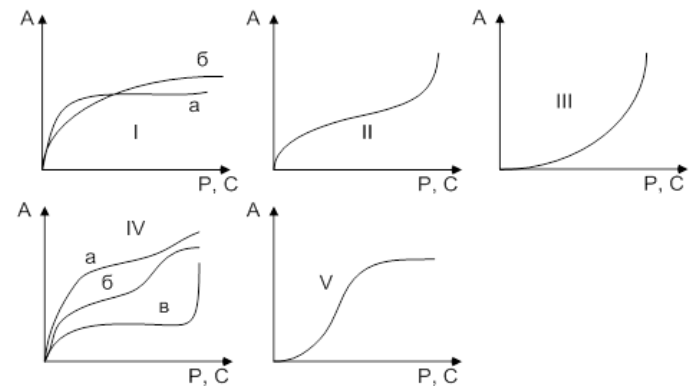
І – наличие в сорбенте микропор, II і IV имеются макропоры и микропоры, III і V – описуют сильное межмолекулярное взаимодействие сорбата
Рисунок 3.1 – Типы изотерм адсорбции по БЭТ
Для аналитического описания изотермы мономолекулярной адсорбции используют уравнение Ленгмюра:
А = Апред · С / (1 + кС),
где А – удельная адсорбция, ммоль/г;
Апред – предельная адсорбция, ммоль/г;
С – равновесная концентрация адсорбата, ммоль/дм3;
к – адсорбционная константа.
Графическое выражение этого уравнения приведен на рисунке 3.3. На изотерме можно выделить три характерных участка. Начальная линия имеет прямолинейный участок, указывающая на то, что при малых концентрациях величина удельной адсорбционной способности прямо пропорциональна этим концентрациям. Это, в значительной степени, отвечает еще свободной поверхности адсорбента.
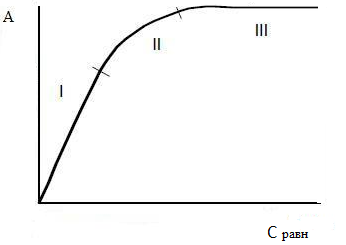
Рисунок 3.3 – Изотерма адсорбции Ленгмюра
Почти горизонтальный участок, который отвечает большим концентрациям, соответствует поверхности адсорбента, полностью насыщенным адсорбтивом. Размер удельной адсорбционной способности в этом случае не зависит от равновесной концентрации адсорбтива в растворе, что свидетельствует об образовании на поверхности мономолекулярного слоя. Средний участок изотермы соответствует промежуточным степеням заполнения поверхности. Уравнение Ленгмюра описывает изотерму адсорбции во всех областях равновесных концентраций. При малых концентрациях формула упрощается приобретает вид:
А = Апред · кС
Предел адсорбции соответствует количеству адсорбтива, приходящаяся на единицу поверхности при предельной упаковке ее молекул в мономолекулярном слое. Как было отмечено ранее, между концентрацией адсорбтива в растворе и на поверхности адсорбента существует равновесие, то есть когда число адсорбированных молекул в единицу времени равно количеству десорбируемых. Совершенно очевидно, что соотношение между величинами удельной адсорбционной способности и равновесной концентрации для одного и того же вида адсорбтива и адсорбента будет определяться температурой.
Так, величина А с увеличением температуры будет уменьшаться, так как при этом увеличивается десорбция молекул с поверхности адсорбента за счет увеличения скорости теплового движения. Поэтому изотерма адсорбции более высоких температур будет лежать ниже, чем для низких (рисунок 3.4). Однако, при повышении температуры предел адсорбции не должен меняться, так как количество активных центров на адсорбенте не меняется, как меняются размеры молекул. Итак, изотермы, соответствующие разным температурам при достижении определенных равновесных концентраций должны сливаться в одну.
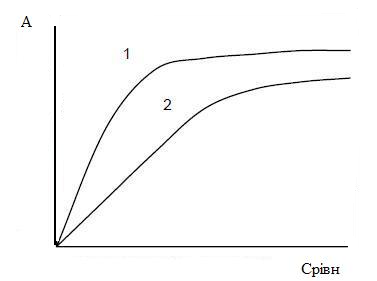
1 – изотерма адсорбции, которая отвечает более низким температурам; 2 – изотерма адсорбции, которая отвечает более высоким температурам
Рисунок 3.4 – Вид изотерм при разных температурах[9].
В области промежуточных равновесных концентраций (на небольших участках изменения концентрации адсорбата) зависимость адсорбции от концентрации часто может быть описана уравнением Фрейндлиха, в основе которого лежит предположение, что изотерма адсорбции является параболой:
А = к · С1/n ,
где к и 1 / n - константы.
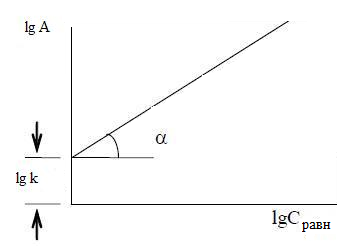
В логарифмическом виде уравнения Фрейндлиха представляется прямой (рисунок 3.4). Имеет вид:
lg A = lg к + 1/n lg C
 0
0
Рисунок 3.5 – Схема определения констант в уравнении Френдлиха
Отрезок, отсекается на оси ординат, равен lg К, tg? = 1 / n. В практике встречаются и другие, более сложные виды изотерм, отвечающие индивидуальным свойствам адсорбента и адсорбтива[5]. Таким образом, адсорбция является сложным гетерогенным процессом, эффективность которого зависит от многих факторов.
4. Методика эксперимента
Для определения сорбционной активности глауконита было проведено ряд экспериментов по стандартной методике [10]. Согласно [10] определяли сорбционную активность глауконита фракции (1 - 3) мм по отношению к метиловому красному, метиловому оранжевому и метиленовому голубому. Образец глауконита массой 0,1 г помещали в колбы 100 мл и добавляли 25 мл раствора красителя концентрацией 1500 мг/дм3. Затем отделяли глауконит от раствора и находили оптическую плотность для метилового оранжевого при длине волны 400 нм, метилового красного - 490 нм, для метиленового голубого - 590 нм. Остаточная концентрация красителя определяли колориметрическим методом с помощью калибровочного графика. Адсорбционную активность (Х) в миллиграммах на 1 грамм продукта рассчитывали по формуле:
Х = (С1 – С2 · К) · 0,025 / m
де С1 –массовая концентрация исходного раствора касителя, мг/дм3;
С2 – массовая концентрация раствора после взаимодействия с глауконитом, мг/дм3;
К – коэффициент разбавления раствора, взятого для анализа, после взаимодействия с глауконитом;
m – масса навески, г;
0,025 –объем раствора индикатора, дм3.
Исследования проводились в статистических условиях, результаты приведены в таблице 1.1
Таблица 1.1 – Экспериментальные данные сорбционной активности глауконита
| Краситель | Масса глауконита, г | Исходная концентрация, мг/дм3 | Остаточная концентрация, мг/дм3 | Адсорбионная емкость, мг/г |
| Метиленовый голубой | 0,1 | 1500 | 990 | 127,5 |
| Метиловый оранжевый | 0,1 | 1500 | 780 | 181,5 |
| Метиловый красный | 0,1 | 1500 | 840 | 164,5 |
Для получения изотерм адсорбции и нахождения констант в уравнении Фрейндлиха был проведен ряд исследований. Полученные данные приведены в таблицах 1.2 - 1.4.
Таблица 1.2 – Экспериментальные данные определения концентрации метилового оранжевого в растворе
| Исходная концентрация, мг/дм3 | Масса глауконита, г | Остаточная концентрация, мг/дм3 | Адсорбционная емкость, мг/г | lg Г | lg Cост |
| 30 | 0,1 | 0,01 | 4,99 | 0,69 | -2 |
| 60 | 0,1 | 8 | 26 | 1,41 | 0,90 |
| 120 | 0,1 | 19,0 | 50,5 | 1,70 | 1,27 |
| 180 | 0,1 | 21,5 | 79,25 | 1,89 | 1,33 |
| 210 | 0,1 | 24,7 | 92,65 | 1,96 | 1,39 |
Таблица 1.3 – Экспериментальные данные определения концентрации метиленового голубого в растворе
| Исходная концентрация, мг/дм3 | Масса глауконита, г | Остаточная концентрация, мг/дм3 | Адсорбционная емкость, мг/г | lg Г | lg Cост |
| 30 | 0,1 | 12 | 7,47 | 0,87 | 1,07 |
| 60 | 0,1 | 17,6 | 14,96 | 1,17 | 1,24 |
| 120 | 0,1 | 38 | 20,5 | 1,31 | 1,57 |
| 150 | 0,1 | 59 | 22,75 | 1,35 | 1,77 |
| 210 | 0,1 | 122 | 23,45 | 1,37 | 2,08 |
| 240 | 0,1 | 137 | 25,75 | 1,41 | 2,13 |
Таблица 1.4 –Экспериментальные данные определения концентрации метилового красного в растворе
| Исходная концентрация, мг/дм3 | Масса глауконита, г | Остаточная концентрация, мг/дм3 | Адсорбционная емкость, мг/г | lg Г | lg Cост |
| 5 | 0,1 | 1 | 1 | 0 | 0 |
| 10 | 0,1 | 5 | 1,25 | 0,096 | 0,69 |
| 25 | 0,1 | 7 | 1,75 | 0,24 | 1,25 |
| 50 | 0,1 | 35 | 3,75 | 0,57 | 1,54 |
| 100 | 0,1 | 60 | 10 | 1,0 | 1,77 |
По полученным данным построили изотермы адсорбции в логарифмических и натуральных координатах, представленные на рисунках 4.1 - 4.3
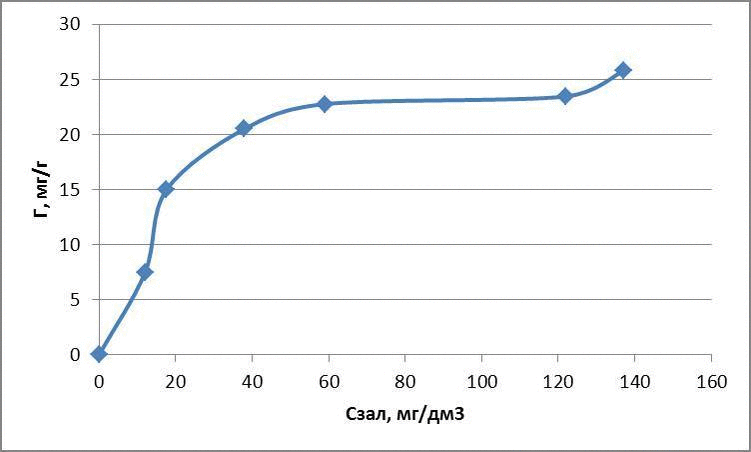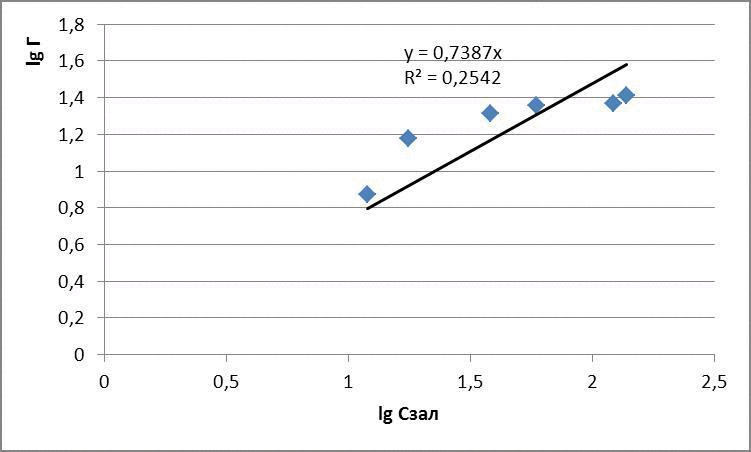
Рисунок 4.1 – Изотермы адсорбции метиленового голубого
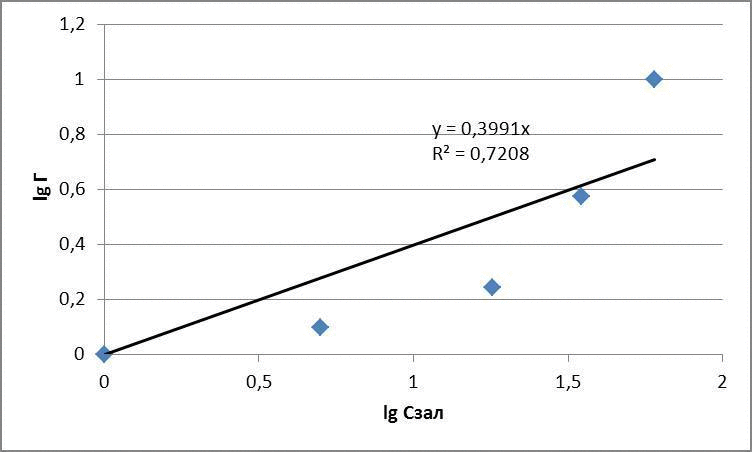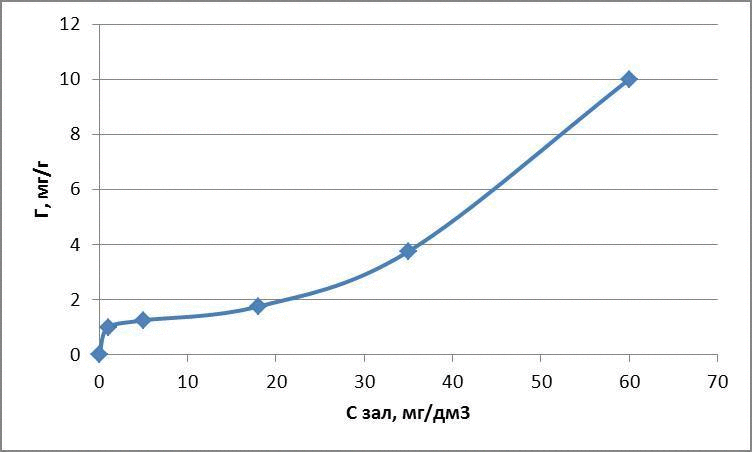
Рисунок 4.2 – Изотермы адсорбции метилового красного
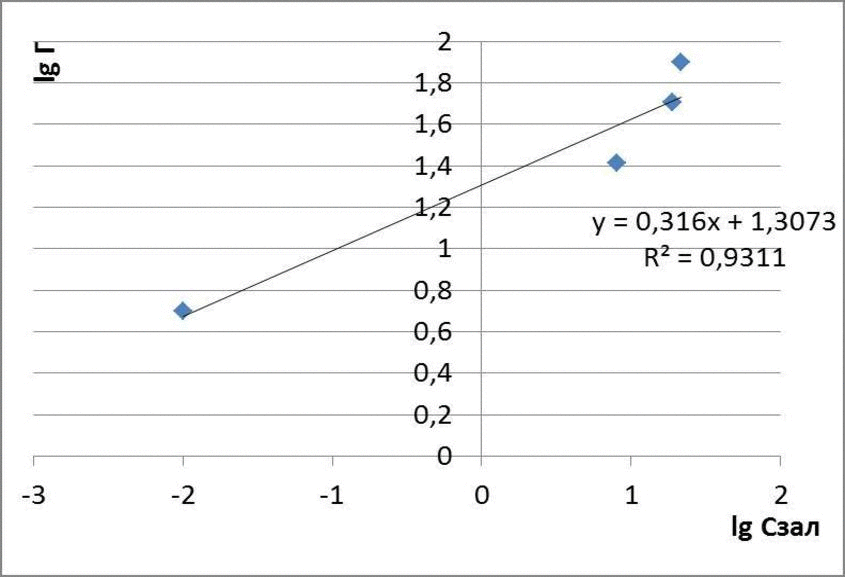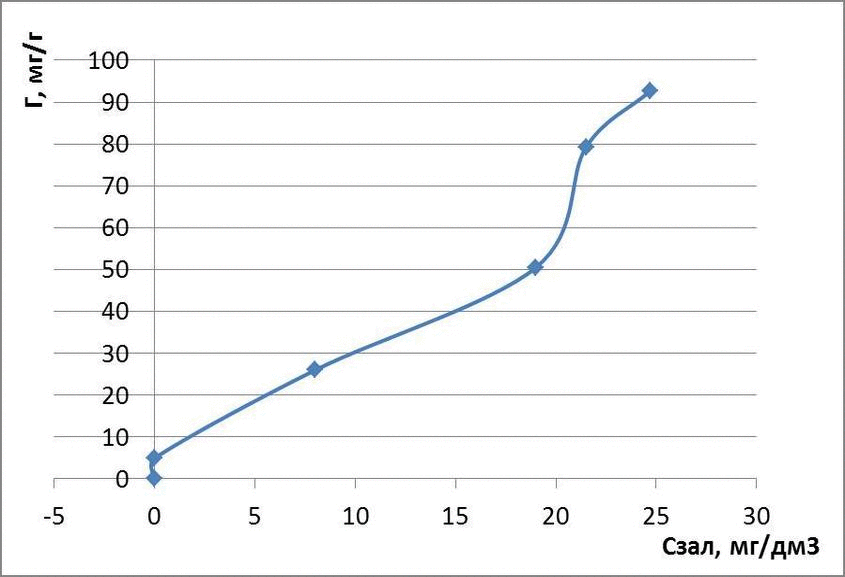
Рисунок 4.3 – Изотермы адсорбции метилового оранжевого
Таким образом, в результате проведенных экспериментов были получены уравнения Фрейндлиха:
для метилового оранжевого: Г = 0,11 · С1,05
для метилового красного: Г = 0,096 · С0,44
для метиленового голубого: Г = 1,31 · С0,7
Выводы
По результатам выполненной работы сделаны следующие выводы:
1 – рассмотрено общую характеристику глауконита, приведены основные физико–химические свойства минерала. Доказано универсальность применения в различных отраслях промышлености.
2 – рассмотрены физико–химические основы процесса адсорбции, приведены основные уравнения, из которых находим адсорбционные константы, факторы влияющие на процесс адсорбции.
3 – экспериментально изучены сорбционные свойства глауконита по отношению к красителям. Получена сорбционная активность глауконита по сравнению с активированным углем от 60 до 80 %. Представленные уравнения Фрейндлиха свидетельствуют о высокой межмолекулярной взаимосвязи между адсорбентом и адсорбатом.
4 – доказана перспективность и эффективность использования природных сорбентов, в частности глауконита для очистки сточных вод подтверждается его преимуществами перед другими, а именно: в доступности, себестоимости, в возможности многоразового использования и без регенерации.
В дальнейшем планируется изучить сорбционную активность глауконита по отношению к тяжелым металлам и органическим загрязнителям.
Перечень ссылок
- Івченко, В.Д. Очищення стічних вод від іонів амонію та феруму глинистими мінералами Сумської області: Автореф. канд. техн. наук: 21.06.01 / Сумський національний аграрний університет – С., 2012. – 35 с.
- Зубков Р.M., Матлак Е.С. Екологічна обстановка в донецькій області / / Одеський гідрометеорологічний інститут. Матеріали III Всеукраїнської наукової студентської конференції "Екологічні проблеми регіонів" (м. Одеса, 25-26 квітня 2001 р.) - с. 30-32.
- Зубков Р.M., Редько А. Л. Екологічні проблеми донецько-макіївської промислово-міської агломерації // Вісник Донбаської державної академії будівництва та архітектури. Збірник наукових праць. Випуск 99-4 (18). Матеріали XXV студентської науково-технічної конференції студентів (27-28 квітня 1999 р.) - с. 78.
- Литвин, Т.С. Сорбційна активність глауконіту Амвросіївського родовища / О.А. Трошина, І.В. Качур, Т.С. Литвин // Матерiали ХХIIІ Всеукраїнської наукової конференцiї аспiрантiв і студентів. – Т.1 – Донецьк: ДонНТУ, 2013. – С. 80 - 81
- Запольський, А.К. Водопостачання, водовідведення та якість води: Підручник / А. К. Запольський. – К.: Вища школа, 2005. – 671 с.
- Таубаева Э.С. Сорбционные свойства глауконита / Э.С. Таубаева, У.Ж. Джусипбеков, С.М. Жунусов
- Фізико-хімічні основи технології очищення стічних вод / За редакцією А.К. Запольського. - Київ: Лібра, 2000. – 549 с.
- Смирнов, А.Д. Сорбционная очистка воды / А.Д. Смирнов. – Л.: Химия, 1982. – 168 с.
- Когановский, А.М. Адсорбция и ионный обмен в процессах водоподготовки и очистки сточных вод. / А.М. Когановский. – К.: Наукова думка, 1983. – 240 с.
- ГОСТ 4453 – 74. Уголь активный осветляющий древесный порошкообразный. Технические условия. М.: Государственный комитет стандартов, 1974. –11 с.