Осовская Анастасия Андреевна
Факультет экологии и химической технологии
Кафедра прикладной экологии и охраны окружающей среды
Специальность «Технология тугоплавких неметаллических и силикатных материалов»
Механизм выделения гидроксида алюминия из растворов алюмината натрия
Научный руководитель: д.х.н., профессор Шаповалов Валерий Васильевич
Реферат по теме выпускной работы
Содержание
Введение1. Актуальность темы
2. Цели и задачи исследования
3. Механизм выделения гидроксида алюминия из раствора алюмината натрия
Вывод
Список источников
Введение
Глинозем является основным исходным материалом для производства первичного алюминия, остальное — производство спеченной и плавленой корундовой керамики, огнеупоров, высокоглиноземистого цемента и т.п. Каждая область применения глинозема нуждается в выполнении определенных технических условий, обозначенных в ДСТУ или ГОСТ [1].
Алюминий — металл стратегического значения, в котором объединяется ряд ценных физико-химических свойств, которые подтверждаются широким спектром областей его применения: от товаров народного потребления до самолетостроения. Амфотерные свойства алюминия существенно расширяют возможности получения глинозема из руд разного состава. Содержание алюминия по массе в земной коре — 8,13 % — третье после кислорода и кремния. Однако для получения оксида алюминия — необходимого полупродукта в технологии алюминия — используется ограниченный круг минералов и руд.
В Украине производство глинозема осуществляется из импортированного боксита по схеме Байера, который является простейшим и наиболее дешевым.

Рисунок 1 – Производство глинозема по схеме Байера
Одним из главных методов при производстве глинозема является карбонизация. Карбонизация необходима для разложения алюминатных растворов с целью выделения гидроокиси алюминия.
Она состоит в обработке алюминатного раствора газами, содержащими углекислый газ [2].
Сложность проведения данного процесса состоит в том, что на карбонизацию алюминатного раствора, т.е. на течение самого процесса и на качество получаемого гидрата окиси алюминия, существенное влияние оказывают следующие факторы:
- температурные условия;
- перемешивание;
- продолжительность (скорость карбонизации);
- степень (глубина) разложения раствора.
1. Актуальность темы
В работе рассмотрена принципиально новая схема процесса карбонизации алюминатных растворов, включающая образование в качестве первичного продукта алюмокарбоната натрия и последующее его превращение в гидроксид алюминия в реакции с алюминатом натрия.
2. Цели и задачи исследования
Главной целью является исследование новой схемы процесса карбонизации алюминатных растворов и объяснение причины загрязнения гидроксида алюминия соединениями натрия.
Задача состоит в получении экспериментальных данных, которые подтвердят новую схему процесса карбонизации алюминатных растворов.
3. Механизм выделения гидроксида алюминия из растворов алюмината натрия
Карбонизация — один из методов, применяемых в практике производства глинозема для разложения алюминатных растворов с целью выделения кристаллической гидроокиси алюминия [3].
Для выделения Al(OH) 3 целесообразно применение карбонизации, так как, наряду с гидроокисью алюминия, получается раствор соды, который используется как оборотный раствор. С химической точки зрения процесс карбонизации протекает в несколько стадий [4]. Диоксид углерода сначала расходуется на преодоление буферной емкости с последующим формированием рентгеноаморфной фазы, которая растворяется в избытке каустической щелочи:
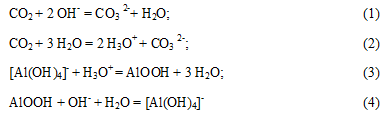
В условиях сопоставимых скоростей образования новых частиц и кристаллизации в твердую фазу выделяется тригидроксид алюминия:
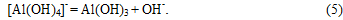
При дальнейшей карбонизации углекислота расходуется на образование в растворе бикарбонатных ионов:

При величинах pH жидкой фазы ниже 10 ед. и увеличения содержания в ней ионов HCO3- происходит образование алюмокарбонатов щелочных металлов:
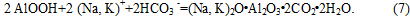
На карбонизацию алюминатного раствора, т.е. на течение самого процесса и главным образом — на качество получаемого гидрата окиси алюминия, существенное влияние оказывают следующие факторы: 1) температурные условия; 2) перемешивание; 3) продолжительность (скорость карбонизации); 4) степень (глубина) разложения раствора. В промышленных условиях эти факторы должны сочетаться таким образом, чтобы получаемый гидрат окиси алюминия содержал возможно меньше примесей кремнезема и щелочи, а крупность кристаллов его была такой, чтобы гидратная пульпа хорошо фильтровалась [5]. Если на загрязнение гидроокиси алюминия кремнеземом наиболее существенное влияние оказывает чистота исходного алюминатного раствора, то на загрязнение гидрата щелочью влияет совокупность многих факторов, поэтому природа (происхождение) щелочи в гидроокиси алюминия не столь проста. Примесь щелочи содержится в гидроокиси алюминия, во-первых, в виде так называемой отмываемой щелочи, которая может быть полностью удалена из гидрата кипячением с водой и представляет собой щелочь, адсорбированную гидроокисью из маточного раствора; во-вторых, в виде связанной щелочи (гидроалюмосиликат натрия) и, в-третьих, в виде так называемой межкристальной щелочи, которая заключена между гранями отдельных • кристаллов гидроокиси в агрегатах. Межкристальная щелочь может быть удалена только при нагревании гидроокиси алюминия до высокой температуры. Примесь щелочи в гидроокиси алюминия, помимо ухудшения качества получаемого Аl2О3, увеличивает безвозвратные потери [6].
В основу приведенных в литературе схем процесса карбонизации (аналогичных схеме 1-7) положен факт, что алюмокарбонаты щелочных металлов получаются в конце процесса карбонизации и рассматриваются как примесные продукты [7].
Однако наиболее полное и систематическое исследование влияния разных факторов на процесс карбонизации алюминатных растворов показывает, что в большей или меньшей степени получаемый гидроксид алюминия всегда содержит гидроалюмокарбонат натрия.
Исходя из представлений координационной химии, учитывая, что алюминат натрия является координационным соединением, можно предложить альтернативную схему карбонизации исходящую из того, что первичным продуктом карбонизации является гидроалюмокарбонат натрия, который в дальнейшем взаимодействует со щелочью и алюминатом натрия с образованием гидроксида алюминия. Процесс карбонизации с этих позиций можно представить следующей схемой (индексы (р), (г) и (т) означают раствор, газ, твердое):
Алюминат натрия в растворе:
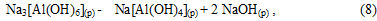
Начальный период карбонизации (индукционный период) при котором не наблюдается выпадение осадков гироксида алюминия и гидроалюмокарбоната натрия:
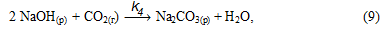
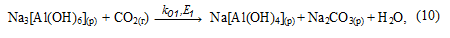
В растворе равновесие реакции (8), в результате связывания NaOH, смещается в сторону образования Na[Al(OH)4] и начинается его карбонизация с образованием гидроалюмокарбоната натрия:
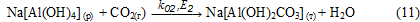
Осадок Na[Al(OH)2СО3] (т) взаимодействует с раствором алюмината натрия с образованием гидроксида алюминия:
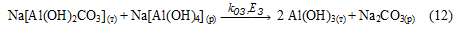
Предложенная схема подтверждается следующими экспериментальными данными:
1. Карбонизация алюминатного раствора имеет время индукции, в течение которого в растворе увеличивается концентрация карбоната натрия, но не происходит выделение из раствора твердых фаз гидроксида и гидрокарбоната алюминия – в растворе протекают реакции (8 - 10).
2. Гидрокарбонат натрия может взаимодействовать с алюминатным раствором по реакции (12) с образованием Al(OH)3, что подтверждается изменением ИК-спектров продуктов, содержащих ГАКН. После воздействия на них алюминатных растворов ИК-спектр продукта идентичен спектру Al(OH)3 (рис. 2). Поскольку реакция (12) является гетерогенной (твердое — раствор), то скорость ее будет относительно невелика
3.Образцы осадка после индукционного периода содержат гидроалюмокарбонат натрия. Его количество зависит от условий карбонизации (табл. 1-3) и рис. 3. Это обусловлено протеканием реакции (11). Скорость последней будет увеличиваться с увеличением концентрации СО2, скорости его подачи (табл.3) и с увеличением температуры (рис.3).
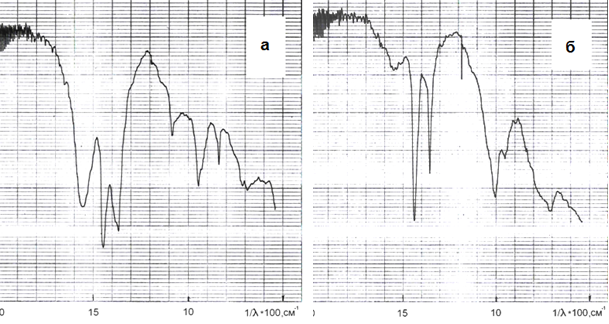
Рисунок 2 – ИК-спектры продукта карбонизации алюминатного раствора (а) и продукта его взаимодействия с алюминатным раствором (б). Исходная концентрация раствора перед карбонизацией — 51,6 г/л Al2O3, скорость подачи СО2 — 0,2 л/мин. (10 % углекислотно-воздушная смесь), время карбонизации 30 мин., температура — 70 °С, содержание ГАКН в гидроксиде алюминия - 35, 6 %. Время взаимодействия гидроалюмокарбоната с алюминатным раствором 150 мин., Т = 70 °С, содержание ГАКН в гидроксиде алюминия — 1,1 %
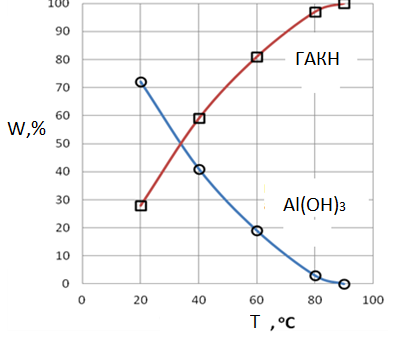
Рисунок 3 – Влияние температуры на образование гидроксида алюминия и гидроалюмокарбоната натрия.
Схеме (9-12) соответствует следующая система дифференциальных уравнений:
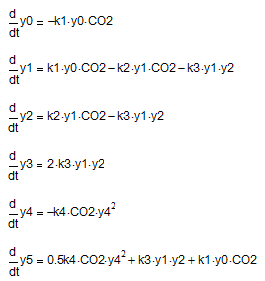
где y0, y1, y2, y3, y4, y5 – текущие концентрации Na3[Al(OH)6], Na[Al(OH)4], Na3[Al(OH)2CO3], Al(OH)3, NaOН и Na2CO3 соответственно; СО2 — условная концентрация СО2.
Кинетические параметры (ki) гетерогенных реакций (9 - 12) представляют собой некоторые комплексные величины, включающие в себя непосредственно химическое взаимодействие, гидродинамические и теплофизические условия, размер частиц твердой фазы, скорость перемешивания раствора и т.д. По этой причине они могут быть относительно определенными лишь при фиксированных условиях реализации технологического процесса карбонизации алюминатных растворов. По этой причине задача анализа решений приведенной системы уравнений состоит не в получении конкретных численных результатов, а в подтверждении принципиальной возможности правильного отклика предложенной схемы реакций на изменение условий карбонизации.
Результаты расчета в виде формализованных кинетических кривых представлены на рис. 4 и 5.
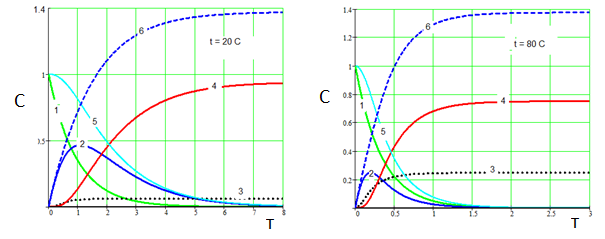
Рисунок 4 – Влияние температуры на карбонизацию алюминатного раствора. 1 – Na3[Al(OH)6], 2 - Na[Al(OH)4], 3 - Na3[Al(OH)2CO3], 4 - Al(OH)3, 5 – суммарная концентрация Al3+ в растворе, 6 – Na2CO3. СО2 = 0.5. (k01=1∙103 , E1 =15000; k02 =2∙106, E2=36000; k03=2∙103, E2=14000; k4=4)
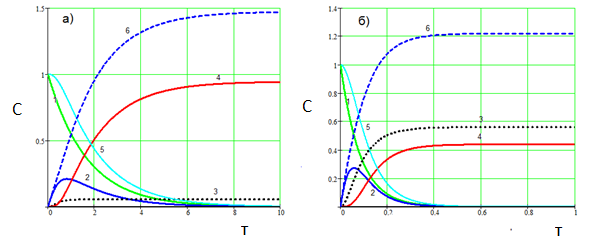
Рисунок 5 – Влияние скорости СО2 на карбонизацию алюминатного раствора. а) СО2 = 0.1 б) СО2 = 2.0. Температура 80 °С. 1 – Na3[Al(OH)6], 2 – Na[Al(OH)4], 3 - Na3[Al(OH)2CO3], 4 - Al(OH)3, 5 – суммарная концентрация Al3+ в растворе, 6 – Na2CO3. (k01=1∙103, E1=15000; k02=2∙106, E2=36000; k03=2∙103, E2=14000; k4=4)
Как видно из рис.4, температура карбонизации существенно влияет на соотношение (гидроксид алюминия) : (алюмокарбонат натрия). С повышением температуры доля алюмокарбоната натрия существенно возрастает. С повышением скорости пропускания СО2 количество получаемого Na3[Al(OH)2CO3] может превысить количество Al(OH)3 (рис. 5, б). В то же время (рис.5), уменьшение скорости подачи СО2 позволяет выделять из алюминатного раствора преимущественно гидроксид алюминия даже при высокой температуре (рис.5, а).
Расчетные кривые влияние температуры на образование гидроксида алюминия и гидроалюмокарбоната (рис.6) натрия идентичны кривым, построенным на основе экспериментальных данных и представленных на рис.4.
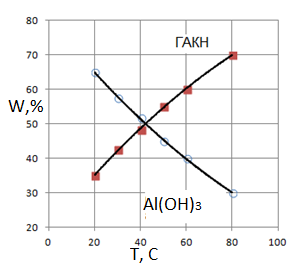
Рисунок 6 – Расчетные кривые влияние температуры на образование гидроксида алюминия и гидроалюмокарбоната натрия. СО2=1.5. (k01=1∙103, E1=15000; k02=2∙106, E2=36000; k03=2∙103, E2=14000; k4=4)
Вывод
Таким образом предложенная схема химических реакций позволяет принципиально изменить организацию технологического процесса карбонизации алюминатных растворов. Вместо трудно контролируемой одной стадии карбонизации всего алюминатного раствора, поступающего с отделения выщелачивания, получение гидроксида алюминия можно осуществлять в две хорошо контролируемые стадии. Для этого раствор после выщелачивания глинозема следует разделить на две части. Первую часть раствора необходимо карбонизовать до полного выделения алюминия в виде осадка гидроалюмокарбоната натрия. После отделения осадок смешивается со второй частью алюминатного раствора и в результате реакции (12) превращается в гидроксид алюминия. Образующийся содовый раствор поступает на выщелачивание спека.
Список источников
1. Лайнер, А. И. Производство глинозема / А. И. Лайнер, Н. И. Еремин, Ю. А. Лайнер. М.: Металлургия, 1978. 420 с.
2. Мазель, В. А. Производство глинозема / В.А. Мазель. - М.: Металлургиздат, 1955. - 430 с.
3. Клименко А.А. О возможности получения глинозема из отходов угле- и горнодобывающей промышленности методом спекания бесщелочного сырья с известняком / В.Н. Вечерко, Л.И. Кукоба, В.В. Шаповалов, В.И. Ванин // Наукові праці ДонНТУ. Серія: Хімія і хімічна технологія. 2012. Вип. 19(199). С. 151-157.
4. Патент 2197429 (РФ) C01F7/38, C01F7/14 Способ переработки алюминийсодержащего сырья / Липин В.А., Шмаргуненко А.Н., Беликов Е.А., Кузнецов А.А., Лазарев В.Г., Макаров С.Н 14.11.2000 (43). Дата публикации заявки: 27.09.2002 (45). Опубликовано: 27.01.2003.
5. Ханамирова, А. А. Глинозем и пути уменьшения содержания в нем примесей / А. А. Ханамирова / Отв. ред. И.З. Певзнер. Ереван: Изд-во АН АрмССР, 1983. 243 с
6. Томилов Н.П. Об условиях образования гидроалюмокарбонатов при взаимодействии алюминия с растворами карбонатов щелочных металлов / Н.П. Томилов, А.С. Бергер, А.И. Бойкова // Ж. нерган. химии. - 1969. Т. 14, № 3. С. 674-680.
7. Абрамов, В. Я. Физико-химические основы комплексной переработки алюминиевого сырья / В.Я. Абрамов, И.В. Николаев, Г.Д. Стельмакова. - М.: Металлургия, 1985. - 288 с.
