Осовська Анастасія Андріївна
Факультет экології та хімічної технології
Кафедра прикладної экології та охорони навколишнього середовища
Спеціальність „Хімічна технологія тугоплавких неметалевих та силікатних матеріалів“
Механізм виділення гідроксиду алюмінію з розчинів алюмінату натрію
Науковий керівник: д.х.н., професор Шаповалов Валерій Васильович
Реферат за темою випускної роботи
Зміст
Вступ1 Актуальність теми
2 Цілі та задачі роботи
3 Механізм виділення гідроксиду алюмінію з розчинів алюмінату натрію
Висновок
Перелік посилань
Вступ
Глинозем є основним вихідним матеріалом для виробництва первинного алюмінію, решта — виробництво спеченої і плавленой корундової кераміки, вогнетривів, высокоглиноземистого цементу і т.п. Кожна область застосування глинозему потребує виконання певних технічних умов, зазначених у ДСТУ або ГОСТ [1].
Алюміній — метал стратегічного значення, в якому об'єднується ряд цінних фізико-хімічних властивостей, які підтверджуються широким спектром областей його застосування: від товарів народного вжитку до літакобудування. Амфотерні властивості алюмінію суттєво розширюють можливості одержання глинозему з руд різного складу. Вміст алюмінію за масою в земній корі — 8,13 % — третє після кисню і кремнію. Однак для одержання оксиду алюмінію — необхідного напівпродукту в технології алюмінію — використовується обмежене коло мінералів і руд.
Одним з головних методів при виробництві глинозему є карбонізація. Карбонізація необхідна для розкладання алюмінатних розчинів з метою виділення гідроокису алюмінію. Вона полягає в обробці алюминатного розчину газами, що містять вуглекислий газ [2].
Складність проведення даного процесу полягає в тому, що на карбонізацію алюминатного розчину, тобто протягом самого процесу і на якість одержуваного гідрату окису алюмінію, істотний вплив роблять наступні фактори:
- температурні умови;
- перемішування;
- тривалість (швидкість карбонізації);
- ступінь (глибина) розкладання розчину.
1. Актуальність теми
В роботі розглянуто принципово нова схема процесу карбонізації алюмінатних розчинів, що включає освіта в якості первинного продукту алюмокарбоната натрію і подальше його перетворення в гідроксид алюмінію в реакції з алюмінатом натрію.
2. Цілі та задачі роботи
Головною метою є дослідження нової схеми процесу карбонізації алюмінатних розчинів і пояснення причини забруднення сполуками натрію гідроксиду алюмінію. Завдання полягає в отриманні експериментальних даних, які підтвердять нову схему процесу карбонізації алюмінатних розчинів.3. Механізм виділення гідроксиду алюмінію з розчинів алюмінату натрію
Карбонізація — один із методів, що застосовуються в практиці виробництва глинозему для розкладання алюмінатних розчинів з метою виділення кристалічної гідроокису алюмінію [3].
Для виділення Al(OH) 3 доцільно застосування карбонізації, так як, разом з гідроокисом алюмінію, виходить розчин соди, який використовується як оборотний розчин. З хімічної точки зору процес карбонізації протікає в декілька стадій[4]. Діоксид вуглецю спочатку витрачається на подолання буферної ємності з подальшим формуванням рентгеноаморфной фази, яка розчиняється в надлишку каустичної лугу:
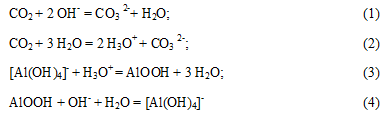
В умовах порівнянних швидкостей утворення нових частинок і кристалізації в тверду фазу виділяється тригидроксид алюмінію:
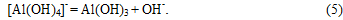
При подальшої карбонізації вуглекислота витрачається на освіту в розчині двокарбонатний іонів:

При величинах рн рідкої фази нижче 10 од. і збільшення вмісту в ній іонів HCO3 відбувається утворення алюмокарбонатов лужних металів:
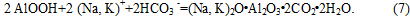
На карбонізацію алюминатного розчину, тобто протягом самого процесу і головним чином — на якість одержуваного гідрату окису алюмінію, істотний вплив роблять наступні фактори: 1) температурні умови; 2) змішування; 3) тривалість (швидкість карбонізації); 4) ступінь (глибина) розкладання розчину. У промислових умовах ці чинники повинні поєднуватися таким чином, щоб одержуваний гідрат окису алюмінію містив можливо менше домішок кремнезему і лугу, а крупність кристалів його була такою, щоб гідратне пульпа добре фильтрувалась[5]. Якщо на забруднення гідроокису алюмінію кремнеземом найбільш істотно впливає чистота вихідного алюминатного розчину, то на забруднення гідрату лугом впливає сукупність багатьох факторів, тож природа (походження) лугу в гідроокису алюмінію не настільки проста. Домішка лугу міститься в гідроокису алюмінію, по-перше, у вигляді так званої отмываемой лугу, яка може бути повністю вилучена з гідрату кип'ятінням з водою і являє собою луг, адсорбированную гідроокисом з маточного розчину; по-друге, у вигляді пов'язаної лугу (гидроалюмосиликат натрію) і, по-третє, у вигляді так званої межкристальной лугу, яка укладена між гранями окремих • кристалів гідроксиду в агрегатах. Межкристальная луг може бути видалена тільки при нагріванні гідроокису алюмінію до високої температури. Домішка лугу в гідроокису алюмінію, крім погіршення якості одержуваного Аl2О3, збільшує безповоротні втрати[6].
В основу наведених у літературі схем процесу карбонізації (аналогічних схемою 1-7) покладений факт, що алюмокарбонаты лужних металів утворюються в кінці процесу карбонізації і розглядаються як домішкові продукти. [7].
Проте найбільш повне і систематичне дослідження впливу різних факторів на процес карбонізації алюмінатних розчинів показує, що в більшій чи меншій мірі одержуваний гідроксид алюмінію завжди містить гидроалюмокарбонат натрію.
Виходячи з уявлень координаційної хімії, враховуючи, що алюмінат натрію є координаційною сполукою, можна запропонувати альтернативну схему карбонізації виходить з того, що первинним продуктом карбонізації є гидроалюмокарбонат натрію, який в подальшому взаємодіє з лугом і алюмінатом натрію з утворенням гідроксиду алюмінію. Процес карбонізації з цих позицій можна представити наступною схемою (індекси (р), (г) і (т) означають розчин, газ, тверде):
Алюмінат натрію в розчині:
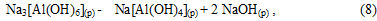
Початковий період карбонізації (індукційний період) при якому не спостерігається випадання опадів гироксида алюмінію і гидроалюмокарбоната натрію:
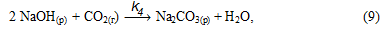
або сумарно:
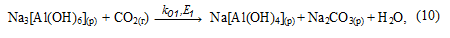
У розчині рівновага реакції (8), в результаті зв'язування NaOH, зміщується в бік утворення Na[Al(OH)4] і починається його карбонізація з утворенням гидроалюмокарбоната натрію:
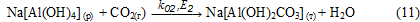
Осад Na[Al(OH)2СО3] (т) взаимодіє з розчином алюмінату натрію з утворенням гідроксиду алюмінію:
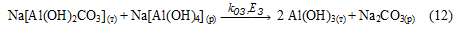
Запропонована схема підтверджується наступними експериментальними даними:
1. Карбонізація алюминатного розчину має час індукції, протягом якого у розчині збільшується концентрація карбонату натрію, але не відбувається виділення з розчину твердих фаз гідроксиду і гідрокарбонату алюмінію - в розчині протікають реакції (8 - 10).
2. Гідрокарбонат натрію може взаємодіяти з алюминатным розчином по реакції (12) з утворенням Al(OH)3, що підтверджується зміною ІЧ-спектрів продуктів, що містять ГАКН. Після впливу на них алюмінатних розчинів ІЧ-спектр продукту ідентичний спектру Al(OH)3 (рис. 1). Оскільки реакція (12) є гетерогенною (твердий розчин), то швидкість її буде відносно невелика
3. Зразки осаду після індукційного періоду містять гидроалюмокарбонат натрію. Його кількість залежить від умов карбонізації (табл. 1-3) і рис. 2. Це обумовлено перебігом реакції (11). Швидкість останньої буде збільшуватися із збільшенням концентрації СО2, швидкості його подачі (табл.3) і зі збільшенням температури (рис.2).
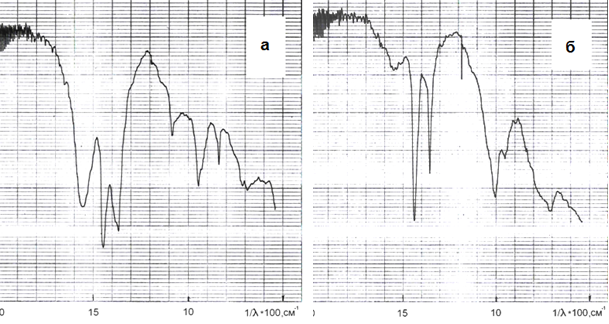
Рис.1. ІЧ-спектри продукту карбонізації алюминатного розчину (а) і продукту його взаємодії з алюмінатим розчином (б). Вихідна концентрація розчину перед карбонізацією - 51,6 г/л Al2O3, швидкість подачі СО2 - 0,2 л/хв. (10 % углекислотно-повітряна суміш), час карбонізації 30 хв., температура - 70 °С, вміст ГАКН в гідроксиді алюмінію – 35,6 % . Час взаємодії гидроалюмокарбоната з алюмінатним розчином 150 хв., Т = 70 °С, вміст ГАКН в гідроксиді алюмінію - 1,1 %
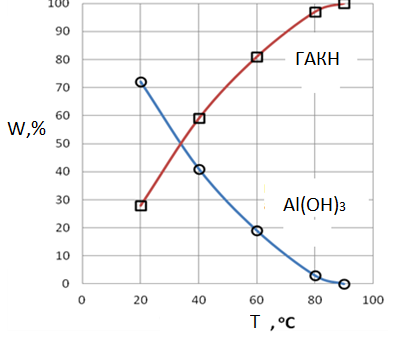
Рис.2. Вплив температури на утворення гідроксиду алюмінію і гидроалюмокарбоната натрію.
Схемою (9-12) відповідає наступна система рівнянь:
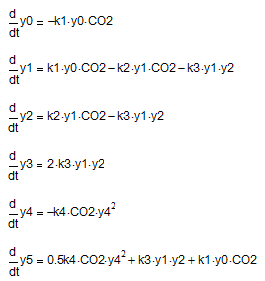
Кінетичні параметри (ki) гетерогенних реакцій (9 - 12) являють собою деякі комплексні величини, які включають в себе безпосередньо хімічну взаємодію, гідродинамічні і теплофізичні умови, розмір частинок твердої фази, швидкість перемішування розчину тощо. З цієї причини вони можуть бути відносно визначеними лише при фіксованих умовах реалізації технологічного процесу карбонізації алюмінатних розчинів. З цієї причини завдання аналізу рішень наведеної системи рівнянь полягає не в отриманні конкретних чисельних результатів, а в підтвердженні принципової можливості правильного відгуку запропонованої схеми реакцій на зміну умов карбонізації.
Результати розрахунку у вигляді формалізованих кінетичних кривих представлені на рис. 3 та 4.
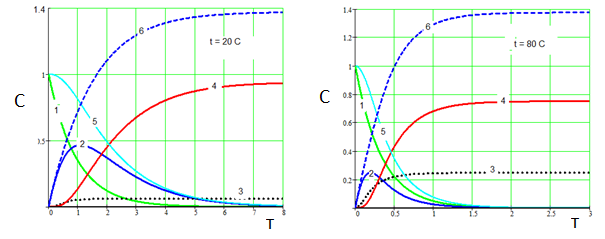
Рис.3. Вплив температури на карбонізацію алюминатного розчину. 1 – Na3[Al(OH)6], 2 - Na[Al(OH)4], 3 - Na3[Al(OH)2CO3], 4 - Al(OH)3, 5 – суммарная концентрация Al3+ в растворе, 6 – Na2CO3. СО2 = 0.5. (k01=1∙103 , E1 =15000; k02 =2∙106, E2=36000; k03=2∙103, E2=14000; k4=4)
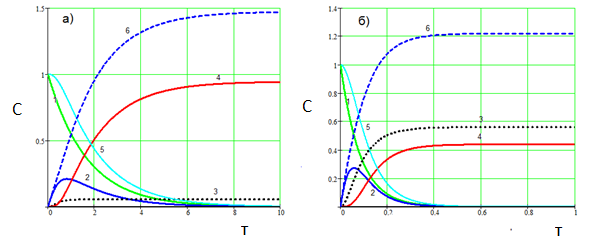
Рис.4. Вплив швидкості СО2 на карбонізацію алюминатного розчину. а) СО2 = 0.1 б) СО2 = 2.0. Температура 80 °С. 1 – Na3[Al(OH)6], 2 – Na[Al(OH)4], 3 - Na3[Al(OH)2CO3], 4 - Al(OH)3, 5 – суммарная концентрация Al3+ в растворе, 6 – Na2CO3. (k01=1∙103, E1=15000; k02=2∙106, E2=36000; k03=2∙103, E2=14000; k4=4)
Як видно з рис.3, температура карбонізації істотно впливає на співвідношення (гідроксид алюмінію) : (алюмокарбонат натрію). З підвищенням температури частка алюмокарбоната натрію істотно зростає. З підвищенням швидкості пропускання СО2 кількість одержуваного Na3[Al(OH)2CO3] може перевищити кількість Al(OH)3 (рис. 4, б). В той же час (рис.4), зменшення швидкості подачі СО2 дозволяє виділяти з алюминатного розчину переважно гідроксид алюмінію навіть при високій температурі (рис.4, а).
Розрахункові криві вплив температури на утворення гідроксиду алюмінію і гидроалюмокарбоната (рис.5) натрію ідентичні кривою, побудованою на основі експериментальних даних [4] та представлені на рис.2.
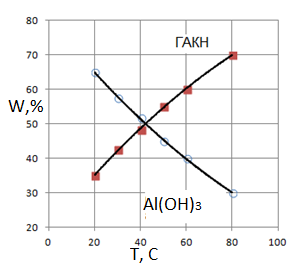
Рис.5. Розрахункові криві вплив температури на утворення гідроксиду алюмінію і гидроалюмокарбонату натрія. СО2=1.5. (k01=1∙103, E1=15000; k02=2∙106, E2=36000; k03=2∙103, E2=14000; k4=4)
Висновок
Таким чином запропонована схема хімічних реакцій дозволяє принципово змінити організацію технологічного процесу карбонізації алюмінатних розчинів. Замість важко контрольованою однієї стадії карбонізації всього алюминатного розчину, що надходить з відділення вилуговування, одержання гідроксиду алюмінію можна здійснювати в дві добре контрольовані стадії. Для цього розчин після вилуговування глинозему слід розділити на дві частини. Першу частину розчину необхідно карбонизовать до повного виділення алюмінію у вигляді осаду гидроалюмокарбоната натрію. Після відділення осад змішується з другою частиною алюминатного розчину і в результаті реакції (12) перетворюється на гідроксид алюмінію. Утворюється содовий розчин надходить на вилуговування спека.
Перелік посилань
1. Лайнер, А. И. Производство глинозема / А. И. Лайнер, Н. И. Еремин, Ю. А. Лайнер. М.: Металлургия, 1978. 420 с.
2. Мазель, В. А. Производство глинозема / В.А. Мазель. - М.: Металлургиздат, 1955. - 430 с.
3. Клименко А.А. О возможности получения глинозема из отходов угле- и горнодобывающей промышленности методом спекания бесщелочного сырья с известняком / В.Н. Вечерко, Л.И. Кукоба, В.В. Шаповалов, В.И. Ванин // Наукові праці ДонНТУ. Серія: Хімія і хімічна технологія. 2012. Вип. 19(199). С. 151-157.
4. Патент 2197429 (РФ) C01F7/38, C01F7/14 Способ переработки алюминийсодержащего сырья / Липин В.А., Шмаргуненко А.Н., Беликов Е.А., Кузнецов А.А., Лазарев В.Г., Макаров С.Н 14.11.2000 (43). Дата публикации заявки: 27.09.2002 (45). Опубликовано: 27.01.2003.
5. Ханамирова, А. А. Глинозем и пути уменьшения содержания в нем примесей / А. А. Ханамирова / Отв. ред. И.З. Певзнер. Ереван: Изд-во АН АрмССР, 1983. 243 с
6. Томилов Н.П. Об условиях образования гидроалюмокарбонатов при взаимодействии алюминия с растворами карбонатов щелочных металлов / Н.П. Томилов, А.С. Бергер, А.И. Бойкова // Ж. нерган. химии. 1969. Т. 14, № 3. С. 674-680.
7. Абрамов, В. Я. Физико-химические основы комплексной переработки алюминиевого сырья / В.Я. Абрамов, И.В. Николаев, Г.Д. Стельмакова. - М.: Металлургия, 1985. - 288 с.
