Реферат за темою випускної роботи
Зміст
- Вступ
- 1. Актуальність теми
- 2. Мета і задачі дослідження та заплановані результати
- 3. Літературний огляд публікацій щодо розчинності діоксиду вуглецю в органічних абсорбентах
- 3.1 Сучасний стан вивчення розчинності діоксиду вуглецю в органічних абсорбентах
- 3.2 Методи досліджень розчинності діоксиду вуглецю при підвищеному тиску
- 4. Методика проведення вимірювань розчинності діоксиду вуглецю в органічних абсорбентах при підвищеному тиску
- 4.1 Підготування реактивів для проведення дослідження
- 4.2 Опис установки та методика дослідження
- 4.3 Можливі похибки при вимірюванні параметрів фазових рівноваг з використанням описаної установки
- Висновки
- Перелік посилань
Вступ
Природний газ, що видобувається з родовищ, містить у своєму складі значну кількість домішок, основними з яких є діоксид вуглецю, сірководень, меркаптани, вода та інші. Вміст цих домішок може бути доволі значним; так, для газу Астраханського родовища вміст діоксиду вуглецю досягає 26%, а сірководню 16% [1]. При цьому Астраханське родовище є найбільшим у Європі родовищем, що розробляється.
При транспортуванні природного газу, який містить водяні пари, можливо утворення газових гідратів усередині трубопроводу, що є неприпустимим. Окрім цього, звільнення газу від небажаних домішок дозволяє зменшити витрати на транспортування та знизити коррозійну дію його на комунікації.
Переважна кількість технологічних газів у хімічній технології мають у своєму складі діоксид вуглецю, водяні пари та сірководень, наприклад, при виробництві синтез-газу для одержання аміаку методом високотемпературної конверсії природного газу, вміст діоксиду вуглецю після стадії конверсії оксиду вуглецю досягає 23–24% [2]. Оскільки домішки у синтез-газі призводять до зниження концентрації основного компоненту, корозії апаратури, отруєння каталізатора, необхідно їх видалення.
У зв'язку з великими об'ємами природного та технологічних газів, що використовуються у хімічній промисловості, економічно доцільним є очищення їх від діоксиду вуглецю, сірководню та водяних парів фізичною абсорбцією останніх органічними абсорбентами. При цьому поглинальна здатність абсорбенту сильно збільшується з підвищенням парціального тиску компонента газової суміші, який видаляється. Для регенерації насиченого абсорбенту від більшої частини леткого компоненту, що був поглинутий, достатньо скинути тиск. Як абсорбенти вологи знаходять широке використання діетиленгліколь (ДЕГ) та триетиленгліколь (ТЕГ). У зв'язку з високою в'язкістю гліколей при низьких температурах доцільним є додавання іншого компонента до складу абсорбента з метою зменшення його в’язкості. Таким компонентом, зокрема, може виступати N-метилпірролідон (N-МП), який має невисоку в’язкість та добре поглинає вологу. Суміші ДЕГ з N-МП можна використовувати для осушення природного газу при температурах до –20°C, що суттєво підвищує якість осушеного газу. При цьому з газу видаляються такі небажані компоненти, як сірководень, меркаптани та діоксид вуглецю.
Для проектування установок та створення технологічних схем очищення газів від діоксиду вуглецю органічним абсорбентом необхідна інформація щодо параметрів рівноваги рідина-пара системи діоксид вуглецю – абсорбент при високому тиску, а також знання діаграми стану цієї системи. Оскільки такі дані у науковій літературі відсутні, виникає необхідність експериментального визначення розчинності діоксиду вуглецю в суміші ДЕГ – N-МП в умовах підвищеного тиску.
1. Актуальність теми
Існуючі методи очищення газів від домішок не є досконалими. У даний час переважно використовуються методи хімічної абсорбції, які дають змогу провести глибоке очищення газів від домішок. При великих об'ємах газів, що очищуються, а також високому вмісту домішок у їх складі хімічна абсорбція є дуже затратною, більш економічно доцільним є використання для очищення явища фізичної абсорбції. Це дасть можливість вдешевити процес очищення та підвищити його ефективність.
2. Мета і задачі дослідження та заплановані результати
Об'єкт дослідження: система діоксид вуглецю – діетиленгліколь – N-метілпірролідон
Метою дослідження є розробка технологічної схеми очищення газових сумішей від діоксиду вуглецю органічним абсорбентом на основі визначення розчинності діоксиду вуглецю в абсорбенті ДЕГ – N-МП при підвищеному тиску
Основні задачі дослідження:
- Визначення розчинності діоксиду вуглецю в абсорбенті ДЕГ – N-МП.
- Розрахунок термодинамічних параметрів розчинення діоксиду вуглецю в даному абсорбенті.
- Розробка технологічної схеми очищення газів від діоксиду вуглецю, визначення оптимальних параметрів роботи схеми.
В рамках магістерської роботи плануються наступні актуальні наукові результати:
- Дані з розчинності діоксиду вуглецю в абсорбенті ДЕГ – N-МП з різним співвідношенням компонентів.
- Основні термодинамічні параметри розчинення діоксиду вуглецю в даній системі
- Діаграма рівноваги рідина-пара в системі діоксид вуглецю – ДЕГ – N-МП.
- Основні параметри очистки газових сумішей від діоксиду вуглецю, сірководню та парів води з використанням абсорбенту ДЕГ – N-МП.
3. Літературний огляд публікацій щодо розчинності діоксиду вуглецю в органічних абсорбентах
3.1 Сучасний стан вивчення розчинності діоксиду вуглецю в органічних абсорбентах
За останні кілька десятиріч в наукових виданнях спостерігається тенденція до збільшення кількості опублікованих робіт, що присвячені дослідженню систем рідина-газ, які містять у своєму складі діоксид вуглецю. Наприклад, з усіх досліджених за останні 5 років двокомпонентних систем рідина-газ при підвищеному тиску 54% містять діоксид вуглецю як один із компонентів, для трьохкомпонентних систем цей показник ще вищий – 66% [3].
Така кількість досліджень пов’язана з тим, що область використання діоксиду вуглецю безперервно поширюється. Він знаходить використання, головним чином, як надкритичний розчинник для екстракції різноманітних органічних сполук. У цій якості діоксид вуглецю має такі переваги перед іншими надкритичними розчинниками: дешевизна, нетоксичність, негорючість, легкість отримання у чистому вигляді, низька критична температура (це запобігає розкладанню речовин, що екстрагуються), та простота виділення компоненту з розчину шляхом скидання тиску та випарування діоксиду вуглецю.
N-метилпірролідон є високоефективним абсорбентом для очищення від діоксиду вуглецю конвертованого газу у виробництві водню методом парокисневої конверсії вуглеводнів під тиском, а також газу, що виробляється конверсією метана в трубчатих печах. Після конверсії оксиду вуглецю газ стискається до 7,6–13,7 МПа, та підвергається очищенню N-МП [4]. З переваг N-МП слід відмітити повну відсутність агресивних властивостей, нетоксичність та легке біологічне розкладання у випадку потрапляння до стічних вод [5].
Нижче наведені основні фізико-хімічні властивості N-МП [6]:
Таблиця 1 – Основні фізико-хімічні властивості N-МП
| Емпірична формула | C5H9ON |
| Молекулярна маса, г/моль | 99,13 |
| Температура кипіння, °С | 205 |
| Температура плавління, °С | –24,2 |
| Густина при 20°С, г/см³ | 1,033 |
| Показник заломлення n20 | 1,4709 |
| В'язкість при 20°С, мПа⋅с | 1,9 |
| Тиск насичених парів при 40,5°С, мм. рт. ст. | 1,0 |
Діетиленгліколь – безбарвна або жовтувато-прозора рідина. Основні фізико-хімічні властивості його приведені нижче [7]:
Таблиця 2 – Основні фізико-хімічні властивості ДЕГ
| Емпірична формула | C4H8O(ОН)2 |
| Молекулярна маса, г/моль | 106,12 |
| Температура кипіння, °С | 244,8 |
| Температура плавління, °С | –7,8 |
| Густина при 20°С, г/см³ | 1,1161 |
| Показник заломлення n20 | 1,4472 |
| В'язкість при 20°С, мПа⋅с | 35,7 |
| Тиск насичених парів при 20°С, Па | <1,3 |
Розчинність діоксиду вуглецю в діетиленгліколі в залежності від температури при тиску 1,5,10,20 атм приведена в роботі [8]. Ізотерми розчинності діоксиду вуглецю в діетиленгліколі приведені на рисунку 1 [9].
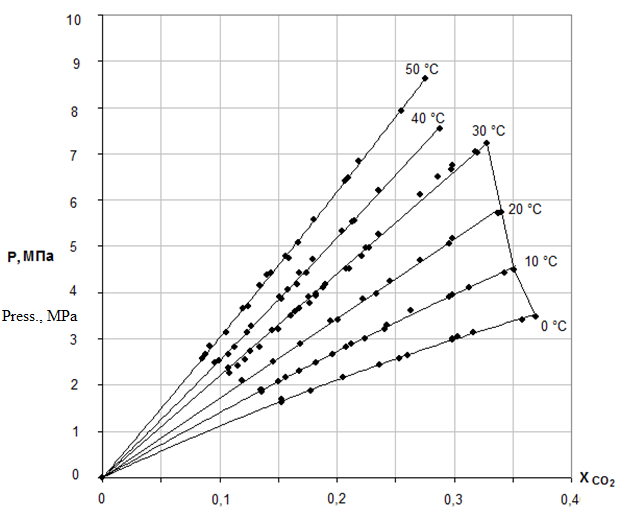
Рисунок 1 – Ізотерми розчинності діоксиду вуглецю в ДЕГ
Системи рідина-газ, що містять у якості одного з компонентів діоксид вуглецю, а другим ДЕГ або N-МП, досліджені у роботах [3,10-14]. У цих роботах проводиться вивчення розчинності діоксиду вуглецю в одно-, двох- та мультикомпонентних органічних розчинниках. При цьому лише відносно невелика кількість робіт присвячена дослідженню систем з цікавими для нас органічними сорбентами – ДЕГ, ТЕГ, N-МП. Дані, що є у науковій періодиці, часто далеко не повні. У наукових виданнях для цих систем дані щодо розчинності отримані лише для невеликого діапазону температур та тиску. Так, у роботі [12] діапазон зміни температури складав 298–398 К, діапазон зміни тиску 0–21,1 МПа. У роботі [13] температура змінювалась від 298 до 318 К, тиск змінювався від 0,9 до 8,4 МПа. У роботі [15] вимірювання проводились при температурі 313 К та діапазоні тиску від 0,72 до 7,78 МПа. Треба відзначити, що дані окремих робіт суттєво розходяться між собою. Також у роботі [16] була досліджена система діоксид вуглецю – ДЕГ – γ-БЛ. γ-БЛ та N-МП східні за своєю структурою та фізико-хімічними властивостям, тому слід очікувати аналогічної фазової поведінки системи діоксид вуглецю – ДЕГ – N-МП. Усе вищезазначене є підставою для узагальнення та систематизації наявної інформації.
3.2 Методи досліджень розчинності діоксиду вуглецю при підвищеному тиску
Методи дослідження фазових рівноваг можна розділити на дві великі групи: аналітичні та синтетичні [17]. Основною відмінністю цих методів є спосіб, у який визначається склад фаз, що знаходяться у рівновазі. У аналітичних методах досліджень проводиться відбір частини фази системи та аналіз проби методами аналітичної хімії. У синтетичних методах склад фаз визначають шляхом непрямих вимірювань в системі заданого складу.
Як приклад синтетичного методу досліджень фазової рівноваги в системі рідина-газ можна привести роботу [15]. Установка для досліджень, що використовувалась в цій роботі, приведена на рисунку 2.
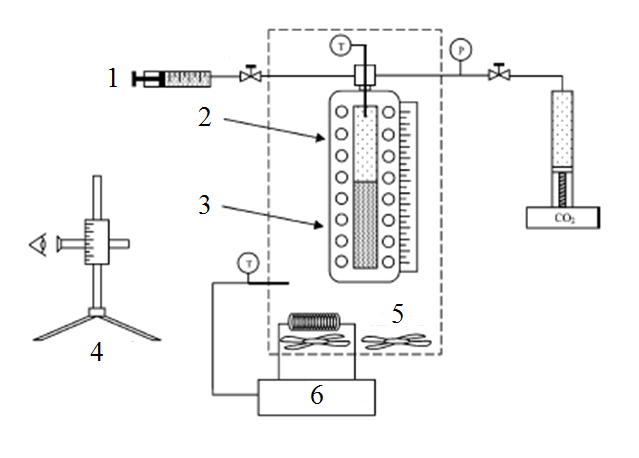
Рисунок 2 – Установка для дослідження фазової рівноваги синтетичним методом
1 – рідкі компоненти, 2 – парова фаза, 3 – рідка фаза, 4 – катетометр, 5 – повітряний термостат,
6 – температурний контролер
Робочий об’єм комірки рівноваги дорівнює 150 см³, вимірювання його проводилось шляхом додавання до комірки відомого об’єму діоксиду вуглецю при постійній температурі та вимірюванням отриманого сумарного об’єму. Калібровка комірки проводилась по воді, висоти фаз вимірювалися за допомогою катетометру. Комірка рівноваги розміщувалась у повітряній вані, що виконувала роль термостату. Температура вимірювалась за допомогою термопари, тиск – за допомогою перетворювача тиску та цифрового вторинного приладу. Комірка рівноваги розташовувалась на рухомому штативі, перемішування вмісту проводилось за допомогою обертання комірки.
Спочатку до комірки рівноваги завантажувався малолеткий компонент, об’єм якого визначався катетометром за допомогою рівняння калібровки. Діоксид вуглецю додавався до комірки з балону. При цьому температура була постійною, після встановлення рівноваги вимірювався тиск системи та висоти стовпчиків фаз за допомогою катетометра. Час досягнення рівноваги досягав 5 хвилин.
Оскільки у синтетичних методах досліджень не здійснюється відбір проб, то склад системи залишається незмінним. Ця методика має такі недоліки: складність установки, великий об’єм комірки рівноваги, що потребує значної кількості реагентів, для кожного завантаження комірки можливо проведення тільки одного вимірювання при заданій температурі.
Синтетичний метод вимірювань був також використаний у роботі [18]. Схема установки наведена на рисунку 3.
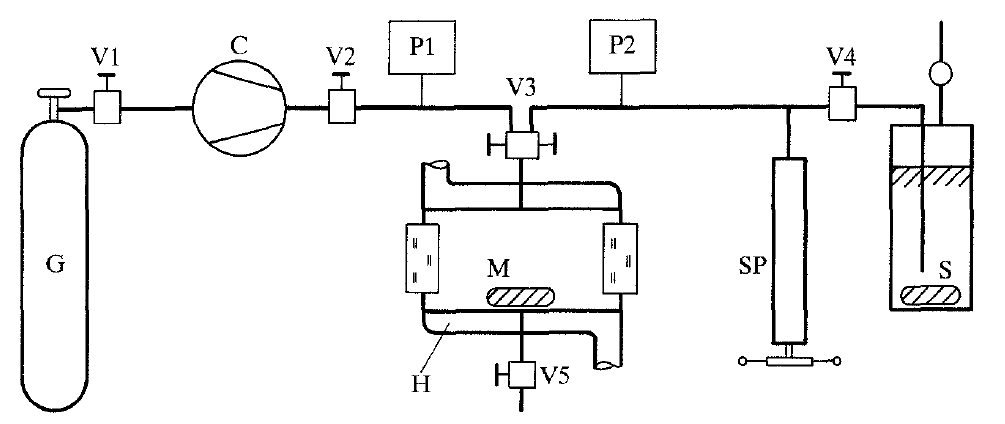
Рисунок 3 – Установка для дослідження фазової рівноваги синтетичним методом
G – ємність для газу, С – діафрагмовий компресор, М – комірка рівноваги, Н – термостат, SP – шприцевий
прес, S – ємність з метанолом
Головною частиною установки є комірка рівноваги. У експерименті використовувалися дві комірки: ємністю 30 см³ з робочим тиском до 200 МПа та 110 см³ з робочим тиском до 70 МПа. Температура у комірці підтримувалась за допомогою термостату. Діафрагмовий компресор слугував для подачі чистого діоксиду вуглецю до комірки. Маса газу, який подавався, розраховувалась через вимірювання об’єму для відомих тиску та температури та відомого об’єму комірки після встановлення рівноваги. Об’єм вимірювався за допомогою шприцевого пресу, приводився до постійного тиску у 7 МПа, та по відомій за цих умов густині вимірювалась маса діоксиду вуглецю. Метанол додавався за допомогою шприцевого пресу при постійній температурі. Вимірювання проводилось наступним чином: метанол додавався до комірки до тих пір, доки не зникав останній пухирець газової фази, та вимірювався тиск, при якому це відбувалося. Таким чином, маси компонентів відомі, отримано значення тиску зникнення останнього пухирця газової фази. Щільність системи обчислена по відомому об’єму комірки рівноваги. За цими даними проводилося обчислення розчинності діоксиду вуглецю в метанолі. Загальна похибка вимірювання тиску не перевищувала 0,2% тиску, який вимірювався. Максимальна похибка вимірювання температури досягала 0,5 К.
Основними перевагами аналітичного методу досліджень є можливість визначати склад рівноважних фаз методами аналітичної хімії. При цьому метод має наступні недоліки: складність апаратурного оформлення, необхідність значної кількості реагентів, досить великий час встановлення рівноваги, і як наслідок цього, значні витрати часу на вимірювання. Взяття проби на аналіз впливає на стан всієї системи, що призводить до похибок при визначенні складу проби, який може відрізнятися від складу всієї системи. Внаслідок цього при однаковій похибці в одержуваних експериментальних даних більш привабливими є синтетичні методи дослідження фазових рівноваг.
Методики, що вказані вище, мають ряд недоліків, які не дають змогу використовувати їх для виконання даної роботи. Тому для досліджень розчинності діоксиду вуглецю в системі ДЕГ – N-МП було обрано методику, яка була використана у роботі [19].
Як вже було сказано, система ДЕГ – N-МП за результатами досліджень рекомендована у якості ефективного низькотемпературного осушувача для природного газу. Це обумовлено високою поглинальною здатністю цієї системи відносно вологи, низькою температурою кристалізації та невеликою в’язкістю її при низьких температурах. Для використання цієї системи у якості абсорбенту діоксиду вуглецю необхідним є визначення розчинності у ній останнього.
4. Методика проведення вимірювань розчинності діоксиду вуглецю в органічних абсорбентах при підвищеному тиску
4.1 Підготування реактивів для проведення дослідження
ДЕГ кваліфікації ч
підвергався перегонці при тиску 0,2–0,4 кПа. Відбиралась середня фракція
дистиляту, запаювалась у скляні ампули та використовувалась для експерименту. Показник заломлення
отриманого ДЕГ n20 = 1,4472 (літературний показник 1,4472 [7]), вміст
води 0,036%.
N-МП кваліфікації технічний переганяли при тиску 0,2–0,4 кПа і для проведення експерименту відбирали середню фракцію, яка запаювалась в скляні ампули. Показник заломлення отриманого N-МП n20 = 1,4701 (літературний показник 1,4709 [6]). Вміст вологи, виміряний по методу Фішера, складав 0,07% мас.
Діоксид вуглецю (вуглекислота харчова), що випускався зі стандартного балону, конденсувався в сталевому балончику ємністю 100 см³ при зануренні останнього у рідкий азот. Після три рази проводився цикл вакуумування – відтаювання – замороження для видалення слідів домішок, які не конденсуються. Діоксид вуглецю, що виходив з балончика, після осушки над плавленим хлоридом кальцію використовувався для завантаження комірки рівноваги.
Чистота діоксиду вуглецю перевірялась за його критичними параметрами: критичній температурі та критичному тиску. У наших дослідах критична температура складала 31,1°С(за літературними даними критична температура складала 31,04–31,1°С, критичний тиск 7,38 МПа співпадав з літературним в межах похибки експерименту [20]).
Перед початком експерименту ампула розкривалась, та визначався показник заломлення абсорбенту. У випадку відповідності його дозагрузочному та літературному значенням реактив використовувався для проведення експерименту.
4.2 Опис установки та методика дослідження
Установка, що використовується для дослідження рівноваги у системах рідина-газ за високого тиску, наведена на рисунку 4.
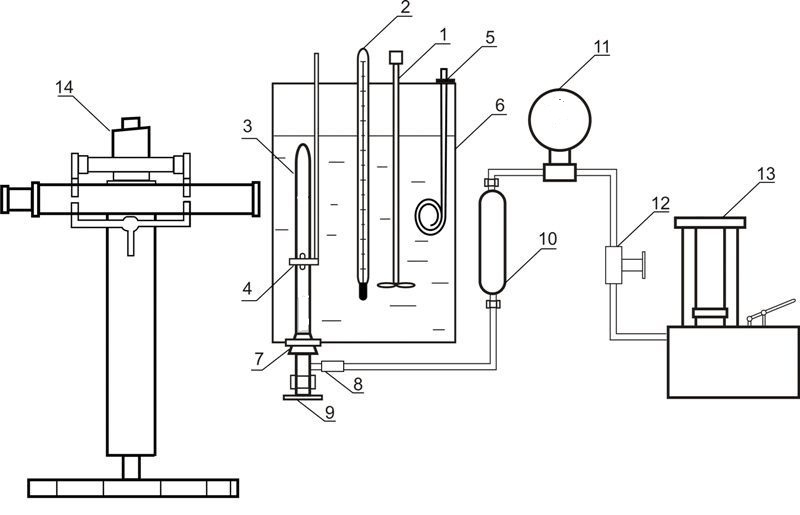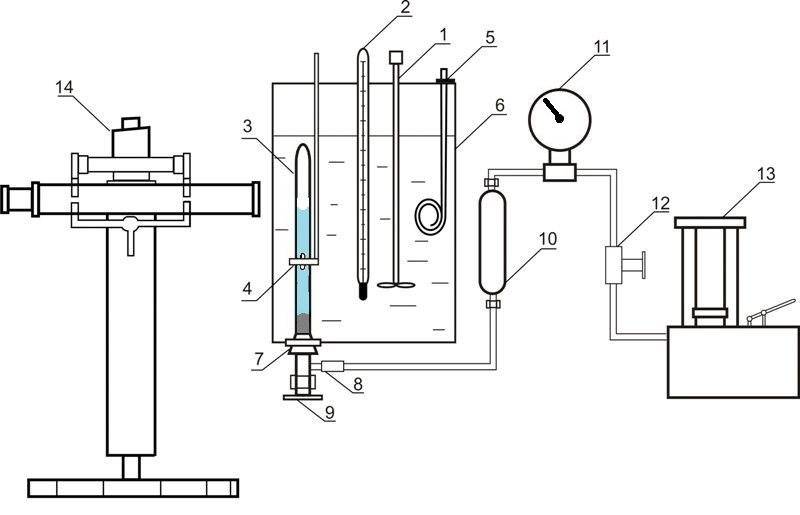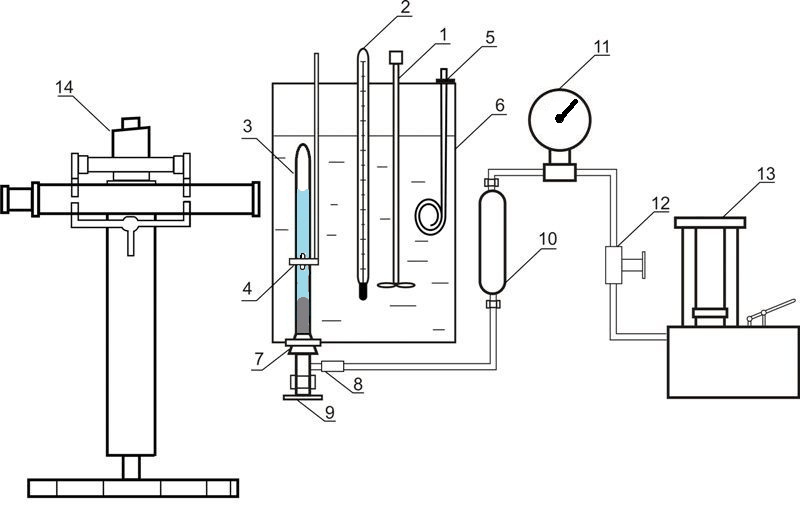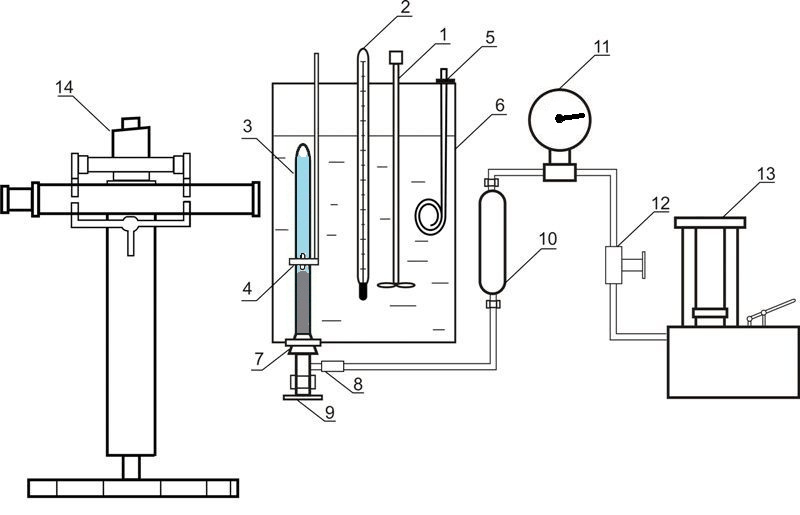
Рисунок 4 – Установка для дослідження рівноваги у системі рідина-газ 1 – мішалка; 2 – термометр; 3 – комірка рівноваги; 4 – магніт; 5 – нагрівач; 6 – термостат; 7 – гумова пробка; 8 – роз'ємне з'єднання; 9 – вентиль; 10 – роздільник масло-ртуть; 11 – зразковий манометр; 12 – вентиль; 13 – масляний прес; 14 – катетометр
До складу установки входить комірка рівноваги з прозорого кварцевого скла 3, вміст якої стискається ртуттю та перемішується за допомогою нікелевої мішалки, що знаходиться всередині комірки. Рух цієї мішалки обумовлений осьовим переміщенням зовнішнього кільцевого магніту 4. Тиск у комірці вимірюється за допомогою зразкового манометру 11, при цьому вводиться поправка на різницю висот стовпчиків ртуті у комірці та у роздільнику 10. Маса комірки складає приблизно 60 г, тому маси компонентів визначаються шляхом зважування на аналітичних терезах. Після загрузки абсорбенту проводиться видалення розчиненого у ньому повітря шляхом вакуумування. Діоксид вуглецю загружається до комірки шляхом наморажування. При цьому комірка занурюється у рідкий азот та до неї подається необхідний об'єм діоксиду вуглецю.
Температура підтримується за допомогою термостату 6 та вимірюється нормальним термометром 2. Вимірювання тиску проводиться зразковим манометром 11. Висота стовпців фаз у комірці вимірюється катетометром В-630.
Для встановлення рівновагі вміст комірки перемішується за допомогою мішалки.
Сама комірка рівноваги наведена на рисунку 5.
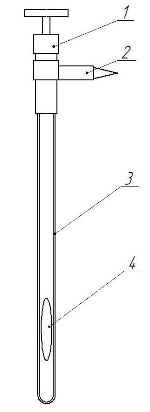
Рисунок 5 – Комірка рівноваги
1 – вентиль; 2 – роз’ємне конусне з’єднання; 3 – ампула комірки; 4 – мішалка
Перед тим, як використувати комірку для досліджень фазової рівноваги, необхідно провести її калібровку. Калібровка проводиться по дистильованій воді, з якої попередньо видаленні розчинені гази. Видалення газів проводиться шляхом кип’ятіння води, та охолодження її до кімнатної температури без доступу повітря. Проведення калібровки дає змогу отримати рівняння, що описує залежність об’єму по висоті комірки.
Комірка вакуумується і зважується на аналітичних вагах. Потім з вентиля вигвинчується шпилька і за допомогою медичного шприца завантажується суміш розчинників. Угвинчується шпилька, розчин заморожується шляхом поміщення комірки в рідкий азот і комірка вакуумується. Коли вона від'єднується від вакуумної лінії, розчинник плавиться. Далі комірка знову занурюється в рідкий азот та вакуумується. Для повного видалення розчиненого в рідині повітря потрібно повторення цієї операції 5-6 разів. Комірка з розчинником, який було вивільнено від повітря зважується і по різниці мас завантаженої і порожньої комірки визначається його маса.
Після додавання розчинника, за допомогою конусного з'єднання комірка приєднується до судини визначеного об'єму, у якому знаходиться досліджуваний газ – діоксид вуглецю. Зі з'єднувальної лінії видаляється повітря, після відкривання комірки і занурення її в рідкий азот наморожується газ. Комірка закривається, отеплюється і зважується.
Завантажена комірка рівноваги за допомогою гумової пробки вставляється в термостат 6 знизу і приєднується за допомогою конусного з'єднання 8 до роздільника масло-ртуть 10. Капіляр верхньої частини роздільника від'єднується від масляної лінії та приєднується через розділову ємність до форвакуумного масляного насоса. Відбувається видалення повітря зі з'єднуючих ліній. Після від'єднання вакуумного насосу ртуть заповнює лінію від роздільника 10 до сідла вентиля 9. Роздільник масло-ртуть приєднується до масляної лінії конусним з'єднанням і за допомогою масляного преса 13 створюється тиск.
Перед відкриттям вентиля комірки, в установці необхідно створити тиск, який вище рівноважного тиску на деяку величину. Інакше, при недостатньому тиску в установці, газова фаза здатна виштовхнути з комірки замикаючу рідину – ртуть, що також приведе до втрати частини досліджуваної речовини. Потім відкривається вентиль і ртуть надходить в комірку, стискаючи досліджувану систему. У термостаті встановлюється необхідна температура і при встановленому значенні тиску робиться енергійне перемішування вмісту комірки мішалкою, що приводиться у рух кільцевим магнітом, до встановлення рівноваги. Для цього потрібно близько 40-50 перемішувань. Для забезпечення достатньої точності вимірювань при кожному зміненні тиску для встановлення рівноваги проводили близько 100 перемішувань. Після встановлення рівноваги за допомогою катетометра визначають висоту рідкої фази розчиннику в комірці 3. Після проведення вимірів при даному тиску система стискується і проводиться експеримент при новому значенні тиску. Одержують інформацію про поводження рідкої фази при встановленій температурі в широкому інтервалі тисків. Потім змінюється температура термостата і знову проводиться експеримент. Таким чином, при одному завантаженні комірки можна одержати інформацію в широкому інтервалі температур і тисків.
4.3 Можливі похибки при вимірюванні параметрів фазових рівноваг з використанням описаної установки
Похибки вимірювання параметрів при дослідженні рівноваги рідина-газ в установці з ртутним поршнем наведені в таблиці 3.
Таблиця 3 – Можливі похибки вимірювання на установці з ртутним поршнем
| Параметр, що вимірюється | Діапазон вимірювання | Похибка вимірювання (абс.) | Похибка вимірювання (відн.) |
| Тиск | 10–90 бар | 0,4 атм | 0,4% |
| Температура | 273,2–323,2 К | 0,02 К | 0,005% |
| Висота стовбчиків фаз | 0,05–0,150 м | 0,0015 м | 0,05% |
| Маса компонентів | 0,2–1,5 г | 0,0002 г | 0,1% |
Висновки
У рамках роботи була досліджена розчинність діоксиду вуглецю в органічній абсорбенті складу 47,1% мол. ДЕГ, 52,9% мол. N-МП в температурному діапазоні 0-50°C і тиску до 9 МПа. Також були визначені теплоти розчинення діоксиду вуглецю в абсорбенту даного складу. Результати досліджень показали високу поглотительну здатність даного абсорбенту по відношенню до діоксиду вуглецю. Дослідження, проведені раніше, показали високу поглинальну здатність даного абсорбенту також по відношенню до сірководню і водяних парів. Таким чином, досліджений абсорбент придатний для комплексного очищення газів від найбільш поширених домішок.
На основі вищесказаного доцільною є розробка високоефективного методу очищення газових сумішей від діоксиду вуглецю, заснованого на явищі фізичної абсорбції останнього даним абсорбентом.
Подальші дослідження направлені на наступні аспекти:
- Визначення розчинності діоксиду вуглецю в органічних абсорбентах різного складу.
- Побудова діаграми стану рідина-пара для системи діоксид вуглецю – ДЕГ – N-МП.
- Розробка технологічної схеми очищення газів від діоксиду вуглецю органічним абсорбентом.
При написанні даного реферату магістерська робота ще не завершена. Остаточне завершення: грудень 2013 року. Повний текст роботи та матеріали по темі можуть бути отримані у автора або його керівника після вказаної дати.
Перелік посилань
- Тер-Саркисов Р.М. Разработка месторождений природных газов. – М.: ОАО Издательство
Недра
, 1999. – 659 с.: ил. - Семенова Т.А., Лейтес И.Л. и др. Очистка технологических газов. – М.:
Химия
, 1969. – 392 с. - High-pressure fluid-phase equilibria: Experimental methods and systems investigated (2005–2008) / Jose M.S. Fonseca, Ralf Dohrn, Stephanie Peper // Fluid Phase Equilibria 300 (2011) 1–69.
- Hochgesand G. Rectisol and Purisol / Hochgesand G. // Ind. and Eng. Chem. – 1970. –V.62. – No 7. – P. 37–43.
- Коуль А.Л., Ризенфельд Ф.С. Очистка газа – М.: Недра, 1968. – 411 с.
- Краткая химическая энциклопедия. ред. кол. И.Л. Кнунянц (отв. ред.) и др., – М.:
Большая российская энциклопедия
, 1992. – Т. 3, Мед – Полимерные. – 639 с. - Краткая химическая энциклопедия. ред. кол. И.Л. Кнунянц (отв. ред.) и др., – М.:
Большая российская энциклопедия
, 1990. – Т. 2, Даффа – Мед. – 671 с. - Мурин В.И. Технология переработки природного газа и конденсата. Т 38, Ч.1 – М.: ООО
Недра-Бизнесцентр
, 2002 – 517 с. - Равновесие жидкость – пар в системе диоксид углерода – диэтиленгликоль / Матвиенко В.Г., Нифантова Л.С. // Наукові праці Донецького національного технічного університету. Серія: хімія і хімічна технологія. Випуск 144 (12). Донецьк - 2009. С. 67 – 74.
- High-pressure fluid-phase equilibria: Experimental methods and systems investigated (2000–2004) / Ralf Dohrn, Stephanie Peper, Jose M.S. Fonseca // Fluid Phase Equilibria 288 (2010) 1–54.
- High-pressure fluid phase equilibria: Experimental methods and systems investigated (1994–1999) / M. Christov, R. Dohrn // Fluid Phase Equilibria 202 (2002) 153–218.
- Solubility of H2S and CO2 in diethylene glycol at elevated pressures / F.Y. Jou, F.D. Otto, A.E. Mather // Fluid Phase Equilibr. 175 (2000) 53–61.
- Solubility of carbon dioxide in dimethylsulfoxide and N-methyl-2-pyrrolidone at elevated pressure / R. Rajasingam, L. Lioe, Q.T. Pham, F.P. Lucien // J. Supercrit. Fluids 31 (2004) 227–234.
- Experimental setup to measure critical properties of pure and binary mixtures and their densities at different pressures and temperatures. Determination of the precision and uncertainty in the results / Laura Gil, Santos F. Otin, Jose Munoz Embid, M. Asuncion Gallardo, Sofia Blanco, Manuela Artal, Inmaculada Velasco // J. of Supercritical Fluids 44 (2008) 123–138.
- High-Pressure Vapor-Liquid Equilbria of Some Carbon Dioxide + Organic Binary Systems / Michael J. Lazzaroni, David Bush, James S. Brown, and Charles A. Eckert // J. Chem. Eng. Data 2005, 50, 60-65.
- Флюидные фазовые равновесия в системе диоксид углерода-диэтиленгликоль-γ-бутиролактон при повышенных давлениях / В.Г. Матвиенко, Л.С. Нифантова, Н.Ю. Траховцов, В.В. Кулик // Наукові праці Донецького національного технічного університету. Серія: хімія і хімічна технологія. Випуск 19 (199). Донецьк – 2012. С. 40.
- Циклис Д.С. Техника физико-химических исследований при высоких и сверхвысоких давлениях – М.: Химия, 1976. – 432 с.
- Isothermal phase equilibria in binary mixtures consisting of (methanol + hydrogen or nitrogen or methane or carbon monoxide or carbon dioxide) / E. Brunner, W. Hultenschmidt, and G. Schlichtharle // J. Chem. Thermodinamics 1987, 19, 213-291.
- Растворимость аргона в бензоле и гексане при повышенных давлениях / Матвиенко В.Г., Ярым-Агаев Н.Л., Грознер Ю.Л. // ЖПХ. – 1995. – Т.68. – № 2. – С. 198–202.
- Алтунин В.В. Теплофизические свойства двуокиси углерода – М.: Издательство стандартов, 1975. – 546 с.
