Реферат по теме выпускной работы
Содержание
- Введение
- 1. Актуальность темы
- 2. Цель и задачи исследования, планируемые результаты
- 3. Литературный обзор публикаций, посвященных растворимости диоксида углерода в органических абсорбентах
- 3.1 Современное состояние изучения растворимости диоксида углерода в органических абсорбентах
- 3.2 Методы исследования растворимости диоксида углерода при повышенных давлениях
- 4. Методика проведения измерений растворимости диоксида углерода в органических абсорбентах при повышенных давлениях
- 4.1 Подготовка реактивов для проведения исследования
- 4.2 Описание установки и методика исследования
- 4.3 Возможные погрешности при измерении параметров фазових равновесий с использованием описанной установки
- Выводы
- Список использованных источников
Введение
Природный газ, добываемый из месторождений, содержит в своем составе значительное количество примесей, основными из которых являются диоксид углерода, сероводород, меркаптаны, вода и др. Содержание этих примесей может быть довольно значительным: так, для газа Астраханского месторождения содержание диоксида углерода достигает 26%, а сероводорода 16% [1]. При этом Астраханское месторождение является наибольшим разрабатываемым месторождением в Европе.
При транспортировке природного газа, содержащего водяные пары, возможно образование газовых гидратов внутри трубопровода, что недопустимо. Кроме того, освобождение газа от нежелательных примесей позволяет уменьшить затраты на транспортирование и снизить коррозионное воздействие его на коммуникации.
Большинство технологических газов, применяемых в химической технологии, содержат в своем составе диоксид углерода, водяные пары и сероводород, например, при производстве синтез-газа для получения аммиака методом высокотемпературной конверсии природного газа, содержание диоксида углерода после стадии конверсии оксида углерода достигает 23-24% [2]. Поскольку примеси в синтез-газе приводят к снижению концентрации основного компонента, коррозии аппаратуры, отравлению катализатора, необходимо их удаление.
В связи с большими объемами природного и технологических газов, используемых в химической промышленности, экономически целесообразной является очистка их от диоксида углерода, сероводорода и водяных паров физической абсорбцией последних органическими абсорбентами. При этом поглотительная способность абсорбента сильно увеличивается с повышением парциального давления удаляемого компонента газовой смеси. Для регенерации насищенного абсорбента от большей части поглощенного летучего компонента, достаточно сброса давления. Как абсорбенты влаги широко применяются диэтиленгликоль (ДЭГ) и триэтиленгликоль (ТЭГ). В связи с высокой вязкостью гликолей при низких температурах целесообразно добавление другого компонента в состав абсорбента с целью снижения его вязкости. Таким компонентом, в частности, может выступать N-метилпирролидон (N-МП), который имеет невысокую вязкость и хорошо поглощает влагу. Смеси ДЭГ с N-МП можно использовать для осушения природного газа при температурах до –20°C, что существенно повышает качество осушенного газа. При этом из газа удаляются такие нежелательные компоненты, как сероводород, меркаптаны и диоксид углерода.
Для проектирования установок и создания технологических схем очистки газов от диоксида углерода органическим абсорбентом необходимы данные по параметрам равновесия жидкость-пар в системе диоксид углерода - абсорбент при высоких давлениях, а также знание диаграммы состояния этой системы. Поскольку эти данные в научной литературе отстутствуют, возникает необходимость экспериментального определения растворимости диоксида углерода в абсорбенте ДЭГ – N-МП в условиях повышенного давления.
1. Актуальность темы
Существующие методы очистки газов от примесей являются несовершенными. В настоящее время преимущественно используются методы химической абсорбции, которые дают возможность провести глубокую очистку газов от примесей. При больших объемах очищаемых газов и высоком содержании примесей в их составе химическая абсорбция очень затратна, более экономически целесообразным является применение для очистки явления физической абсорбции. Это даст возможность удешевить процесс очистки и повысить его эффективность.
2. Цель и задачи исследования, планируемые результаты
Объект исследования: система диоксид углерода – диэтиленгликоль – N-метилпирролидон
Целью исследования является разработка технологической схемы очистки газовых смесей от диоксида углерода органическим абсорбентом на основе определения растворимости диоксида углерода в абсорбенте ДЭГ – N-МП при повышенных давлениях.
Основные задачи исследования:
- Определение растворимости диоксида углерода в абсорбенте ДЭГ – N-МП.
- Расчет термодинамических параметров растворения диоксида углерода в данном абсорбенте.
- Разработка технологической схемы очистки газов от диоксида углерода, определение оптимальных параметров работы схемы.
В рамках магистерской работы планируются следующие актуальные научные результаты:
- Данные по растворимости диоксида углерода в абсорбенте ДЭГ – N-МП с различными соотношениями компонентов.
- Основные термодинамические параметры растворения диксида углерода в данном абсорбенте.
- Диаграмма равновесия жидкость-пар в системе диоксид углерода – ДЭГ – N-МП.
- Основные параметры очистки газовых смесей от диоксида углерода, сероводорода и водяных паров с использованием абсорбента ДЭГ – N-МП.
3. Литературный обзор публикаций, посвященных растворимости диоксида углерода в органических абсорбентах
3.1 Современное состояние изучения растворимости диоксида углерода в органических абсорбентах
За последние несколько десятилетий в научных изданиях наблюдается тенденция к увеличению количества опубликованных работ, посвященных исследованию систем жидкость-газ, содержат диоксид углерода. Например, из из всех исследованных за последние 5 лет двухкомпонентных систем жидкость-газ при повышенном давлении, 54% содержали диоксид углерода в качестве одного из компонентов, для трехкомпонентных систем этот показатель еще выше – 66% [3].
Такое количество исследований связано с тем, что область применения диоксида углерода непрерывно расширяется. Он используется, главным образом, как надкритический растворитель для экстракции различных органических соединений. В этом качестве диоксид углерода имеет следующие преимущества перед другими надкритичными растворителями: дешевизна, нетоксичность, негорючесть, простота получения в чистом виде, низкая критическая температура (что предотвращает разложение экстрагируемых веществ) и простота выделения компонента из раствора путем сброса давления и испарения диоксида углерода.
N-метилпирролидон является высокоэффективным абсорбентом для очистки от диоксида углерода конвертированного газа в производстве водорода методом парокислородной конверсии углеводородов под давлением, а также газа, производимого конверсией метана в трубчатых печах. После конверсии оксида углерода газ сжимается до 7,6-13,7 МПа и подвергается очистке N-МП [4]. Из преимуществ N-МП следует отметить полное отсутствие агрессивных свойств, нетоксичность и легкое биологическое разложение в случае попадания в сточные воды [5].
Ниже приведены основные физико-химические свойства N-МП [6]:
Таблица 1 – Основные физико-химические свойства N-МП
| Эмпирическая формула | C5H9ON |
| Молекулярная масса, г/моль | 99,13 |
| Температура кипения, °С | 205 |
| Температура плавления, °С | –24,2 |
| Плотность при 20°С, г/см³ | 1,033 |
| Показатель преломления n20 | 1,4709 |
| Вязкость при 20°С, мПа⋅с | 1,9 |
| Давление насыщенных паров при 40,5°С, мм. рт. ст. | 1,0 |
Диэтиленгликоль – бесцветная или желтовато-прозрачная жидкость. Основные физико-химические свойства его приведены ниже [7]:
Таблица 2 – Основные физико-химические свойства ДЭГ
| Эмпирическая формула | C4H8O(ОН)2 |
| Молекулярная масса, г/моль | 106,12 |
| Температура кипения, °С | 244,8 |
| Температура плавления, °С | –7,8 |
| Плотность при 20°С, г/см³ | 1,1161 |
| Показатель преломления n20 | 1,4472 |
| Вязкость при 20°С, мПа⋅с | 35,7 |
| Давление насыщенных паров при 20°С, Па | <1,3 |
Растворимость диоксида углерода в ДЭГ в зависимости от темпрературы при давлениях 1,5,10,20 атм приведена в работе [8]. Изотермы растворимости диоксида углерода в ДЭГ приведены на рисунке 1 [9].
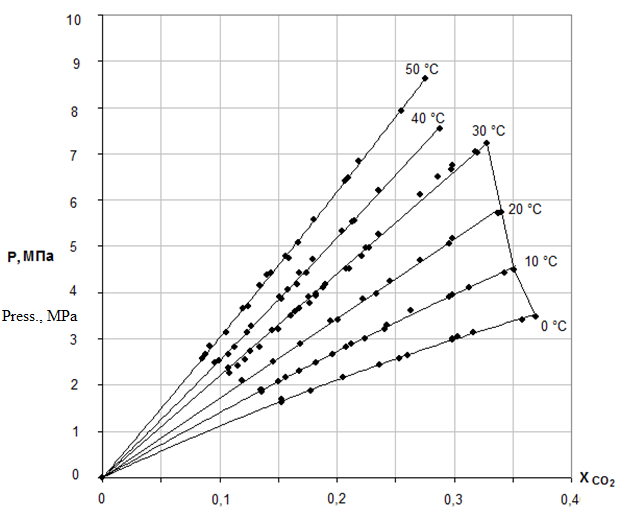
Рисунок 1 – Изотермы растворимости диоксида углерода в ДЭГ
Системы жидкость-газ, содержащие в качестве одного из компонентов диоксид углерода, а другогим – ДЭГ или N-МП, исследованы в работах [3,10-14]. В этих работах проводится изучение растворимости диоксида углерода в одно-, двух- и мультикомпонентных органических растворителях. При этом лишь относительно небольшое количество работ посвящено исследованию систем с интересующими нас абсорбентами – ДЭГ, ТЭГ, N-МП. Данные, имеющиеся в научной периодике, часто являются далеко не полными. В научных изданиях данные для этих систем по растворимости получены лишь в небольшом диапазоне температур и давлений. Так, в работе [12] диапазон изменения температуры составлял 298–398 К, диапазон изменения давлений 0–21,1 МПа. В работе [13] температура изменялась от 298 до 318 К, давление изменялось от 0,9 до 8,4 МПа. В работе [15] измерения проводились при температуре 313 К в диапазоне давлений от 0,72 до 7,78 МПа. Следует отметить, что данные отдельных работ существенно расходятся между собой. Также в работе [16] была исследована система диоксид углерода – ДЭГ – γ-БЛ. γ-БЛ и N-МП сходны по своей структуре и физико-химическим свойствам, поэтому следует ожидать аналогичного фазового поведения системы диоксид углерода – ДЭГ – N-МП. Все вышесказанное является основанием для обобщения и систематизации имеющейся информации.
3.2 Методы исследования растворимости диоксида углерода при повышенных давлениях
Методы исследования фазовых равновесий можно разделить на две большие группы: аналитические и синтетические [17]. Основным отличием этих методов является способ определения составов равновесных фаз. В аналитических методах исследований проводится отбор части фазы системы и анализ пробы методами аналитической химии. В синтетических методах состав фаз определяют путем непрямых измерений в системе заданного состава.
В качестве примера синтетического метода исследования фазовых равновесий в системе жидкость-газ можно привести работу [15]. Установка для исследований, используемая в данной работе, показана на рисунке 2.
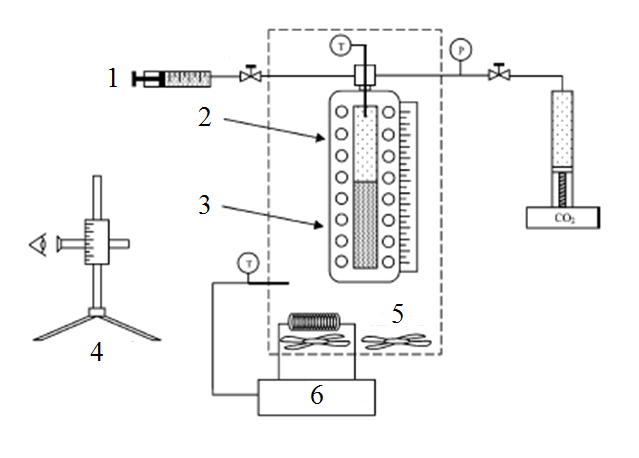
Рисунок 2 – Установка для исследования фазовых равновесий синтетическим методом
1 – жидкие компоненты, 2 – паровая фаза, 3 – жидкая фаза, 4 – катетометр, 5 – воздушный термостат,
6 – температурный контроллер
Рабочий объем ячейки равновесия достигает 150 см³, измерялся путем добавления известного объема диоксида углерода при постоянной температуре и измерением полученного суммарного объема. Калибровка ячейки проводилась по воде, высоты фаз измерялись катетрометром. Ячейка равновесия помещалась в воздушной ванне, которая играла роль термостата. Температура измерялась термопарой, давление - с помощью преобразователя давления и цифрового вторичного прибора. Ячейка равновесия размещалась на подвижном штативе, перемешивание содержимого проводилось вращением ячейки.
Вначале в ячейку равновесия загружался малолетучий компонент, объем которого опрелделялся катетометром с помощью уравнения калибровки. Диоксид углерода добавлялся в ячейку из баллона. При этом температура поддерживалась постоянной, после установления равновесия измерялось давление в системе и высоты столбцов фаз с помощью катетометра. Время достижения равновесия достигало 5 минут. После достижения равновесия проводился отбор пробы на анализ.
Поскольку в синтетических методах не осуществляется отбор проб, то состав системы остается неизменным. Эта методика имеет следующие недостатки: сложность установки, большой объем ячейки равновесия, что требует значительного расхода реагентов, для каждой загрузки возможно проведение только одного измерения при заданной температуре.
Синтетический метод измерений был также использован в работе [18]. Схема установки приведена на рисунке 3.
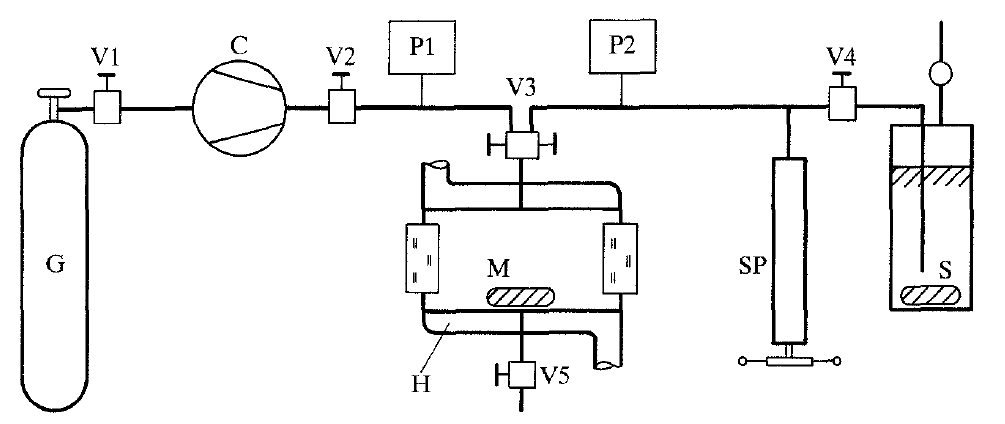
Рисунок 3 – Установка для исследования фазовых равновесий синтетическим методом
G – емкость для газа, С – диафрагменный компрессор, М – ячейка равновесия, Н – термостат, SP – шприцевый пресс,
S – емкость с метанолом
Главной частью установки является ячейка равновесия. В эксперименте использовались две ячейки: емкостью 30 см³ с рабочим давлением до 200 МПа и 110 см³ с рабочим давлением до 70 МПа. Температура в ячейке поддерживалась с помощью термостата. Диафрагменный компрессор служил для подачи чистого диоксида углерода в ячейку. Масса подаваемого газа рассчитывалась через измерение объема для известных давления и температуры и известного объема ячейки после установления равновесия. Объем измерялся шприцевым прессом, приводился к постоянному давлению в 7 МПа, и по известной при данных условиях плотности измерялась масса диоксида углерода. Метанол добавлялся шприцевым прессом при постоянной температуре. Измерение проводилось следующим образом: Метанол добавлялся в ячейку до тех пор, пока не исчезал последний пузырек газовой фазы, и измерялось давление, при котором это происходило. Таким образом, массы компонентов известны, получено значение давления исчезновения последнего пузырька газовой фазы. Плотность системы рассчитана по известному объему ячейки равновесия. По этим данным проводился расчет растворимости диоксида углерода в метаноле. Общая погрешность измерения давления не превышала 0,2% измеряемой величины давления. Максимальная погрешность измерения температуры достигала 0,5 К.
Основным преимуществом аналитического метода исследований является возможность определять состав равновесных фаз методами аналитической химии. При этом метод имеет следующие недостатки: сложность аппаратурного оформления, необходимость значительного количества реагентов, достаточно большое время установления равновесия, и вследствие этого значительные затраты времени на проведение измерений. Взятие пробы на анализ влияет на состояние всей системы, что приводит к погрешностям при определении состава пробы, который может отличаться от состава всей системы. Вследствие этого при одинаковой погрешности в получаемых данных более привлекательными являются синтетические методы исследования фазовых равновесий.
Методики, приведенные выше, имеют ряд недостатков, которые не позволяют использовать их для выполнения данной работы. Поэтому для исследования растворимости диоксида углерода в системе ДЭГ – N-МП была выбрана методика, использованная в работе [19].
Как уже было сказано, система ДЭГ – N-МП по результатам исследований рекомендована в качестве эффективного низкотемпературного осушителя природного газа. Это обусловлено высокой поглотительной способностью этой системы относительно водяных паров, низкой температурой кристаллизации и небольшой вязкостью ее при низких температурах. Для использования данной системы в качестве абсорбента диоксида углерода необходимо определение растворимости в ней последнего.
4. Методика проведения измерений растворимости диоксида углерода в органических абсорбентах при повышенном давлении
4.1 Подготовка реактивов для проведения исследования
ДЭГ квалификации ч
перегонялся при давлении 0,2–0,4 кПа. Отбиралась средняя фракция дистиллята, запаивалась
в стеклянные ампулы и использовалась для эксперимента. Показатель преломления полученного ДЭГ n20
= 1,4472 (литературный показатель 1,4472 [7]), содержание влаги 0,036%.
N-МП квалификации технический
перегоняли при давлении 0,2–0,4 кПа и для проведения эксперимента
отбирали среднюю фракцию, которая запаивалась в стеклянные ампулы. Показатель преломления полученного N-МП
n20 = 1,4701 (литературное значение 1,4709 [6]). Содержание влаги, измеренное
по методу Фишера, составляло 0,07% масс.
Диоксид углерода (углекислота пищевая), который выпускался из стандартного баллона, конденсировался в стальном баллончике емкостью 100 см³ при погружении последного в жидкий азот. После три раза проводился цикл вакуумирования - оттаивания - замораживания для удаления следов неконденсирующихся примесей. Диоксид углерода, выходящий из баллончика, после осушки над плавленным хлоридом кальция использовался для загрузки ячейки равновесия.
Чистота диоксида углерода проверялась по его критическим параметрам: критической температуре и критическому давлению. В наших исследованиях критическая температура составляла 31,1°С(по литературным данным критическая температура составляла 31,04–31,1°С, критическое давление 7,38 МПа совпадало с литературным в пределах погрешности эксперимента [20]).
Перед началом эксперимента ампула вскрывалась и определялся показатель преломления абсорбента. В случае соответствия его дозагрузочному и литературным значениям реактив использовался для проведения эксперимента.
4.2 Описание установки и методика исследования
Установка, используемая для исследования равновесия в системах жидкость-газ при повышенных давлениях, приведена на рисунке 4.
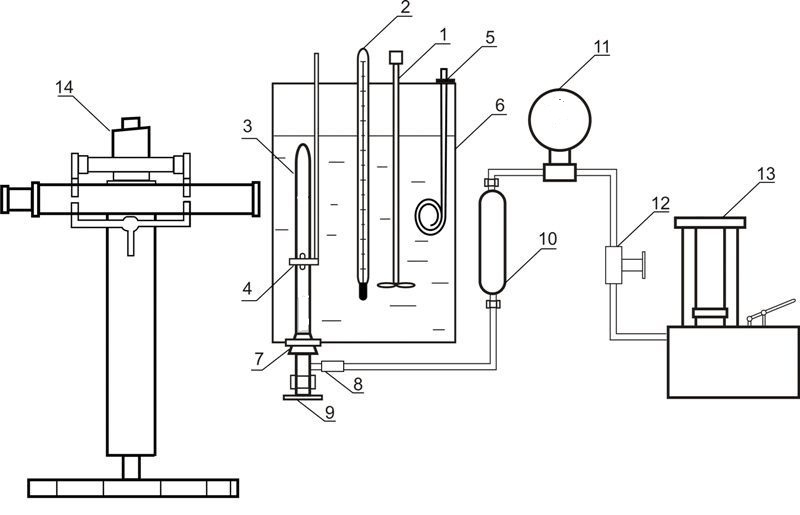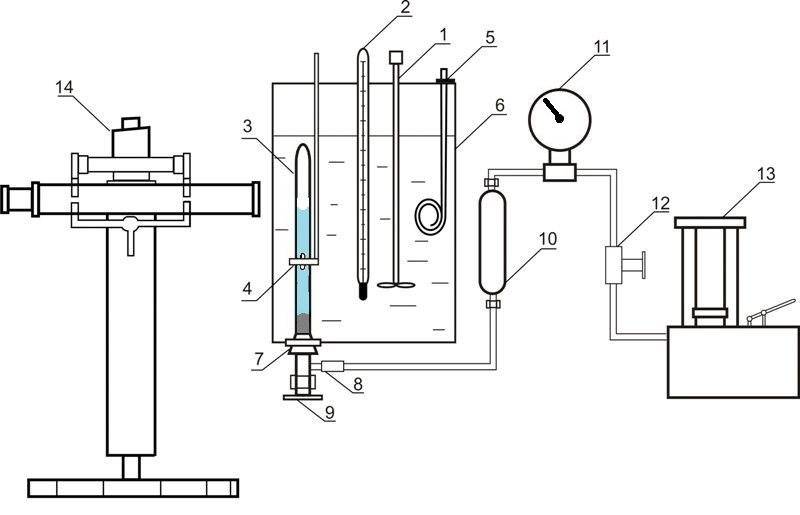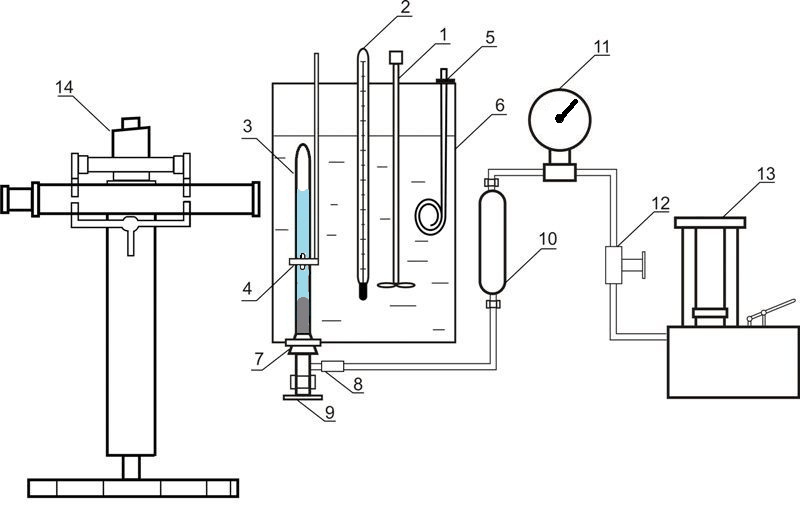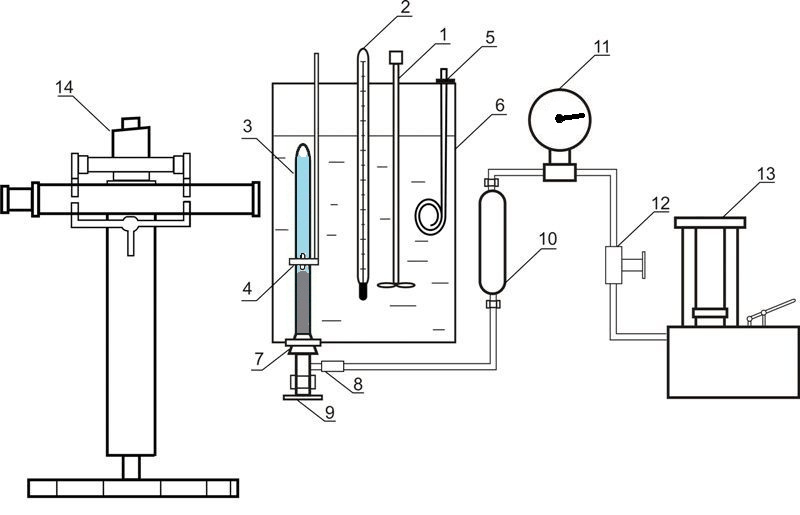
Рисунок 4 – Установка для исследования равновесия в системе жидкость-газ 1 – мешалка; 2 – термометр; 3 – ячейка равновесия; 4 – магнит; 5 – нагреватель; 6 – термостат; 7 – резиновая пробка; 8 – разъемное соединение; 9 – вентиль; 10 – разделитель масло-ртуть; 11 – образцовый термометр; 12 – вентиль; 13 – масляный пресс; 14 – катетометр
В состав установки входит ячейка равновесия из прозрачного кварцевого стекла 3, содержание которого сжимается ртутью и перемешивается с помощью никелевой мешалки, которая находится внутри ячейки. Движение этой мешалки обусловлено осевым перемещением внешнего кольцевого магнита 4. Давление в ячейке определяется с помощью образцового манометра 11, при этом вводится поправка на разницу высот столбцов ртути в ячейке и в разделителе 10. Масса ячейки составляет приблизительно 60 г, поэтому массы компонентов определяются путем взвешивания на аналитических весах. После загрузки абсорбента проводится удаление растворенного в нем воздуха путем вакуумирования. Диоксид углерода загружается в ячейку намораживанием. При этом ячейка погружается в жидкий азот и в нее подается необходимый объем диоксида углерода.
Температура поддерживается с помощью термостата 6 и измеряется нормальным термометром 2. Измерение давления проводится образцовым манометром 11. Высота столбцов фаз в ячейке измеряется катетометром В-630.
Для установления равновесия содержимое ячейки перемешивается с помощью мешалки.
Сама ячейка равновесия приведена на рисунке 5.
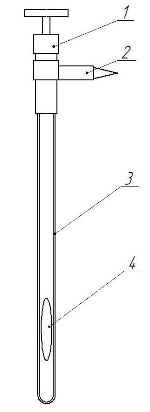
Рисунок 5 – Ячейка равновесия
1 – вентиль; 2 – разъемное конусное соединение; 3 – ампула ячейки; 4 – мешалка
Перед использованием ячейки для исследования фазовых равновесий необходимо провести ее калибровку. Калибровка проводится по дистиллированной воде, из которой предварительно удаляются растворенные газы. Удаление газов проводится путем кипячения воды и охлаждения ее до комнатной температуры без доступа воздуха. Проведение калибровки дает возможность получить уравнение, описывающее зависимость объема от высоты ячейки.
Ячейка вакуумируется и взвешивается на аналитических весах. После этого из вентиля вывинчивается шпилька и с помощью медицинского шприца загружается смесь растворителей. Завинчивается шпилька, раствор замораживается путем помещения ячейки в жидкий азот и ячейка вакуумируется. Когда она отсоединяется от вакуумной линии, растворитель плавится. После ячейка вновь погружается в жидкий азот и вакуумируется. Для полного удаления растворенного в жидкости воздуха необходимо повторение данной операции 5-6 раз. Ячейка с растворителем, освобожденным от воздуха, взвешивается и по разнице масс загруженой и пустой ячейки определяется его масса.
После добавления растворителя с помощью конусного соединения ячейка присоединяется к сосуду известного объема, в котором находится исследуемый газ – диоксид углерода. Из соединительной линии удаляется воздух, после открытия ячейки и погружения ее в жидкий азот намораживается газ. Ячейка закрывается, отепляется и взвешивается.
Загруженная ячейка равновесия с помощью резиновой пробки вставляется в термостат 6 снизу и присединяется с помощью конусного соединения 8 к разделителю масло-ртуть 10. Капилляр верхней части разделителя отъединяется от масляной линии и присоединяется через разделительную емкость к форвакуумному масляному насосу. Происходит удаление воздуха из соединительных линий. После отсоединения вакуумного насоса ртуть заполняет линию от разделителя 10 до седла вентиля 9. Разделитель масло-ртуть присоединяется к масляной линии конусным соединением и с помощью масляного пресса 13 создается давление.
Перед открытием вентиля ячейки в установке необходимо создать давление, превышающее равновесное давление на некоторую величину. Иначе, при недостаточном давлении в установке, газовая фаза способна вытолкнуть из ячейки замыкающую жидкость – ртуть, что также приведет к потере части исследуемого вещества. Потом открывается вентиль и ртуть поступает в ячейку, сжимая исследуемую систему. В термостате устанавливается необходимая температура и при установившемся значении давления производится энергичное перемешивание содержимого ячейки мешалкой, приводимой в движение кольцевым магнитом, до установления равновесия. Для этого необходимо около 40-50 перемешиваний. Для обеспечения достаточной точности измерений при каждом изменении давления для установления равновесия проводили около 100 перемешиваний. После установления равновесия с помощью катетометра определяют высоту жидкой фазы растворителя в ячейке 3. После проведения измерений при данном давлении система сжимается и проводится эксперимент при новом значении давления. Получают информацию о поведении жидкой фазы при установленной температуре в широком диапазоне давлений. Потом изменяется температура термостата и снова проводится эксперимент. Таким образом, при одной загрузке ячейки можно получить информацию в широком интервале температур и давлений.
4.3 Возможные погрешности при измерении параметров фазових равновесий с использованием описанной установки
Погрешности измерения параметров при исследовании равновесия жидкость-газ в установке с ртутным поршнем приведены в таблице 3.
Таблица 3 – Возможные погрешности измерения на установке с ртутным поршнем
| Измеряемый параметр | Диапазон измерения | Погрешность измерения (абс.) | Погрешность измерения (отн.) |
| Давление | 10–90 бар | 0,4 атм | 0,4% |
| Температура | 273,2–323,2 К | 0,02 К | 0,005% |
| Высота столбцов фаз | 0,05–0,150 м | 0,0015 м | 0,05% |
| Масса компонентов | 0,2–1,5 г | 0,0002 г | 0,1% |
Выводы
В рамках работы была исследована растворимость диоксида углерода в органическом абсорбенте состава 47,1% мол. ДЭГ, 52,9% мол. N-МП в температурном диапазоне 0-50°C и давлении до 9 МПа. Также были определены теплоты растворения диоксида углерода в абсорбенте данного состава. Результаты исследований свидетельствуют о высокой поглотительной способности данного абсорбента по отношению к диоксиду углерода. Исследования, проведенные ранее, показали высокую поглотительную способность данного абсорбента также по отношению к сероводороду и водяным парам. Таким образом, исследованный абсорбент пригоден для комплексной очистки газов от наиболее распространенных примесей.
На основе вышесказанного целесообразным является разработка высокоэффективного метода очистки газовых смесей от диоксида углерода, основанного на явлении физической абсорбции последнего данным абсорбентом.
Дальнейшие исследования направлены на следующие аспекты:
- Определение растворимости диоксида углерода в органических абсорбентах различного состава.
- Построение диаграммы состояния жидкость-пар для системы диоксид углерода – ДЭГ – N-МП.
- Разработка технологической схемы очистки газов от диоксида углерода органическим абсорбентом.
При написании данного реферата магистерская работа еще не завершена. Окончательное завершение: декабрь 2013 года. Полный текст работы и материалы по теме могут быть получены у автора либо его руководителя после указанной даты.
Список использованных источников
- Тер-Саркисов Р.М. Разработка месторождений природных газов. – М.: ОАО Издательство
Недра
, 1999. – 659 с.: ил. - Семенова Т.А., Лейтес И.Л. и др. Очистка технологических газов. – М.:
Химия
, 1969. – 392 с. - High-pressure fluid-phase equilibria: Experimental methods and systems investigated (2005–2008) / Jose M.S. Fonseca, Ralf Dohrn, Stephanie Peper // Fluid Phase Equilibria 300 (2011) 1–69.
- Hochgesand G. Rectisol and Purisol / Hochgesand G. // Ind. and Eng. Chem. – 1970. –V.62. – No 7. – P. 37–43.
- Коуль А.Л., Ризенфельд Ф.С. Очистка газа – М.: Недра, 1968. – 411 с.
- Краткая химическая энциклопедия. ред. кол. И.Л. Кнунянц (отв. ред.) и др., – М.:
Большая российская энциклопедия
, 1992. – Т. 3, Мед – Полимерные. – 639 с. - Краткая химическая энциклопедия. ред. кол. И.Л. Кнунянц (отв. ред.) и др., – М.:
Большая российская энциклопедия
, 1990. – Т. 2, Даффа – Мед. – 671 с. - Мурин В.И. Технология переработки природного газа и конденсата. Т 38, Ч.1 – М.: ООО
Недра-Бизнесцентр
, 2002 – 517 с. - Равновесие жидкость – пар в системе диоксид углерода – диэтиленгликоль / Матвиенко В.Г., Нифантова Л.С. // Наукові праці Донецького національного технічного університету. Серія: хімія і хімічна технологія. Випуск 144 (12). Донецьк - 2009. С. 67 – 74.
- High-pressure fluid-phase equilibria: Experimental methods and systems investigated (2000–2004) / Ralf Dohrn, Stephanie Peper, Jose M.S. Fonseca // Fluid Phase Equilibria 288 (2010) 1–54.
- High-pressure fluid phase equilibria: Experimental methods and systems investigated (1994–1999) / M. Christov, R. Dohrn // Fluid Phase Equilibria 202 (2002) 153–218.
- Solubility of H2S and CO2 in diethylene glycol at elevated pressures / F.Y. Jou, F.D. Otto, A.E. Mather // Fluid Phase Equilibr. 175 (2000) 53–61.
- Solubility of carbon dioxide in dimethylsulfoxide and N-methyl-2-pyrrolidone at elevated pressure / R. Rajasingam, L. Lioe, Q.T. Pham, F.P. Lucien // J. Supercrit. Fluids 31 (2004) 227–234.
- Experimental setup to measure critical properties of pure and binary mixtures and their densities at different pressures and temperatures. Determination of the precision and uncertainty in the results / Laura Gil, Santos F. Otin, Jose Munoz Embid, M. Asuncion Gallardo, Sofia Blanco, Manuela Artal, Inmaculada Velasco // J. of Supercritical Fluids 44 (2008) 123–138.
- High-Pressure Vapor-Liquid Equilibria of Some Carbon Dioxide + Organic Binary Systems / Michael J. Lazzaroni, David Bush, James S. Brown, and Charles A. Eckert // J. Chem. Eng. Data 2005, 50, 60-65.
- Флюидные фазовые равновесия в системе диоксид углерода-диэтиленгликоль-γ-бутиролактон при повышенных давлениях / В.Г. Матвиенко, Л.С. Нифантова, Н.Ю. Траховцов, В.В. Кулик // Наукові праці Донецького національного технічного університету. Серія: хімія і хімічна технологія. Випуск 19 (199). Донецьк – 2012. С. 40.
- Циклис Д.С. Техника физико-химических исследований при высоких и сверхвысоких давлениях – М.: Химия, 1976. – 432 с.
- Isothermal phase equilibria in binary mixtures consisting of (methanol + hydrogen or nitrogen or methane or carbon monoxide or carbon dioxide) / E. Brunner, W. Hultenschmidt, and G. Schlichtharle // J. Chem. Thermodinamics 1987, 19, 213-291.
- Растворимость аргона в бензоле и гексане при повышенных давлениях / Матвиенко В.Г., Ярым-Агаев Н.Л., Грознер Ю.Л. // ЖПХ. – 1995. – Т.68. – № 2. – С. 198–202.
- Алтунин В.В. Теплофизические свойства двуокиси углерода – М.: Издательство стандартов, 1975. – 546 с.
