Реферат за темою випускної роботи
Зміст
- Вступ
- 1. Актуальність теми
- 2. Мета і задачі дослідження та заплановані результати
- 3. Огляд досліджень та розробок
- 3.1 Огляд міжнародних джерел
- 3.2 Огляд національних джерел
- 3.3 Огляд локальних джерел
- 4. Калориметрія
- Висновки
- Перелік посилань
Вступ
В наш час природний газ широко використовується в якості сировини і палива для різних галузей промисловості. Природний газ є найкращим видом палива, поступаючись лише нафті. Це перевага пов'язана з високою теплотою згоряння, легко регульованою подачею газу в піч, відсутністю золи.
Газ – найчистіший з екологічної точки зору вид палива, внаслідок чого його використовують як джерело енергії набагато частіше, ніж інші види палива. Але його кількість у зв'язку зі зростанням промисловості різко зменшується, внаслідок чого виникає проблема раціонального використання газу, його якості. Відомо, що чим більше питома теплота згоряння палива, тим менше питома витрата палива при такому ж показнику коефіцієнта корисної дії. Питома теплота згоряння вимірюється в Джоулях на кілограм або калоріях на кілограм. Для експериментального виміру цієї величини використовуються методи калориметрії.
Калориметрія – це наука, яка займається визначенням зміни кількості енергії шляхом вимірювання теплового обміну з навколишнім середовищем.
Прилади, які використовуються для таких вимірювань, називаються калориметрами. Стандартними інструментами для вимірювання калорійності твердих і рідких горючих матеріалів є кисневі бомбові калориметри.
1. Актуальність теми
У зв'язку з сучасним розвитком прикладних галузей науки і техніки, стають актуальними роботи, що стосуються вимірювальної техніки. Найважливіше місце у вимірювальній техніці займає калориметрія. За допомогою калориметрів визначають теплоємність, теплопровідність, теплотворну здатність, кількість теплоти, що виділяються при зміні стану, ентальпію, ентропію.
Калориметри застосовуються в металургії, радіоелектроніці, медицині, радіаційній дозиметрії, фізиці, фізичній хімії, газифікації. В останні роки розроблено ряд еталонних і зразкових установок для калориметрії. Але, не дивлячись на це, досі залишаються невирішеними деякі проблеми, пов'язані зі створенням технічних калориметрів, які задовольняли б вимогам масових технічних вимірювань для різних прикладних калориметричних завдань з чутливості, температури, порогової чутливості, швидкодії, метрологічним характеристикам.
Всі перераховані параметри калориметрів залежать від їх теплофізичних характеристик (характера теплообміну з навколишнім середовищем), конструктивних особливостей калориметрів, типів датчиків температур, способу проведення калориметрического досвіду. Отже, необхідне уточнення класифікації калориметрів, їх характеристик, вивчення існуючих моделей, їх порівняння і подальша розробка калориметра з покращеннними характеристиками. Тому робота, спрямована на вирішення цих завдань, є актуальною і має велике народногосподарське і промислове значення.
2. Мета і задачі дослідження та заплановані результати
Метою даної роботи є розробка приладу, що визначає теплотворну здатність газу на сучасній елементній базі.
Основні завдання дослідження:
- Аналіз існуючих калориметрів, дослідження їх характеристик, порівняльний аналіз приладів.
- Дослідження і пошук вирішення різних виробничих і лабораторних вимірювань у калориметрії.
- Оцінка заособів збільшення швидкодії, спектру температури, чутливості, порогової чутливості, радіаційної прозорості.
- Проведення метрологічного дослідження та атестації.
- Введення розробки в досліджувальну і виробничу практику.
Об'єкт дослідження : процес вимірювання теплотворної здатності природного газу в контрольних точках газопроводу Росія–Україна.
Предмет дослідження : прилад для визначення теплотворної здатності газу.
3. Огляд досліджень та розробок
Виходячи з того, що колориметри є важливою частиною в промисловості та газифікації, то проблеми їх мінімізації, поліпшення технічних і економічних характеристик і реалізації було широко досліджено як європейськими, американськими, японськими вченими, так і вітчизняними фахівцями.
3.1 Огляд міжнародних джерел
Вивчення калориметрії бере своє коріння ще в 18 столітті. У 1780 р. французькі вчені Антуан Лавуазьє (1743–1794) і П'єр Симон Лаплас (1749–1827) запропонували прилад для вимірювання питомих теплоємностей та назвали його калориметром.
Основу калориметра становить теплоізольований сосуд і калориметричне тіло, в якому поглинається або виділяється тепло. Прилад складається з вуглецевої мішені, в якій відбувається генерація вторинних часток – нейтральних іонів, які, розпадаючись, формують поток фотонів.
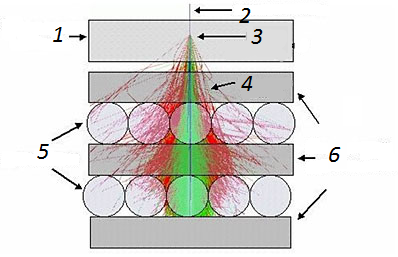
Рисунок 1 - Калориметр 18 століття
1 - вуглецева мішень, 2 - первинна частка, 3 - місце взаємодії, 4 - вторинні частки, 5 - детектори,
6 - свинцевий поглинач.
Вони реєструються шарами детекторів, розташованих між поглиначами і свинцем під мішенню. Вимірюючи кількість вторинних часток, можна визначити енергію первинної. Чим більше шарів детекторів, тим точніше вимірювана енергія. У 1750 р. петербурзький фізик Георг Рихман (1711–1753), що працював у співдружності з М. В. Ломоносовим, встановив на досвіді, що якщо змішати рівні кількості води, що мають різну температуру, то температура суміші буде дорівнювати середньому арифметичному температур частин. Ці досліди були повторені у 1772 р. Іоганном Вільке в Німеччині. Вільке ввів одиницю вимірювання кількості теплоти – калорію як кількість теплоти, необхідної для зміни температури одиниці маси води на один градус. Вона збереглася до наших днів. [14].
Одночасно розвиваються статистичні уявлення. Больцман знаходить точний зв'язок між середньою енергією теплового руху часток і температурою, вводячи нову світову константу, названу його ім'ям.
Сучасні калориметри працюють в діапазоні температур від 0,1 до 3500 К і дозволяють вимірювати кількість теплоти з точністю до 10–20%. Пристрій калориметрів дуже різноманітний і визначається характером і тривалістю досліджуваного процесу, областю температур, при яких проводяться вимірювання, кількістю вимірюваної теплоти і необхідною точністю.
На початку 20 століття була видана перша монографія з калориметрії, написана Вайтом [11] у 1928 році.
У 1946 Свитославського С.И.[12] було вперше введено таке поняття, як мікрокалориметрія, де була викладена історія розвитку теплофізичних величин, які відіграють важливу роль у сучасній промисловості, наведений опис, метрологічні характеристики, принципи дії еталонів одиниць цих величин.
В області калориметрії відбувся прогрес, який призвів до значних досягнень в експериментальній калориметрії. У 1989 році Хеммінгер випускає книгу, де чітко викладено принципи калориметричних методів, класифікація калориметрів та обробки результатів калориметричних вимірів, наведено безліч математичних моделей, що дозволяють проводити порівняльну характерістіку різноманітних калориметричних методик [1].
У 1963 році Кальве і Прат у своєму виданні описали винахід нового типу калориметра – теплопровідного. Незважаючи на зовнішні ізолюючі оболонки, він не адіабатічен, так як теплота, що виділяється в ньому, виводиться з калориметричної камери в міру її виділення і розсіюється у великому металевому блоці. У калориметрі Тіана–Кальве хоч температура калориметричної системи змінюється незначно, прилад не можна назвати ізотермічним, тому що в ньому виявляються невеликі зміни температури, які неминучі і служать основою вимірювань [2].
Стандартні стану для калориметричній бомби в середині 20 століття вперше описав Едвард Вашбурн. У його роботах докладно описані дослідження термодинамічних умов, існуючих в калориметричних бомбі [3]. Експериментальної термодинамікою і адіабатичними калориметрами займалася команда вчених, у складі якої були Веструм Е.Ф., Фурукава Г.Т., Маккаллог Д.П.[6].
У 1990 році Бернштейном В.А і Єгоровим В.М. був розроблений метод, що поєднує якості традиційної калориметрії і динамічного аналізу теплових процесів, що має назву диференціальна скануюча калориметрія. Цей метод дозволяє визначати як термодинамічні параметри речовин (теплоємність, температуру, ентальпію і ентропію фазових переходів, енергетичні вимірювання різної природи), так і кінетичні характеристики процесів в умовах лінійно програмованого вимірювання температури [9].
3.2 Огляд національних джерел
Вітчизняні вчені вперше щільно зайнялися калориметричними дослідженнями на початку 20 століття. У 1914 році Попов М.М. під керівництвом Свентославского В.А. в журналі російського фізико–хімічного товариства випустив свою першу наукову роботу «Про калориметричних бомби і теплоту горіння бензольної кислоти». Велика увага Попов приділяв вдосконаленню методики калориметричних вимірів. Йому належить ідея і перша в світі конструкція калориметра з рухомої бомбою, розроблена в 1933 році, що згодом стало застосовуватися у всіх термохімічних лабораторіях. Також Поповим М.М. разом з учнями були розроблені і побудовані калориметри для вимірювання теплоємності при високих (до 1200 К) і низьких (від 60 до 300 К) температурах, калориметри для визначення теплоти розчинення солей і теплоємкостей їх водних розчинів [4].
У кінці 20 століття в калориметрії почали відкриватися нові галузі. Так, у 1981 році Анатичук Л.І. і Лусте О.Я. встановили, що мікрокалориметричні експерименти дозволяють встановлювати порядок реакцій, константи рівноваги, виявляти нефіксовані іншими методами особливості зменшення концентрації реагентів у часі [8].
Згодом з'явилися методики, що сприяють знайти оптимальний шлях з експериментального визначення необхідної калориметричної величини, який був би найменш трудомістким і забезпечував би достатню точність результатів, використовуючи при цьому вже добре апробовані і детально розроблені апаратуру і способи вимірювань. Це було запропоновано Кирьяновим К.В. в «Калориметричних методах дослідженнях» [5].
Різні конструкції теплообмінних апаратів були описані Вяхіревим Р.А. в Російській газовій енциклопедії [10].
Питання, що стосуються дослідження зразкових мір кількості теплоти в калориметрії спалювання і методів та засоби калориметрії теплофізичних вимірювань, були розглянуті Александровим Ю.І. і Осиповим Т.Р. [7].
У Національній академії наук України Стьопчиним А.А. було написано безліч робіт, присвячених калориметричним дослідженням. У своїй дисертаційній роботі він провів порівняльний аналіз і розробку диференціальних та мостових калориметрів з термоелектричними і резистивними елементами [13].
3.3 Огляд локальних джерел
У Донецькому національному технічному університеті темою, що стосується калориметричних досліджень, вивчали наступні студенти: Борисенков А. Д., П'янков М. В., Прохорова Є.В., Трач Д.С., Пивоваров Д.А., Киливник О.С..
4. Калориметрія
Основним завданням при використанні природного газу є його раціональне споживання, тобто зниження питомої витрати за допомогою впровадження економічних технологічних процесів, при яких найбільш повно реалізуються позитивні властивості газу.
Застосування газового палива дозволяє уникнути втрат теплоти, що визначаються механічним і хімічним недожогом. Зменшення витрат теплоти з вихідними продуктами горіння досягається спалюванням газу при малих коефіцієнтах витрати повітря.
При роботі агрегатів на газовому паливі можливо також ступеневу використання продуктів горіння. Для того, щоб використання газу було найбільш раціональним, необхідно визначати його теплотворну здатність. Саме для цього існують колориметри.
Калориметр являє собою пристрій настільного типу. Принцип дії калориметра полягає в вимірі зміни температури калориметричній системи із заздалегідь відомим енергетичним еквівалентом при спалюванні суворо певної кількості досліджуваного палива.
Питома теплота згоряння палива визначається за формулою:
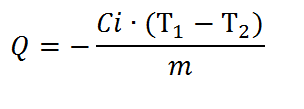
де С i – енергетичний еквівалент калориметра, Т 1 – теоретичне значення, Т 2 – експериментальне значення, m – маса зразка палива.
У калориметрі В-08 М зміна температури проводиться за допомогою метастатичного термометра і оптичного пристрою.
Калорійність (теплоту згорання) зразка можна визначити в широкому розумінні як кількість тепла, звільненого оденицею маси зразка при згорянні в кисневому середовищі у замкнутому постійному обсязі. При цій реакції зразок і кисень спочатку мають однакову температуру, і продукти згоряння охолоджуються на кілька градусів від початкової температури. Водяна пара, що утворюється при згоранні, конденсується в рідкому стані. Більш точне визначення повинне б вказувати температуру, при якій реакція починається і закінчується.
Однак зміна теплоти згорання при можливих варіаціях початкової температури є такими незначними, що подібна деталізація не потрібна. До того ж, температури початку і закінчення не збігаються, розрізняючись за величиною підвищення температури в калориметр – але вплив цієї різниці настільки невелик, що їм нехтують. Отже, термін калорійність (або теплота згоряння) при вимірюванні в бомбовий калориметр, означає кількість тепла звільненого при згорянні всього вуглецю і водню в кисні і утворенням двоокису вуглецю і води, включаючи тепло, звільнене при окисленні інших елементів (таких як сірка), які можуть бути присутнім у зразку.
Теплота згоряння, визначена в кисневому бомбовому калориметрі, вимірюється в процесі заміщення, при якому теплота, отримана від зразка порівнюється з теплотою, отриманою від згоряння подібної кількості бензольної кислоти або іншого стандартизованого матеріалу з відомою калорійністю. Ці виміри виходять шляхом представленого зразка в кисневому середовищі під тиском в металевих посудинах високого тиску, так званих «бомбах». Енергія, отримана при цьому згорянні, поглинається в калориметрі. При цьому фіксується зміна температур в поглинаючому середовищі. Потім теплота згоряння зразка розраховується шляхом множення величини підвищення температури в калориметрі на раніше відомий енергетичний еквівалент або теплоємність, визначена при попередніх випробуваннях із стандартизованим матеріалом. При цьому слід вводити поправки, щоб підвести ці величини до будь-якої передачі теплоти, яка відбувається в калориметрі, а також врахувати побічні реакції, які є унікальними в процесі згоряння в бомбі.
Будь бомбовий калориметр повинен складатися з чотирьох основних частин:
1. Бомба або сосуд, в якому проводиться спалювання заряду.
2. Короб або контейнер, для занурення бомби в виміряну кількість води, разом з датчиком температури і механізмом управління.
3. Ізольовальна оболонка для захисту коробу від несталого теплового навантаження під час процесу згоряння.
4. Термометр або інший датчик для вимірювання змін температури в контейнері.
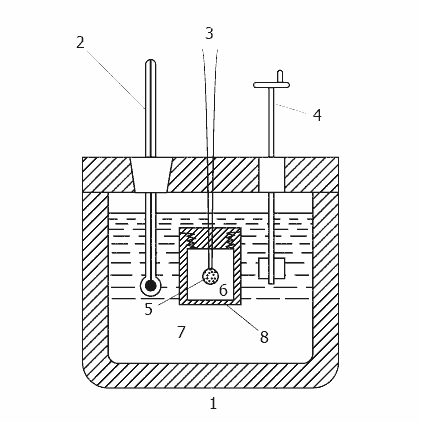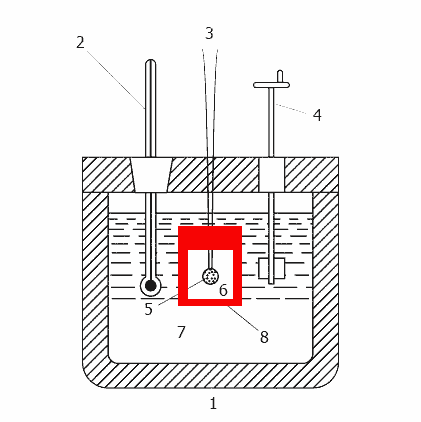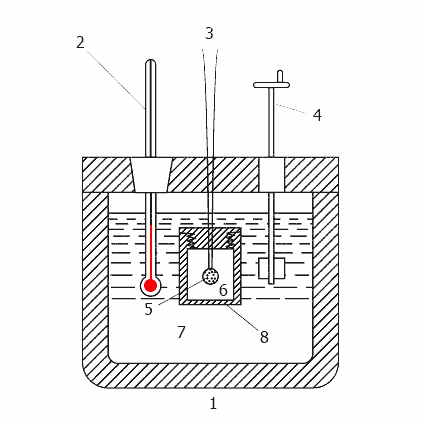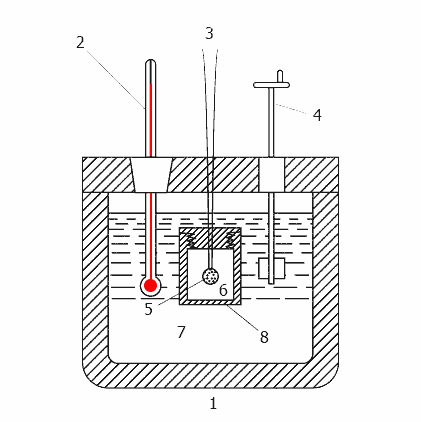
Рисунок 2 - Принцип дії калориметра
(анімація: 11 кадрів, 13 циклів повторення, 20 кілобайт)
1-теплоізольований корпус, 2 - термометр, 3 - дроти для підпалу, 4 - мішалка, 5 - зразок, 6 - кисень,
7 - вода, 8 - бомба
Бомба представляє з себе міцний металевий сосуд з товстими стінками, який можна відкривати для розміщення зразка, для вилучення продуктів згорання і для очищення. Повинні бути передбачені трубки для заповнення бомби киснем під тиском і для випуску решти газів після завершення випробування. Крім цього, бомба укомплектовується електродами для подачі струму запалювання на провід запалу. Оскільки під час запалювання внутрішній тиск може доходити до 1500 фунтів на квадратний дюйм, більшість кисневих бомб розраховані на тиск не менше 3000 фунтів на квадратний дюйм.
Висновки
У кисневих бомбових калориметрах використовується кілька систем оболонок. Найпростіші з них є нерегульованими або оболонками з простою ізоляцією. При використанні цього типу оболонки передбачається, що температура оболонки, залишається постійною під час усього випробування без застосування спеціальної системи регулювання температури. Враховуючи простоту, калориметри з простою ізоляцією рекомендуються як недорогі прилади для користувачів, які тільки час від часу проводять калориметричні випробування або для тих користувачів, чия робоча завантаження не виправдовує витрат на купівлю моделей з регулюванням температури. Калориметри з простою оболонкою не вимагають постійного підключення. Його можна налаштувати і підготувати до роботи за кілька хвилин, якщо калориметр не використовується, то його можна легко розібрати і покласти на зберігання.
Перелік посилань
Список источников
- Хеммингер В., Хене Г. Калориметрия. Теория и практика. М.: Химия. 1989. 176 с.
- Кальве Э., Прат А. Микрокалориметрия. М.: Изд-во ин. лит. 1963. 477 с.
- Washburn E.W. Standard states for bomb calorimetry. J. Res. Nat. Bur. Standards. 10. 1933. P. 525
- Попов М.М. Термохимия и калориметрия. 2-е изд. М.: 1954.
- Кирьянов К.В. Калориметрические методы исследования. Нижний Новгород, 2007, 76 с.
- Westrum E.F., Furukawa G.T., McCullough J.P. Adiabatic Low-temperature Calorimetry.Experimental Thermodynamics. V. I. Ed. McCullough J.P., Scott D.W. L.: Butterworths, 1968.
- Александров Ю.И., Осипова Т.Р., Юшкевич В.Ф. Исследование образцовых мер количества теплоты в калориметрии сжигания. Методы и средства калориметрии теплофизических измерений. Л., 1984. 250 с.
- Анатычук Л.И., Лусте О.Я. Микрокалориметрия. Львов: Вища школа. Изд-во при Львов. гос. ун-те. 1981. 160 с.
- Бернштейн В.А., Егоров В.М. Дифференциальная сканирующая калориметрия в физикохимии полимеров. Л.: Химия, 1990. 256 с.
- Вяхирев Р.А. Российская газовая энциклопедия, М: 2004, 527 с.
- Вайт П.А. Современная калориметрия, Л:1928, 340 с.
- Свитославский С.И. Микрокалориметрия, М:1946, 280 с.
- Сравнительный анализ и разработка дифференциальных, мостовых калориметров с термоэлектрическими и резистивными элементами [Электронный ресурс]. – Режим доступа: http://tekhnosfera.com/view/62460/a?#?page=20.
- История калориметрии . [Электронный ресурс]. – Режим доступа: http://www.kipstory.ru/pribori/color/.
