Реферат по теме выпускной работы
Содержание
- Введение
- 1. Актуальность темы, цель и задачи исследования
- 2. Характеристика синтетических переносчиков кислорода
- 2.1 Соединения кобальта(II)
- 2.2 Исследование смешаннолигандной системы кобальта(II)
- 3. Проведение эксперимента
- 4. Результаты исследования
- Вывод
- Список источников
Введение
Среди разнообразных координационных соединений особенно интересны комплексные соединения переходных металлов с молекулярным кислородом, и проблема обратимого взаимодействия О2 с комплексами металлов чрезвычайно важна. Это, прежде всего, связано с тем, что на основе такого типа координационных соединений можно создавать катализаторы высокой эффективности для окисления ряда органических соединений. Наряду с этим, изучение процессов оксигенации координационных соединений d-элементов важно и с точки зрения исследования строения и свойств переносчиков молекулярного кислорода в живом организме [1].
Способностью координировать молекулярный кислород обладают комплексные соединения определенного строения большинства элементов первого переходного ряда, а также d-элементов VIII группы в низших степенях окисления. Эффективность взаимодействия комплексов данных металлов с молекулярным кислородом определяется геометрическим строением комплексов, составом ближайшей координационной сферы, природой и донорными свойствами лиганда, занимающего транс-положение. Одна из специфических особенностей кислородных комплексов октаэдрического типа состоит в возможности регулирования свойств координированной молекулы кислорода путем модификации транс-лиганда.
Этим требованиям в определенной степени отвечают низкоспиновые плоские тетракоординационные комплексы кобальта(II) с основаниями Шиффа, координационная сфера которых содержит два или четыре атома азота, а в качестве транс-лиганда выступает N-гетероциклическое основание. Координационные соединения с молекулярным кислородом играют существенную роль для моделирования как биологических процессов, так и выяснения механизмов окислительно-восстановительных процессов в гомогенной среде [1].
1. Актуальность темы, цель и задачи исследования
Актуальность данной темы состоит в том, что способность комплексных соединений кобальта обратимо присоединять молекулу кислорода является важной с экологической точки зрения. Так как эти соединения являются моделями активных центров в сложных биологических соединениях (гемоглобине, миоглобине, гемеритрине, гемоцианине) и поэтому могут рассматриваться как природные переносчики кислорода. Уже разработаны такие препараты как перфторан, перфукол на основе перфрорированых углеводородов, однако они не совершенны и обладают рядом недостатков, которые препятствуют их использованию в клинических условиях. Для решения этой проблемы необходим поиск более оптимальных синтетических переносчиков кислорода [2].
Цель исследования заключается в изучении реакций комплексообразования в системе кобальт(ІІ)-аланилаланин-дипиридил как в инертной атмосфере, так и в присутствии кислорода. Определении условий образования оксигенированных комплексов, играющих важную роль в современной медицине.
Для достижения цели поставлены следующие задачи:
1 – определить константы равновесия всех стадий процесса;
2 – построить кривые распределения;
3 – рассчитать равновесные концентрации в исследуемой системе;
4 – сравнить полученные результаты с имеющимися в литературе с целью выбора наиболее оптимальных условий проведения исследования.
2. Характеристика синтетических переносчиков кислорода
Некоторые координационные соединения переходных металлов в низких степенях окисления способны обратимо связывать молекулу кислорода.
Выяснение закономерностей, определяющих механизмы поглощения молекулярного кислорода его природными переносчиками и его утилизации, весьма затруднено из-за высокой молекулярной массы белковой части многих природных молекул. Решение проблем геометрического и электронного строения этих соединений и механизма их действия значительно облегчается при использовании простых модельных систем — комплексов переходных металлов с О2. В настоящее время исследовано большое количество таких комплексов, способных моделировать функции, а в некоторых случаях — и строение активного центра природных носителей О2. Изучение этих моделей с привлечением современных физических методов позволило в ряде случаев установить природу взаимодействия металлактивного центра с молекулой кислорода [3, 4].
Близкими к природным переносчикам О2 оказались комплексы металлов первого переходного ряда в низких степенях окисления (Мn(II), Fe(II), Со(II), Ni(II), Сu(I)). Они (особенно соединения Со(II)) способны обратимо оксигенироваться в водных растворах и имеют состав внутренней координационной сферы, аналогичный природным активным центрам. Так, смешанные аминокислотноимидазольные и гистидинатные комплексы Со(II) моделируют функции и состав активного центра гемеритрина [1, 2, 5].
Такие оксигенированные комплексы можно рассматривать в качестве моделей не только природных носителей О2, но и металлоферментов, катализирующих реакции окисления.
Интерес к активации координированного молекулярного кислорода вызван также возможностью образования короткоживущих интермедиатов в гомогенно-каталитических реакциях автоокисления. Особое значение для выяснения механизмов реакций представляют исследования реакционной способности О2 в оксигенированном комплексе. Изучение реакций интермедиата позволяет представить сложный механизм гомогенно-каталитической реакции в виде отдельных стадий. Следовательно, соединения переходных металлов с О2 играют важнейшую роль для моделирования биологических процессов, а также для выяснения механизма и поиска катализаторов окислительно-восстановительных процессов.
Однако роль комплексов переходных металлов с О2 не ограничена чисто химическими, биологическими и медицинскими аспектами. Они могут служить источниками чистого кислорода для различных технологических целей. Разработан способ получения запасов кислорода на основе бис-салицилидениминкобальта(II). Основной его недостаток — необратимое окисление части переносчика кислорода в каждом цикле поглощения О2. Координационные соединения, способные связывать О2, могут служить индикаторами кислорода. Соединения, способные присоединять и активировать О2, могут служить катализаторами реакций для получения промышленно важных продуктов, катализаторами электровосстановления кислорода, биологически активными препаратами, а также использоваться в системах очистки газов от примесей кислорода. Современные знания о синтетических переносчиках молекулярного кислорода — координационных соединениях переходных металлов с О2 — сформировались в результате многостороннего подхода к изучению свойств и строения этих комплексов. Разработаны методы синтеза соединений, изучались кинетика и термодинамика процессов оксигенации, электронная и геометрическая структуры соединений. Наиболее широко перечисленные методы использовались для исследования свойств и строения комплексов кобальта с О2. В настоящее время координационные соединения с молекулярным кислородом известны для всех 3d-переходных металлов в низких степенях окисления [3, 6].
Координация молекулы кислорода во внутренней сфере иона металла сопровождается переносом электронной плотности с центрального иона на О2, что в некоторых случаях приводит к внутримолекулярной окислительно-восстановительной реакции, в результате чего координированная частица О2 приобретает свойства супероксид- или пероксид-иона. Поэтому представляют интерес окислительно-восстановительные потенциалы в ряду ионов 3d-переходных металлов. Стандартный окислительно-восстановительный потенциал М3+/ 2+х × (М3+ + е = Ме2+) изменяется в ряду от титана до меди (данные для никеля отсутствуют) следующим образом: 0,37 (Ti), 0,256 (V), 0,41 (Сr), 1,51 (Мn), 0,771 (Fe), 1,808 (Со), 0,337 (Сu). Соединения ионов металлов в степени окисления два начала ряда имеют более низкие окислительно-восстановительные потенциалы и, как известно, очень легко окисляются молекулярным кислородом. В то же время металлы(II) второй половины ряда плохо или совершенно не окисляются кислородом. На протекание окислительно-восстановительных процессов между О2 и ионами металлов(II) середины 3d-переходного ряда влияет природа лигандов внутренней координационной сферы, в первую очередь азотсодержащих. Восстановление координированной молекулы кислорода до пероксид- или супероксид-иона часто обеспечивает ее обратимое связывание комплексом металла. Действительно, в настоящее время наибольшее количество координационных соединений с молекулярным кислородом получено для ионов Со(II), Fe(II) и Мn(II) [3].
Искусственные переносчики кислорода — это химические соединения, использующиеся для увеличения объема кислорода в крови. Примерами таких переносчиков могут быть перфторкарбонаты (PFCs), переносчики на основе гемоглобина (LEHs). Искусственные переносчики кислорода могут быть использованы, когда:
– настоящая кровь недоступна,
– имеется риск заражения какой-либо инфекцией,
– нет времени на то, чтобы проверить совместимость крови донора и реципиента.
Однако, эти продукты используются мало, они постоянно совершенствуются, требуют проводить больше научных исследований и клинических испытаний.
Кислородные соединения металлов, обратимо присоединяющие кислород могут служить моделями природных носителей молекулярного кислорода: гемоглобина, гемэритрина, гемоцианина и др. Синтетические носители молекулярного кислорода представляют и несомненно технический интерес:
– являются потенциальным рабочим веществом для получения кислорода из атмосферы в мягких условиях;
– могут служит катализаторами в гомогенно-каталитических окислительно-восстановительных реакциях (так как при координации молекулярного кислорода происходит его активация);
– использоваться для повышения эффективности работы положительного электрода в топливных элементах;
– для глубокой очистки жидкостей и газов от кислорода, служить антиоксидантами [2].
Из известных в настоящее время комплексов, обратимо связывающих молекулярный кислород, большую часть составляют комплексные соединения кобальта с различными лигандами: шиффовыми основаниями, аминами, аминокислотами, порфиринами и др. Особый интерес представляют смешаннолигандные дикислородные комплексы, содержащие во внутренней сфере наряду с π-акцепторными лигандами типа 1,10-фенантролин, фрагменты белков аминокислоты или пептиды. Такие комплексы по типу организации аналогичны природным переносчикам О2, как известно, обладают высокой эффективностью [3].
2.1 Соединения кобальта(II)
Особое положение среди металлов первого переходного периода по способности образовывать координационные соединения с О2 занимает кобальт. Большинство известных в настоящее время координационных соединений 3d-переходных металлов с О2 составляют соединения кобальта с соотношением Со:О2 = 2:1 и 1:1. В настоящем разделе рассматриваются основные типы координационных соединений кобальта с О2.
Известно несколько разновидностей лигандов, которые, координируясь с Со(II), создают условия для обратимого образования комплексов с О2: основания Шиффа, порфирины, амины, макроциклические амины, полиамины, аминокислоты, комплексоны, пептиды, полипептиды. Рассмотрение основных типов координационных соединений кобальта с О2 показывает, что у большинства из них координационное число равно шести. Ион кобальта в оксигенированных комплексах связан с лигандами главным образом через атомы азота (как правило, не менее трех) и кислорода. Получены переносчики кислорода разнолигандного состава: ион аминокислоты — имидазол, ион аминокислоты — нуклеотид, ион аминокислоты или дипептид — гетероциклический амин, пятикоординированные фосфинсодержащие соединения, комплексы с серосодержащими основаниями Шиффа и др.
Комплексы с О2 изучены в водных и неводных растворах. В водных и других полярных растворителях с высокой диэлектрической проницаемостью
образуются преимущественно двуядерные оксигенированные комплексы, имеющие более полярную связь металл – молекула кислорода, чем одноядерные.
Одноядерные оксигенированные комплексы менее устойчивы, чем двуядерные. Выделению одноядерных комплексов способствуют малая диэлектрическая
проницаемость среды, высокая концентрация кислорода, низкая температура и значительные стерические препятствия на пути димеризации.
Большинство одноядерных оксигенированных комплексов кобальта образуется в неводных растворителях. В состав внутренней координационной сферы
их входят основания Шиффа или порфирины. Лиганды — порфирины различных типов — представляют существенный интерес для получения оксигенированных
комплексов, так как это наиболее близкие модели гема в природных переносчиках кислорода. Изучены различные физико-химические свойства комплексов
кобальта с порфиринами: термодинамика и кинетика связывания кислорода, влияние стереохимии порфирина и аксиального лиганда на способность
связывать кислород. Показано, что указанные комплексы быстро реагируют с кислородом и дают соединения Со:О2 = 1:1 при низких температурах.
При повышении температуры до комнатной происходит необратимое окисление Со(II) и получаются не способные к оксигенации порфириновые комплексы
Со(III). Синтез комплексов кобальта со стерически затрудненными частокольными
порфиринами — перспективный путь улучшения свойств этих
синтетических переносчиков кислорода. Большинство соединений Со(II) с порфиринами растворяется и реагирует с О2 в неводных растворителях,
причем в полярных апротонных растворителях образуются более прочные кислородные продукты, чем в растворе толуола. Координационные соединения
Со(II) с основаниями Шиффа являются первыми синтетическими переносчиками кислорода [5, 7, 8, 9].
Таким образом, ионы 3d-переходных металлов в низких степенях окисления образуют координационные соединения, способные обратимо реагировать с О2. Это свойство зависит от природы лигандов, внутренней координационной сферы ионов металлов. В состав ближайшего окружения иона металла входят преимущественно атомы азота, а также атомы кислорода, фосфора, иногда серы. Известны одноядерные (М:О2 = 1:1) и двуядерные (М:О2 = 2:1) координационные соединения 3d-переходных металлов с О2. Последние чаще встречаются у металлов конца ряда. Большинство синтетических переносчиков кислорода представляет собой координационные соединения Со(II). На их основе получены наиболее эффективные переносчики О2 в твердом состоянии (координационные соединения Со(II) с основаниями Шиффа) и в растворах (комплексы кобальта с гистидином, ионом аминокислоты и гетероциклическими основаниями, полиазамакроциклическими лигандами) [1].
В общем виде образования дикислородных комплексов кобальта может быть передан следующей схемой (заряды ионов опущены) (рисунок 2.1):

Рисунок 2.1 — Механизм образования дикислородных комплексов
(анимация: 10 кадров, 7 повторений, 9 килобайт)
Уравнение (1) отвечает образованию моноядерного дикислородного комплекса. Если при этом не созданные благоприятные условия, которые стабилизируют моноядерный дикислородный комплекс, то он превращается в биядерный комплекс (уравнение (2)).
К стабилизирующим факторам, которые предотвращают образование биядерних комплексов, относятся: применение донорных растворителей с низкой диэлектрической константой; пространственные факторы, которые затрудняют димеризацию комплекса, низкая температура раствора, низкая концентрация комплекса; применение в качестве как лигандов макромолекулы, которые снижают возможность образования О2-мостика между двумя центральными ионами кобальта(II). В водных растворах образования дикислородных комплексов практически всегда приводит к образованию биядерных комплексов [3].
2.2 Исследование смешаннолигандной системы кобальта
Начало исследований процесса образования смешаннолигандных оксигенированных комплексов кобальта(II) было положено в 1980 г. работой, в которой рассмотрена оксигенация глицинатофенантролинового комплекса кобальта(II).
Затем последовали исследования процесса оксигенации комплексов кобальта(II) с дипиридилом, фенантролином и анионами других α-аминокислот (аланина, аминомасляной, норвалина, норлейцина, валина, лейцина и изолейцина). При исследовании этих комплексов впервые были предприняты попытки математического моделирования процессов образования биядерных бимостиковых комплексов. Была составлена схема основных равновесий процесса оксигенации комплексов кобальта(II), содержащих во внутренней координационной сфере два бидентатных лиганда и две молекулы воды (рисунок 2.2) [2]:
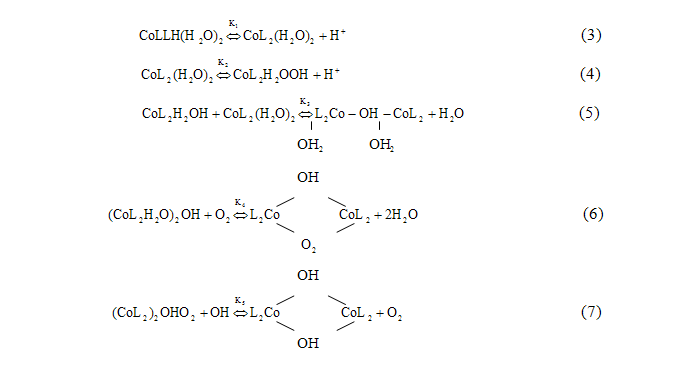
Рисунок 2.2 — Схема основных равновесий процесса оксигенации комплексов кобальта(II)
2,2’-дипиридил был синтезирован в конце 19-го столетия Блау. Молекула 2,2’-дипиридила (Dipy) представлена на рисунке 2.3:
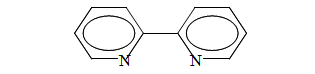
Рисунок 2.3 — Молекула 2,2’-дипиридила (Dipy)
Благодаря наличию в составе молекулы дипиридила двух атомов азота они в процессе образования комплексов с ионами металлов выступают как бидентатные лиганды. Причем, вместе с донорными свойствами дипиридил, как лиганд обладает значительными акцепторными свойствами.
Дипептиды — это соединения, которые состоят из двух остатков аминокислот, соединенных друг с другом пептидной связью. В водном растворе дипептиды существуют в виде цвиттер-ионов, в которых депротонирована карбоксильная группа и протонирована амино-группа (рисунок 2.4):
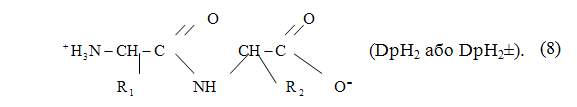
Рисунок 2.4 — Молекула дипептида
С помощью рН-потенциометрических исследований в инертной атмосфере было установлено, что в водных растворах смеси монодипиридилового комплексов кобальта(II) [CoAA(H2O)4]2+ и дипептидов происходит образование смешаннолигандных диаминдипептидних комплексов [11].
Калориметрически установлено, что дипептиды образуют смешаннолигандные комплексы с монодиаминовимы комплексами кобальта(II) только после депротонирования NH3+-группы дипептида. Таким образом, в исследованных системах устанавливается следующая равновесие (рисунок 2.5):

Рисунок 2.5 — Равновесие в системе кобальт(II)-дипептид
Для исследования смешаннолигандной системы кобальт(II)-аланилаланин-дипиридил-кислород используются уравнения химических реакций, полученные при исследовании однородных систем. Сюда входят реакции процесса комплексообразования в системе кобальт(II)-аланилаланин (7 реакций), кобальт-дипиридил (10 реакций), кобальт-аланилаланин-дипиридил (4 реакции), последние 11 реакций схемы — это реакции оборотного присоединения молекулярного кислорода однородными дипиридиловыми и аланилаланиловыми комплексами кобальта, а также смешаннолигандными комплексами кобальта [2].
3. Проведение эксперимента
Для исследования процесса комплексообразования и оксигенации в системе кобальт(II)-аланилаланин-дипиридил-кислород был применен рН-потенциометрический метод.
рН-метрически устанавливался состав комплексов, которые образуются в растворе, как в инертной атмосфере, так и в атмосфере воздуха.
В процессе проведения эксперимента проводилось титрование водных растворов смеси соли кобальта(II), дипиридила и аланилаланина (из аланилового ряда дипептидов), при мольном соотношении 1:1:1 и 1:1:2, при ионной силе 0,1 (KNO3), t = 25°C, в инертной атмосфере и атмосфере воздуха.
Схема установки для проведения рН-потенциометричних исследований представлена на рисунке 3.1.

Рисунок 3.1 — Схема установки для проведения рН-потенциометричних исследований
Как регистрирующий прибор использовался миливольтметр типа рН-121. Наладка рН-метра проводилась с использованием стандартных буферных растворов со значением рН 1,68, 4,01, 6,86, 9,18. Основная погрешность измерения миливольтметра типа рН-121 составляет ±0,05. Как электрод сравнения использовался хлоридсеребряный электрод типа ЕВЛ-1МЗ. Индикаторным электродом служил стеклянный электрод типа ЕСЛ-43-07. Реакционная ячейка (5) с раствором термостатируется водой, которая поступает из термостата (8) с помощью насоса, работающего от двигателя (9) мощностью 80 Вт, по резиновым шлангам. Температура в ячейке поддерживается постоянной и равна 25°С и контролируется двумя лабораторными термометрами (6) установленными на термостате и в ячейке. Для поддержки постоянной температуры на термостат был установлен контактный термометр (7), нагревание производится двумя тенами мощностью 200 и 400 Вт, отведение избытка тепла производится водопроводной водой через встроенный в термостат трубчатый теплообменник. Перемешивание осуществлялось барботажем газа или магнитной мешалкой (4).
При проведении исследований рН-потенциометрически в инертной атмосфере в реакционную ячейку (5) подается инертный газ из баллона (10), который содержит аргон ОЧ. При проведении рН-потенциометрических исследований в атмосфере воздуха, воздух подается компрессором (13), проходя очистку через хлоркальциеву трубку с аскарид (12) и осушитель (14) [10].
4. Результаты исследования
Во время исследования была составлена система уравнений для смешанолигандной системы Со(II)-Alaala-dipy-O2, проведено рН-потенциометрическое исследование смеси монодипиридилового комплекса кобальта(ІІ) и аланилаланина щелочью в атмосфере воздуха, данные исследования приведены в таблицах 4.1 и 4.2.
Таблица 4.1 — Данные рН-метрического титрования щелочью раствора смеси соли кобальта(II), аланилаланина и дипиридила (мольное соотношение 1:1:1) в атмосфере кислорода, при t = 25°С, μ = =0,1(KNO3), [O2] = 2,5 × 10-4 моль/дм3
| Исходный состав смеси | |
| Со(ІІ):Alaala:dipy = 1:1:1 | |
| VКОН, мл | рН |
| 0,05 | 7,23 ± 0,051 |
| 0,09 | 7,38 ± 0,052 |
| 0,11 | 7,47 ± 0,050 |
| 0,14 | 7,54 ± 0,061 |
| 0,17 | 7,60 ± 0,050 |
| 0,21 | 7,65 ± 0,053 |
| 0,28 | 7,74 ± 0,052 |
| 0,35 | 7,81 ± 0,064 |
Таблица 4.2 — Данные рН-метрического титрования щелочью раствора смеси соли кобальта(II), аланилаланина и дипиридила (мольное соотношение 1:2:1) в атмосфере кислорода, при t = 25°С, μ = =0,1(KNO3), [O2] = 2,5 × 10-4 моль/дм3
| Исходный состав смеси | |
| Со(ІІ):Alaala:dipy = 1:2:1 | |
| VКОН, мл | рН |
| 0,07 | 7,09 ± 0,052 |
| 0,14 | 7,25 ± 0,052 |
| 0,20 | 7,35 ± 0,059 |
| 0,26 | 7,42 ± 0,058 |
| 0,33 | 7,49 ± 0,062 |
| 0,41 | 7,55 ± 0,059 |
| 0,47 | 7,60 ± 0,060 |
| 0,54 | 7,66 ± 0,051 |
Общая схема равновесий процесса комплексообразования и оксигенации в смешаннолигандных системе кобальт(II)-аланилаланин-дипиридил-кислород в атмосфере воздуха включает 32 реакции. Необходимо последующее изучение свойств полученных в системе Co(II)-Alaala-dipy-O2 оксигенованных биядерных комплексов кобальта, с целью определения оптимальных условий их образования для последующего применения в качестве синтетических переносчиков кислорода.
Вывод
Во время проведения работы был рассмотрен процесс образования и оксигенации комплексов кобальта в смешанолигандной системе кобальт(ІІ)-дипиридил-аланилаланин. Были определены значения рН в этой системе в инертной атмосфере и в атмосфере воздуха. В дальнейшем планируется расчет констант равновесия, построение кривых распределения и расчет равновесных концентраций в исследуемой системе.
Полученные константы могут использоваться как самостоятельные справочные величины, а данные о наибольшей концентрации комплекса при каждом определенном рН могут быть использованы для получения необходимого комплекса — синтетического переносчика кислорода.
Список источников
- Братушко, Ю.И. Координационные соединения 3d-nepexoдных металлов с молекулярным кислородом / Ю.И. Братушко. — К.: Наук. Думка, 1987. — 168 с.
- Ганнова Ю.М., Фурман О.В., Катишева В.В. Визначення умов утворення октанованих комплексів в системі кобальт(II)-гліцилаланін-дипіридил // Наукові праці ДонНТУ. Серія: хімії і хімічна технологія. — 2013. — Вип. 2(21) — с.83–91
- Гринберг, А.А. Введение в химию комплексных соединений / А.А. Гринберг. — М.: Химия, 1971. — 371 с.
- Паладе Д.М. Кинетика и механизм образования оксигенированных комплексов кобальта // Коорд. химия. — 1992. — Т. 18, — №7 — С.729–749.
- Паладе Д.М. Определение кобальта в его комплексных соединениях // Ж. аналит. химии. — 1966. — Т.21. — С.377–378.
- Паладе Д.М., Линькова B.C. Чудаева Г. В. Оксигенация бисдипиридилового комплека кобальта(II) // Ж. Неорган. химии. — 1982. — Т.27, — № 9. — С. 2311 – 2315.
- Скурлатов Ю.И., Пурмаль А.П. Связывание О2 комплексами Со2+ с 2,2'-дипиридилом. — № 1474 — 70 Деп.: М. — 1969. — 19 с.
- Скурлатов Ю.И., Пурмаль А.П. Связывание О2 комплексами Со2+ с 2,2'-дипиридилом // Ж.физ.химии. — 1970. — Т.44. — С. 1364–1372.
- Эйхгорн, Г. Неорганическая биохимия / Г. Эйхгорн. — М.: Мир, 1978. — 737с.
- Ганнова Ю.Н., Шаповалов В.В., Фурман Е.В. Оксигенация в смешаннолегандной системе кобальт(II)-фенантролин-аланилаланин // Наукові праці ДонНТУ. Серія: хімії і хімічна технологія. — 2011. — Вип. 2(18) — с.15–21
- Краткая химическая энциклопедия. — М.: Советская энциклопедия, 1964 — Т.З. — 903 с.
