Реферат за темою випускної роботи
Зміст
- Вступ
- 1. Актуальність теми
- 2. Аналіз процесу електролізу як об’єкту управління
- 3. Мета та задачі дослідження
- 4. Моделювання САУ та аналіз показників якості регулювання
- Висновки
- Перелік посилань
Вступ
В даний час хлор в промислових масштабах отримують разом з гідроксидом натрію і воднем шляхом електролізу розчину кухонної солі. Застосовується три варіанти електрохімічного методу отримання хлору. Два з них електроліз з твердим катодом: діафрагмовий і мембранний методи, третій – електроліз з рідким ртутним катодом (ртутний метод виробництва).
При диафрагменном електролізі очищений від домішок і насичений по NaCl розсіл подається безпосередньо в електролізери. При цьому очищення розсолу від домішок проводиться при рН розсолу в інтервалі 9–11 од, а рекомендоване значення рН розсолу перед подачею в електролізери має бути 2,5–3,0 од.
При ртутному електролізі розчин NaCl (анолит), що випливає з електролізерів, перед поверненням його на електроліз проходить стадії обесхлоріваніія, донасищенія NaCl і фільтрації. Так само як і в диафрагменном методі, очищення розсолу від домішок проводиться при рН розсолу в інтервалі 9–11 од, а рекомендоване значення рН розсолу перед подачею в електролізери має бути 2,5–3,0 од.
Таким чином, у виробництві хлору і каустичної соди необхідно забезпечити автоматичне підтримання рН водних розчинів NaCl (аноліта і розсолу) на стадіях його підготовки і подачі безпосередньо на електроліз.
1. Актуальність теми
У виробництві хлору і каустичної соди необхідно забезпечити автоматичне підтримання рН водних розчинів NaCl (аноліта і розсолу) на стадіях його підготовки і подачі безпосередньо на електроліз. Зміна величини рН розсолу здійснюється шляхом зміни витрат кислоти (лугу), що подаються на відповідні вузли технологічного процесу. Як правило, вузли підкислення аноліта і розсолу і вузол подщелачивания аноліта так само, як і технологічні процеси нейтралізації стічних вод, є однотипними об'єктами регулювання. Типові схеми цих вузлів наведені на рис.1.1 а, б.
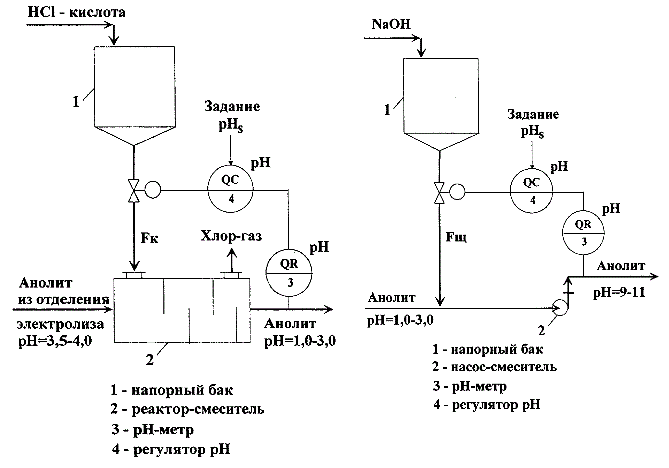
Рисунок 1.1 – Спосіб автоматичного регулювання величини pH водних розчинів: а) САР вузла підкислення аноліта (зліва); б) САР вузла підлугування аноліта (зправа)
Вузли включають баки – збірники кислоти або лугу (поз.1 на рис.1.1 а, б) щоб забезпечити безперервну подачу реагентів в реактори змішувачі. Як змішувачів можуть використовуватися як спеціальні апарати (поз.2, рис.1.1 а), так і, наприклад, відкачують насоси (поз.2, рис.1.1 б). Автоматичні системи регулювання (АСР) цих вузлів також однотипні. Як регульованих змінних використовується величина рН, яка вимірюється безпосередньо на об'єкті за допомогою рН метра (поз.3 на рис.1.1, б), регульована величина і завдання подаються на вхід регулятора величини рН (поз.4 на рис.1.1, б), а регулюючими впливами є витрати кислоти (F до ) або лугу (F щ ).
За умовами ведення технологічного процесу до систем регулювання рН пред’являються досить жорсткі вимоги до точності підтримки величини рН. Зазвичай ця величина складає ±(0,10–0,15) одиниць рН. Однак існуючі автоматичні системи регулювання не можуть забезпечити задану точність підтримки величини рН і, більш того, часто працюють в режимі автоколивань з неприпустимо великою амплітудою. У зв’язку з незадовільною якістю регулювання на більшості промислових підприємств безпосередньо на стадію електролізу подається не кислий, а лужної розсіл з рН = 11–12 од., Так як перекісленіе розсолу може привести до аварійної ситуації.
Незадовільна якість регулювання величини рН пов’язано з різко нелінійним характером залежності величини рН від концентрації кислоти або лугу в розчині [1]. При активності водневих іонів або іонів гідроксилу, рівних одиниці, ця залежність описується виразом:
| pH = -lgCHCl, | (1.1) |
де – CHCl – концентрація кислоти в розчині, моль/л
| pH = 14+lgCNaOH, | (1.2) |
де – CNaOH – концентрація лугу в розчині, моль/л.
Ця залежність наведена на рисунку 1.2, де для того, щоб ці два графіка поєднати на одному рисунку, концентрація кислоти умовно прийнята негативною.
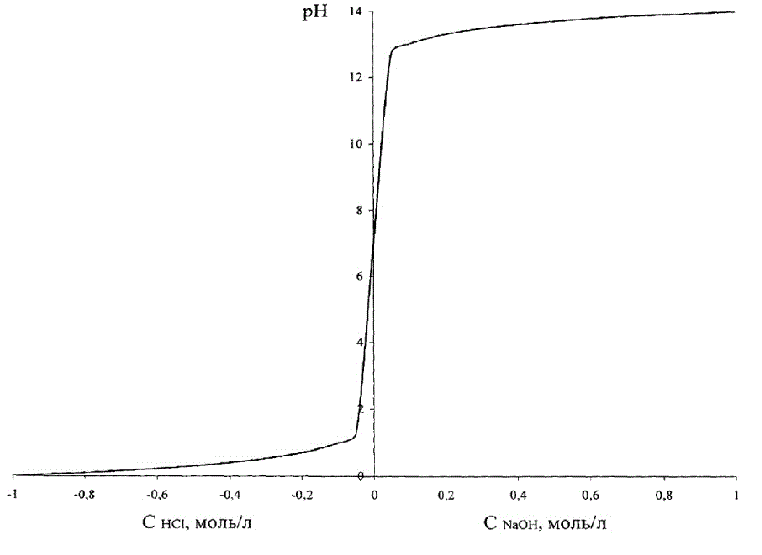
Рисунок 1.2 – Залежність рН розчину від кислоти (лугу)
З рис.1.2 видно, що зміна рН при зміні концентрації кислоти – лугу має вигляд S-подібної кривої з насиченням, симетричною відносно нейтрального середовища, відповідної рН = 7,0 од.
Зауважимо, що вся область значень рН = 0–14 відповідає дуже невеликим абсолютним значенням концентрацій кислоти/лугу.
Тому технологічні вимоги, наприклад, підтримувати рН розсолу, рівним 2–3 од., Відповідає вимозі підтримувати концентрацію кислоти в розчині в діапазоні (0,04–0,36) г/л, тобто повинна забезпечуватися дуже висока абсолютна точність регулювання малих значень концентрацій кислоти [2]. Такі ж залежності характерні для лужних розчинів.
Оскільки витрата кислоти або лугу на кілька порядків менше витрати розсолу або аноліта, концентрація аноліта або лугу в потоці лінійно залежить від керуючого впливу – витрати кислоти або лугу. Отже, такий же нелінійний характер мають залежності величини рН від керуючого впливу – витрат кислоти або лугу, що навіть визначається низька якість процесів регулювання рН.
Також, якщо проаналізувати узагальнену задачу регулювання рН, то відомий метод підвищення стійкості і якості регулювання рН за рахунок застосування двох регулюючих клапанів різного розміру, що дозволяє компенсувати нелінійність характеристики об'єкта в великому діапазоні зміни витрати реагенту (рис. 1.3).
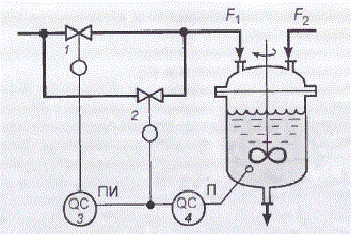
Рисунок 1.3 – Схема регулювання рН з двома регулюючими клапанами
Клапаном малого розміру (з малим умовним прохідним діаметром) 2 з рівнопропорційною видатковою характеристикою управляє П-регулятор 4, вихідний сигнал якого надходить також на вхід ПІ-регулятора 3, що має зону нечутливості. ПІ-регулятор управляє клапаном великого розміру 1 з лінійною видатковою характеристикою.
При невеликих відхиленнях pH від величини, що відповідає точці нейтралізації, коли коефіцієнт посилення об’єкту великий, командний сигнал П-регулятора виявляється в зоні нечутливості ПІ-регулятора. Вихідний сигнал ПІ-регулятора не змінюється і положення затвора великого клапана 1 залишається колишнім. Регулює процес нейтралізації здійснюється за допомогою малого клапана 2. Зміна командного сигналу регулятора призводить до невеликої зміни витрати реагенту F1, тобто коефіцієнт посилення виконавчого пристрою в цьому випадку малий.
Якщо значення pH сильно відхиляється від величини, що відповідає точці нейтралізації, тобто об’єкт працює в режимі, де його коефіцієнт посилення малий, то командний сигнал П-регулятора виходить із зони нечутливості ПІ-регулятора. При цьому затвор малого клапана займає одне з крайніх положень, а регулювання здійснюється за допомогою великого клапана. Зміна командного сигналу регулятора призводить до великої зміни витрати реагенту F1, тобто коефіцієнт посилення виконавчого пристрою в цьому випадку великий. Таким чином, зміна коефіцієнта посилення об’єкта компенсується зміною коефіцієнта посилення виконавчого пристрою. Природно, що повна компенсація зміни коефіцієнта посилення контуру регулювання може бути здійснена тільки при певному співвідношенні між величиною pH і ступенем відкриття обох клапанів (і великого, і малого розмірів) [3].
Таким чином, розробка способу автоматичного регулювання величини рН, що забезпечує високу статичну і динамічну точність підтримки заданої величини рН, а також підвищення показників ефективності процесу електролізу є актуальним завданням.
2. Аналіз процесу електролізу як об’єкту управління
Метою процесу регулювання є забезпечити підтримку pH водних розчинів NaCl (аноліта і розсолу) на стадіях його підготовки і подачі безпосередньо на електроліз. Зміна величини рН здійснюється шляхом зміни витрат кислоти (лугу), що подаються на відповідні вузли ТП.
Найкращі показники ефективності процесу електролізу (такі як напруга на електролізері, вихід за струмом та ін.) В діафрагменних і ртутних електролізерах досягаються при подачі в них підкисленого розсолу зі значеннями рН не вище 3,5 одиниць.
При диафрагменном електролізі очищений від домішок і насичений по NaCl розсіл подається безпосередньо в електролізери. При цьому очищення розсолу від домішок проводиться при рН розсолу в інтервалі 9–11 од, а рекомендоване значення рН розсолу перед подачею в електролізери має бути 2,5–3,0 од.
При ртутному електролізі розчин NaCl (анолит), що випливає з електролізерів, перед поверненням його на електроліз проходить стадії обесхлоріваніія, донасищенія NaCl і фільтрації. При цьому анолит перед обесхлоріваніем і розсіл, безпосередньо подається в електролізери, повинні подкисляемого, а перед донасищеніем анолит подщелачивают. Зокрема, анолит з рН 3,5–4,0 перед обесхлоріваніем повинен бути підкислити до рН = –3,0, потім перед донасищеніем і фільтрацією значення рН аноліта має становити 9–11 од. Значення рН розсолу перед подачею в електролізери має бути 2,5–3,0 од.
Як правило, вузли підкислення аноліта і розсолу, і вузол подщелачивания аноліта є однотипними об’єктами регулювання. Схема аналізу процесу електролізу як об’єкта управління з точки зору матеріальних потоків і їх матеріальних змінних представлена на рис.2.1.
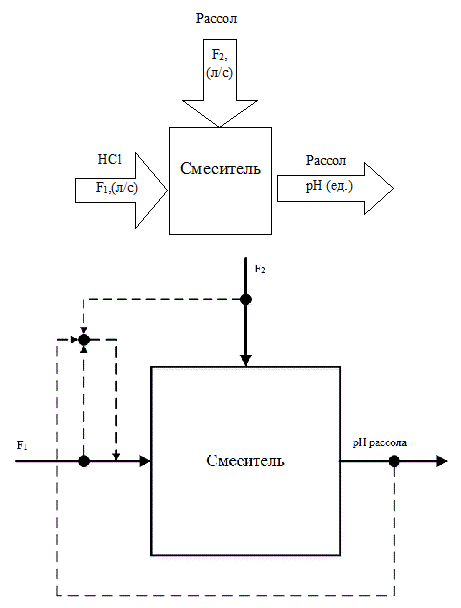
Рисунок 2.1– Схема аналізу процесу як об’єкта управління з точки зору матеріальних потоків і їх матеріальних змінних
З рис. 2.1 випливає, що зміна величини рН здійснюється шляхом зміни витрат кислоти (лугу), що подаються на відповідні вузли ТП. Виходячи з цього, в якості регульованої величини необхідно прийняти pH розсолу, а регулюючий вплив реалізувати зміною витрати кислоти F1.
Для поліпшення якості регулювання показника ефективності необхідно передбачити систему регулювання співвідношення витрат кислоти F1 в залежності від розходу розсолу F2.
Система автоматичного управління величини pH водних розчинів передбачає наявність в системі двох контурів. Зовнішній контур – це регулятор концентрації соляної кислоти, вихід якого коригує сигнал завдання по витраті соляної кислоти в співвідношенні з витратою розсолу. Внутрішній контур – регулятор співвідношення витрат, керуючий заслінкою на витрата соляної кислоти.
3. Мета та задачі дослідження
Для забезпечення високої статичної та динамічної точності підтримки заданої величини рН необхідно линеаризовать нелінійну залежність величини рН від концентрації кислоти або лугу (рис. 3.1), тобто фактично линеаризовать нелінійну характеристику датчика рН-метра. Лінійність системи буде забезпечена, якщо в якості регульованої величини використовувати не величину рН, а перетворене значення цієї величини, а саме зворотну функцію залежності величини рН від концентрації кислоти або лугу [4].
Для кислих розчинів перетворення здійснюється за виразом:
| CHCl = 10-pH, | (3.1) |
для лугових за виразом:
| CNaOH = 10pH-14, | (3.2) |
Вид цієї залежності наведений на рис. 3.1, де також концентрація кислоти умовно прийнята негативною.
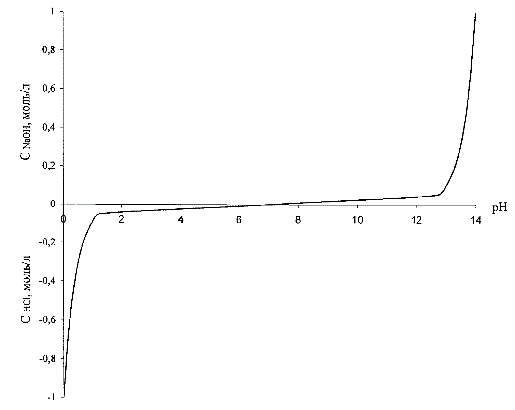
Рисунок 3.1 – Залежність концентрації кислоти (лугу) від рН розчину
Завдання регулятору має бути представлено в тих же одиницях, що і регульована величина. Тому сигнал завдання перед подачею на регулятор також повинен бути перетворений за вищенаведеними виразами (3.1–3.2).
З огляду на вищесказане, сформулюємо мету – підвищення ефективності процесу електролізу за рахунок розробки системи автоматичного управління, в якій в якості регульованої величини використовується не величина рН, а зворотна функція залежності величини рН від концентрації кислоти.
Для досягнення даної мети необхідно вирішити такі завдання:
1.Проаналізіровать технологічний процес виробництва хлору і каустичної соди і описати його як об’єкт управління з точки зору матеріальних потоків і їх інформаційних змінних;
2. Виконати аналіз існуючих САУ на предмет виявлення їх недоліків.
3. Побудувати структурну схему САУ, отримати математичні моделі ОУ і елементів САУ, синтезувати закон управління;
4. Довести працездатність САУ методами математичного моделювання і проаналізувати динаміку синтезується САУ.
4. Моделювання САУ та аналіз показників якості регулювання
У розробляється САУ буде використовуватися принцип управління за відхиленням з негативним зворотним зв’язком.
Цей принцип є одним з найбільш широко поширених принципів управління. Відповідно до цього принципу система управління спостерігає за об’єктом, на який впливають обурюють фактори. В результаті, в поведінці об’єкта виникають відхилення. Система управління відстежує спостерігаються параметри (змінні) і на основі спостережень створює алгоритм управління [5].
Система має два контури. Зовнішній контур – регулятор концентрації соляної кислоти, вихід якого коригує завдання по витраті соляної кислоти в співвідношенні з витратою розсолу. Внутрішній контур – регулятор співвідношення витрат, керуючий заслінкою на витрата соляної кислоти.
Відповідно до обраної ідеологією управління побудуємо структурну схему системи автоматичного управління величини pH в умовах виробництва хлору і каустичної соди.
Структурна схема САУ зображена на рис. 4.1.
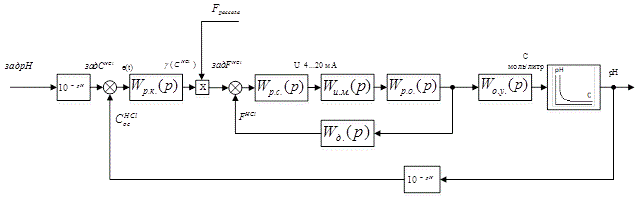
Рисунок 4.1 – Структурна схема управління величини pH
На даній структурній схемі:
Wр.к. (p) – ПФ регулятора концентрації HCl;
Wр.с.(p) – ПФ регулятора співвідношення;
Wи.м.(p) – ПФ виконавчого механізму;
Wр.о.(p) – ПФ регулюючого органу;
Wд. (p) – ПФ датчика витрати HCl;
W О.У.(p) – ПФ об’єкта управління.
Це каскадна схема з принципом підлеглого управління. На схемі присутні обчислювальні елементи, що виконують перетворення з pH в концентрацію кислоти.
Модель об’єкта управління представлена у вигляді нелінійної залежності pH від концентрації соляної кислоти.
Ця залежність наведена на рис. 4.2, де для того, щоб ці два графіка поєднати на одному малюнку, концентрація кислоти умовно прийнята негативною.
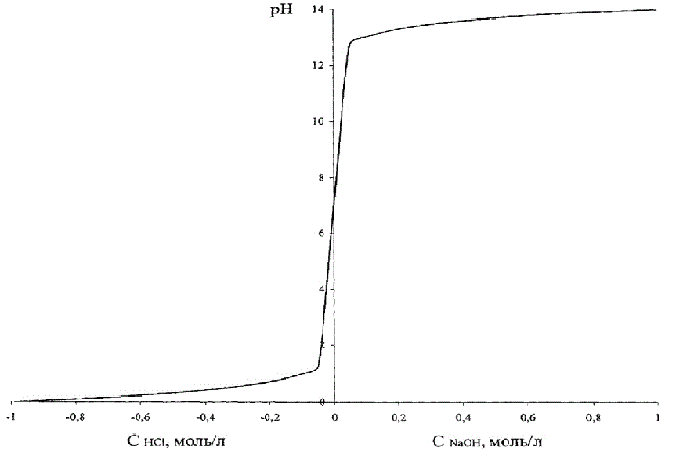
Рисунок 4.2 – Залежність рН розчину від кислоти (лугу)
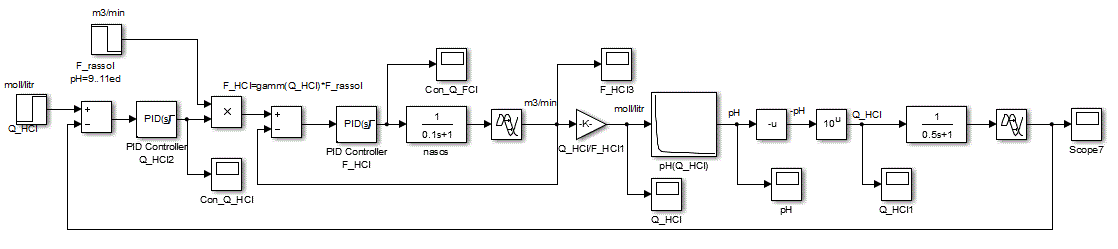
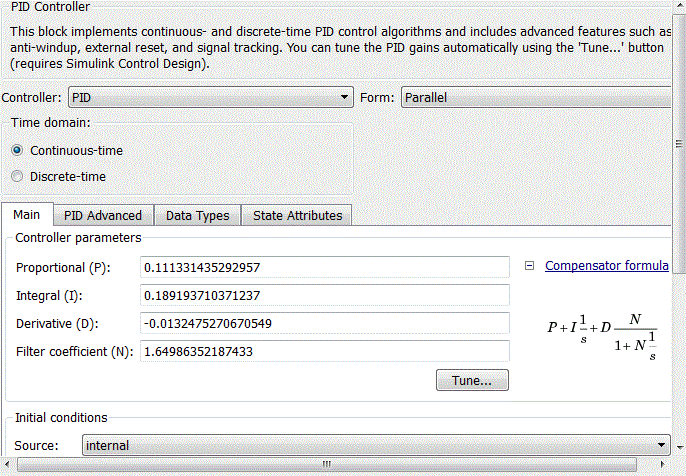
Нелінійну залежність рН розчину від концентрації кислоти можливо реалізувати за допомогою блоку LookUp Table пакета прикладних програм Matlab-Simulink, наведеного на рис. 4.4. У рядках таблиці задані значення концентрації кислоти, а клітинах таблиці – відповідні значення рівня рН розчину.
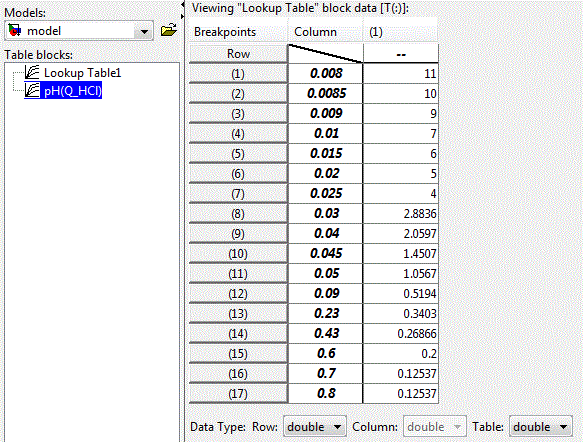
Рисунок 4.3 – Вікно настройки блоку LookUp Table
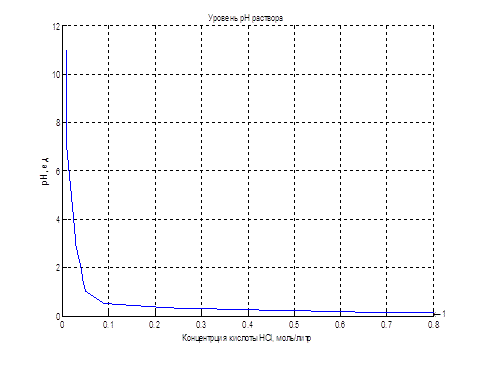
Рисунок 4.4 – Реалізація об’єкта управління за допомогою блоку LookUp Table
Оскільки ідеєю управління є лінійність системи за рахунок вибору в якості регульованої величини не величиною рН, а перетвореного значення цієї величини, а саме зворотної функції залежності величини рН від концентрації кислоти або лугу. Реалізуємо її обчислювальним чином за схемою моделювання, наведеної на рис. 4.5.
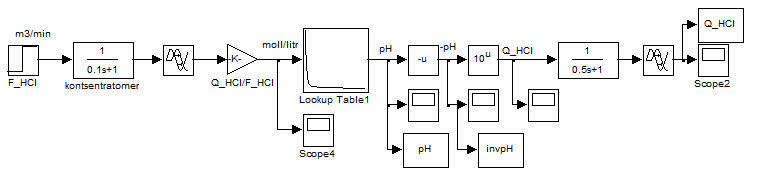
Рисунок 4.5 – Схема перетворення значення величини рН в зворотну функцію по формулі CHCl = 10-pH
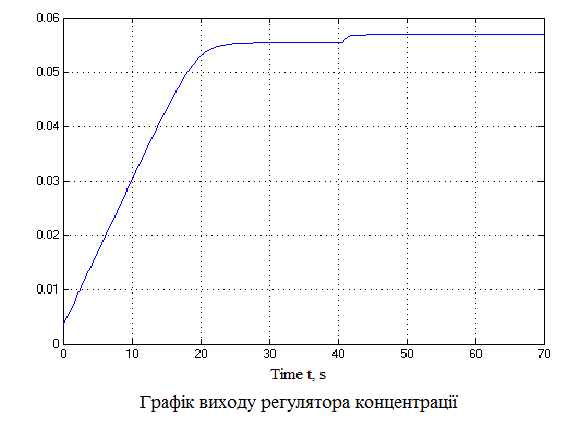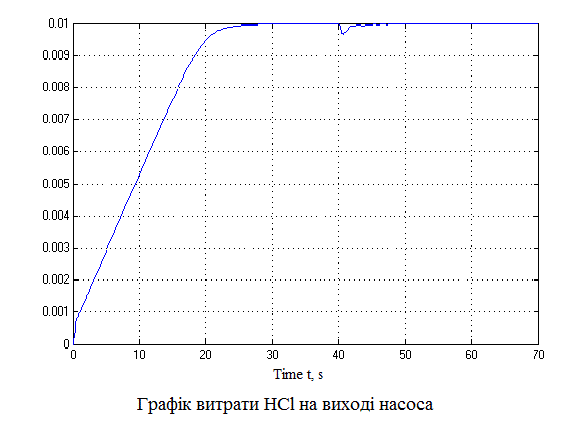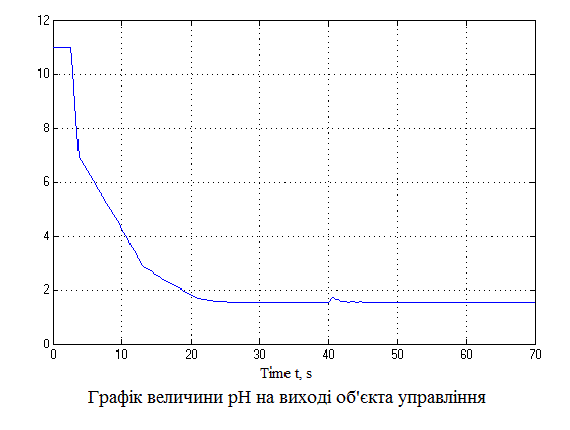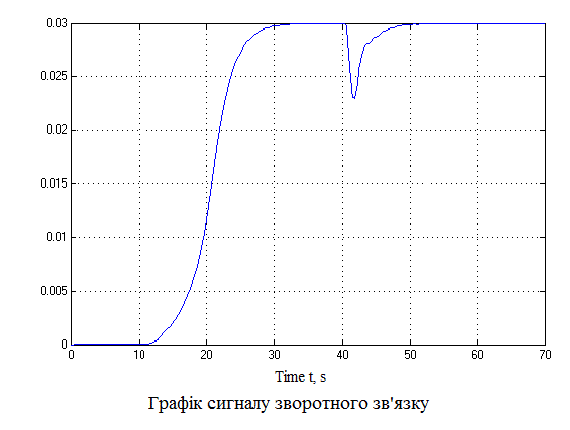
За даною схемою отримаємо графіки (рис.4.6), що пояснюють постановку задачі на управління.

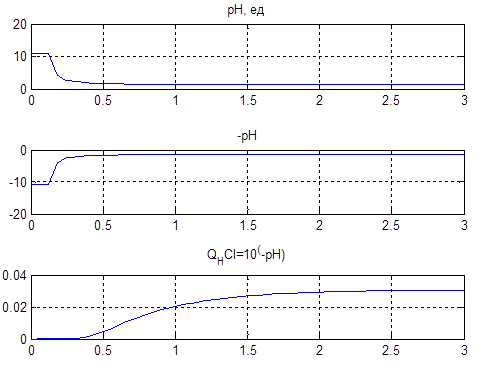
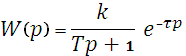 ,
,