Реферат по теме выпускной работы
Содержание
- Введение
- 1. Актуальность темы
- 2. Анализ процесса электролиза как объекта управления
- 3. Цель и задачи исследования
- 4. Моделирование САУ и анализ показателей качества регулирования
- Выводы
- Список источников
Введение
В настоящее время хлор в промышленных масштабах получают вместе с гидроксидом натрия и водородом путём электролиза раствора поваренной соли. Применяется три варианта электрохимического метода получения хлора. Два из них электролиз с твердым катодом: диафрагменный и мембранный методы, третий – электролиз с жидким ртутным катодом (ртутный метод производства).
При диафрагменном электролизе очищенный от примесей и насыщенный по NaCl рассол подается непосредственно в электролизеры. При этом очистка рассола от примесей проводится при рН рассола в интервале 9–11 ед, а рекомендуемое значение рН рассола перед подачей в электролизеры должно быть 2,5–3,0 ед.
При ртутном электролизе раствор NaCl (анолит), вытекающий из электролизеров, перед возвратом его на электролиз проходит стадии обесхлориваниия, донасыщения NaCl и фильтрации. Так же как и в диафрагменном методе, очистка рассола от примесей проводится при рН рассола в интервале 9–11 ед, а рекомендуемое значение рН рассола перед подачей в электролизеры должно быть 2,5–3,0 ед.
Таким образом, в производстве хлора и каустической соды необходимо обеспечить автоматическое поддержание рН водных растворов NaCl (анолита и рассола) на стадиях его подготовки и подачи непосредственно на электролиз.
1. Актуальность темы
В производстве хлора и каустической соды необходимо обеспечить автоматическое поддержание рН водных растворов NaCl (анолита и рассола) на стадиях его подготовки и подачи непосредственно на электролиз. Изменение величины рН рассола осуществляется путем изменения расходов кислоты (щелочи), подаваемых на соответствующие узлы технологического процесса. Как правило, узлы подкисления анолита и рассола и узел подщелачивания анолита так же, как и технологические процессы нейтрализации сточных вод, являются однотипными объектами регулирования. Типовые схемы этих узлов приведены на рис.1.1 а, б.
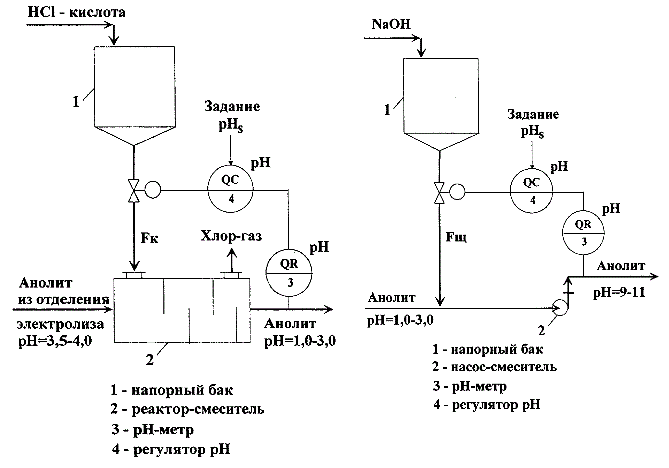
Рисунок 1.1 – Способ автоматического регулирования величины pН водных растворов: а) САР узла подкисления анолита (слева); б) САР узла подщелачивания анолита (справа)
Узлы включают баки – сборники кислоты или щелочи (поз.1 на рис.1.1 а, б) обеспечивающие непрерывную подачу реагентов в реакторы смесители. В качестве смесителей могут использоваться как специальные аппараты (поз.2, рис.1.1 а), так и, например, откачивающие насосы (поз.2, рис.1.1 б). Автоматические системы регулирования (АСР) этих узлов также однотипны. В качестве регулируемых переменных используется величина рН, измеряемая непосредственно на объекте с помощью рН метра (поз.3 на рис.1.1 , б), регулируемая величина и задание подаются на вход регулятора величины рН (поз.4 на рис.1.1 , б), а регулирующими воздействиями являются расходы кислоты (Fк) или щелочи (Fщ).
По условиям ведения технологического процесса к системам регулирования рН предъявляются достаточно жесткие требования к точности поддержания величины рН. Обычно эта величина составляет ±(0,10–0,15) единиц рН. Однако существующие автоматические системы регулирования не могут обеспечить заданную точность поддержания величины рН и, более того, зачастую работают в режиме автоколебаний с недопустимо большой амплитудой. В связи с неудовлетворительным качеством регулирования на большинстве промышленных предприятий непосредственно на стадию электролиза подается не кислый, а щелочной рассол с рН = 11–12 ед., так как перекисление рассола может привести к аварийной ситуации.
Неудовлетворительное качество регулирования величины рН связано с резко нелинейным характером зависимости величины рН от концентрации кислоты или щелочи в растворе [1]. При активности водородных ионов или ионов гидроксила, равных единице, эта зависимость описывается выражением:
| pH = -lgCHCl, | (1.1) |
где – CHCl – концентрация кислоты в растворе, моль/л
| pH = 14+lgCNaOH, | (1.2) |
где – CNaOH – концентрация щелочи в растворе, моль/л.
Эта зависимость приведена на рисунке 1.2, где для того, чтобы эти два графика совместить на одном рисунке, концентрация кислоты условно принята отрицательной.
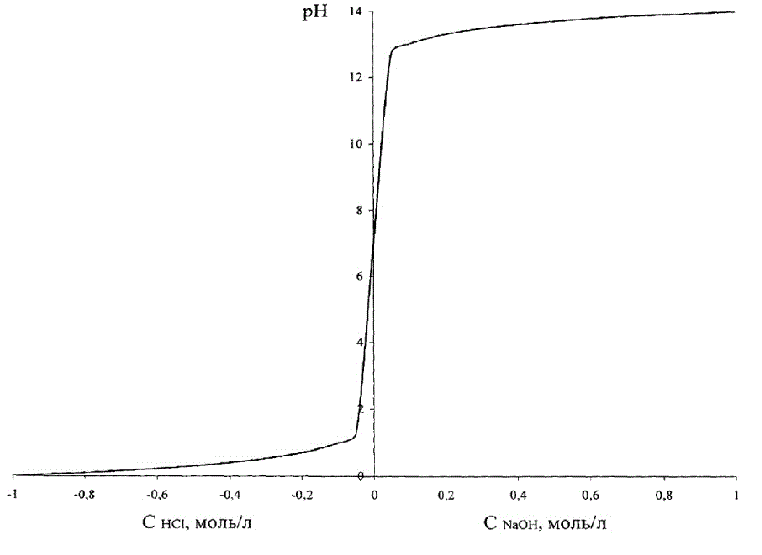
Рисунок 1.2 – Зависимость рН раствора от кислоты (щелочи)
Из рис. 1.2 видно, что изменение рН при изменении концентрации кислоты – щелочи имеет вид S-образной кривой с насыщением, симметричной относительно нейтральной среды, соответствующей рН = 7,0 ед.
Заметим, что вся область значений рН = 0–14 соответствует очень небольшим абсолютным значениям концентраций кислоты/щелочи.
Поэтому технологические требования, например, поддерживать рН рассола, равным 2–3 ед., соответствует требованию поддерживать концентрацию кислоты в растворе в диапазоне (0,04–0,36) г/л, то есть должна обеспечиваться очень высокая абсолютная точность регулирования малых значений концентраций кислоты [2]. Такие же зависимости характерны для щелочных растворов.
Поскольку расход кислоты или щелочи на несколько порядков меньше расхода рассола или анолита, концентрация анолита или щелочи в потоке линейно зависит от управляющего воздействия – расхода кислоты или щелочи. Следовательно, такой же нелинейный характер имеют зависимости величины рН от управляющего воздействия – расходов кислоты или щелочи, чем и определяется низкое качество процессов регулирования рН.
Также, если проанализировать обобщенную задачу регулирования рН, то известен метод повышения устойчивости и качества регулирования рН за счет применения двух регулирующих клапанов разного размера, что позволяет компенсировать нелинейность характеристики объекта в большом диапазоне изменения расхода реагента (рис. 1.3).
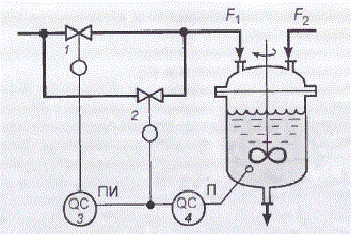
Рисунок 1.3 – Схема регулирования рН с двумя регулирующими клапанами
Клапаном малого размера (с малым условным проходным диаметром) 2 с равнопроцентной расходной характеристикой управляет П-регулятор 4, выходной сигнал которого поступает также на вход ПИ-регулятора 3, имеющего зону нечувствительности. ПИ-регулятор управляет клапаном большого размера 1 с линейной расходной характеристикой.
При небольших отклонениях pH от величины, соответствующей точке нейтрализации, когда коэффициент усиления объекта велик, командный сигнал П-регулятора оказывается в зоне нечувствительности ПИ-регулятора. Выходной сигнал ПИ-регулятора не изменяется и положение затвора большого клапана 1 остаётся прежним. Регулирование процесса нейтрализации осуществляется с помощью малого клапана 2. Изменение командного сигнала регулятора приводит к небольшому изменению расхода реагента F1, то есть коэффициент усиления исполнительного устройства в этом случае мал.
Если значение pH сильно отклоняется от величины, соответствующей точке нейтрализации, то есть объект работает в режиме, где его коэффициент усиления мал, то командный сигнал П-регулятора выходит из зоны нечувствительности ПИ-регулятора. При этом затвор малого клапана занимает одно из крайних положений, а регулирование осуществляется с помощью большого клапана. Изменение командного сигнала регулятора приводит к большому изменению расхода реагента F1, то есть коэффициент усиления исполнительного устройства в этом случае велик. Таким образом, изменение коэффициента усиления объекта компенсируется изменением коэффициента усиления исполнительного устройства. Естественно, что полная компенсация изменения коэффициента усиления контура регулирования может быть осуществлена только при определённом соотношении между величиной pH и степенью открытия обоих клапанов (и большого, и малого размеров) [3].
Таким образом, разработка способа автоматического регулирования величины рН, обеспечивающего высокую статическую и динамическую точность поддержания заданной величины рН, а также повышение показателей эффективности процесса электролиза является актуальной задачей.
2. Анализ процесса электролиза как объекта управления
Целью процесса регулирования является обеспечить поддержание pH водных растворов NaCl (анолита и рассола) на стадиях его подготовки и подачи непосредственно на электролиз. Изменение величины рН осуществляется путем изменения расходов кислоты (щелочи), подаваемых на соответствующие узлы ТП.
Наилучшие показатели эффективности процесса электролиза (такие как напряжение на электролизере, выход по току и др.) в диафрагменных и ртутных электролизерах достигаются при подаче в них подкисленного рассола со значениями рН не выше 3,5 единиц.
При диафрагменном электролизе очищенный от примесей и насыщенный по NaCl рассол подается непосредственно в электролизеры. При этом очистка рассола от примесей проводится при рН рассола в интервале 9–11 ед, а рекомендуемое значение рН рассола перед подачей в электролизеры должно быть 2,5–3,0 ед.
При ртутном электролизе раствор NaCl (анолит), вытекающий из электролизеров, перед возвратом его на электролиз проходит стадии обесхлориваниия, донасыщения NaCl и фильтрации. При этом анолит перед обесхлориванием и рассол, непосредственно подаваемый в электролизеры, должны подкисляться, а перед донасыщением анолит подщелачивается. В частности, анолит с рН 3,5–4,0 перед обесхлориванием должен быть подкислен до рН = 1,0–3,0, затем перед донасыщением и фильтрацией значение рН анолита должно составлять 9–11 ед. Значение рН рассола перед подачей в электролизеры должно быть 2,5–3,0 ед.
Как правило, узлы подкисления анолита и рассола, и узел подщелачивания анолита являются однотипными объектами регулирования. Схема анализа процесса электролиза как объекта управления с точки зрения материальных потоков и их материальных переменных представлена на рис. 2.1.
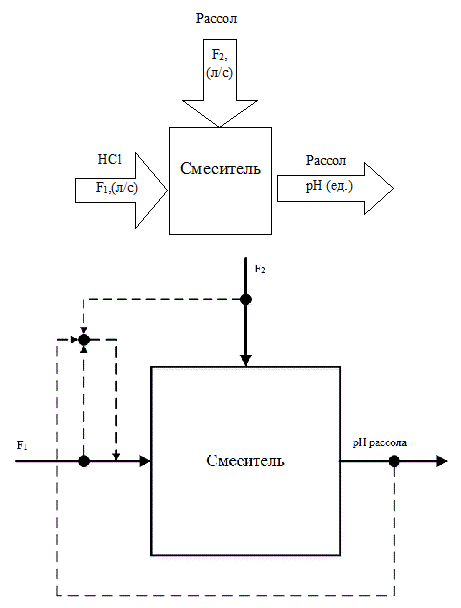
Рисунок 2.1 – Схема анализа процесса как объекта управления с точки зрения материальных потоков и их материальных переменных
Из рис. 2.1 следует, что изменение величины рН осуществляется путем изменения расходов кислоты (щелочи), подаваемых на соответствующие узлы ТП. Исходя из этого, в качестве регулируемой величины необходимо принять pH рассола, а регулирующее воздействие реализовать изменением расхода кислоты F1.
Для улучшения качества регулирования показателя эффективности необходимо предусмотреть систему регулирования соотношения расхода кислоты F1 в зависимости от расхода рассола F2.
Система автоматического управления величины pH водных растворов предусматривает наличие в системе двух контуров. Внешний контур – это регулятор концентрации соляной кислоты, выход которого корректирует сигнал задания по расходу соляной кислоты в соотношении с расходом рассола. Внутренний контур – регулятор соотношения расходов, управляющий заслонкой на расход соляной кислоты.
3. Цель и задачи исследования
Для обеспечения высокой статической и динамической точности поддержания заданной величины рН необходимо линеаризовать нелинейную зависимость величины рН от концентрации кислоты или щелочи (рис. 3.1), то есть фактически линеаризовать нелинейную характеристику датчика рН-метра. Линейность системы будет обеспечена, если в качестве регулируемой величины использовать не величину рН, а преобразованное значение этой величины, а именно обратную функцию зависимости величины рН от концентрации кислоты или щелочи [4].
Для кислых растворов преобразование осуществляется по выражению:
| CHCl = 10-pH, | (3.1) |
для щелочных по выражению:
| CNaOH = 10pH-14, | (3.2) |
Вид этой зависимости приведен на рис. 3.1, где также концентрация кислоты условно принята отрицательной.
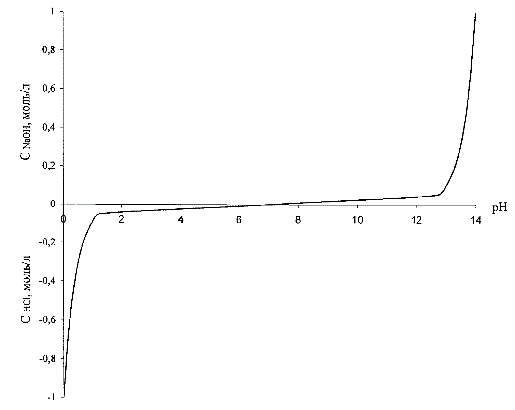
Рисунок 3.1 – Зависимость концентрации кислоты (щелочи) от pН раствора
Задание регулятору должно быть представлено в тех же единицах, что и регулируемая величина. Поэтому сигнал задания перед подачей на регулятор также должен быть преобразован по вышеприведенным выражениям (3.1–3.2).
Учитывая вышесказанное, сформулируем цель – повышение эффективности процесса электролиза за счёт разработки системы автоматического управления, в которой в качестве регулируемой величины используется не величина рН, а обратная функция зависимости величины рН от концентрации кислоты.
Для достижения данной цели необходимо решить следующие задачи:
1. Проанализировать технологический процесс производства хлора и каустической соды и описать его как объект управления с точки зрения материальных потоков и их информационных переменных;
2. Выполнить анализ существующих САУ на предмет выявления их недостатков.
3. Построить структурную схему САУ, получить математические модели ОУ и элементов САУ, синтезировать закон управления;
4. Доказать работоспособность САУ методами математического моделирования и проанализировать динамику синтезируемой САУ.
4. Моделирование САУ и анализ показателей качества регулирования
В разрабатываемой САУ будет использоваться принцип управления по отклонению с отрицательной обратной связью.
Этот принцип является одним из наиболее широко распространенных принципов управления. В соответствии с этим принципом система управления наблюдает за объектом, на который воздействуют возмущающие факторы. В результате, в поведении объекта возникают отклонения. Система управления отслеживает наблюдаемые параметры (переменные) и на основе наблюдений создает алгоритм управления [5].
Разрабатываемая система имеет два контура. Внешний контур – регулятор концентрации соляной кислоты, выход которого корректирует задания по расходу соляной кислоты в соотношении с расходом рассола. Внутренний контур – регулятор соотношения расходов, управляющий заслонкой на расход соляной кислоты.
В соответствии с выбранной идеологией управления построим структурную схема системы автоматического управления величины pH в условиях производства хлора и каустической соды.
Структурная схема разрабатываемой САУ изображена на рис. 4.1.
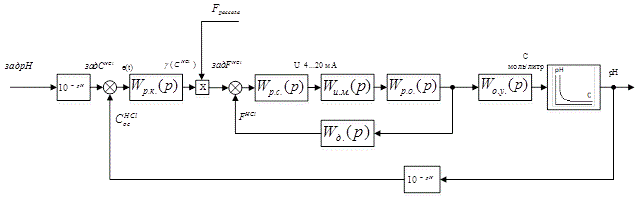
Рисунок 4.1 – Структурная схема управления величины pH
На данной структурной схеме:
Wр.к.(p) – ПФ регулятора концентрации HCl;
Wр.с.(p) – ПФ регулятора соотношения;
Wи.м.(p) – ПФ исполнительного механизма;
Wр.о.(p) – ПФ регулирующего органа;
Wд.(p) – ПФ датчика расхода HCl;
Wо.у.(p) – ПФ объекта управления.
Это каскадная схема с принципом подчинённого управления. На схеме присутствуют вычислительные элементы, выполняющие преобразование из pH в концентрацию кислоты.
Модель объекта управления представлена в виде нелинейной зависимости pH от концентрации соляной кислоты.
Эта зависимость приведена на рис. 4.2, где для того, чтобы эти два графика совместить на одном рисунке, концентрация кислоты условно принята отрицательной.
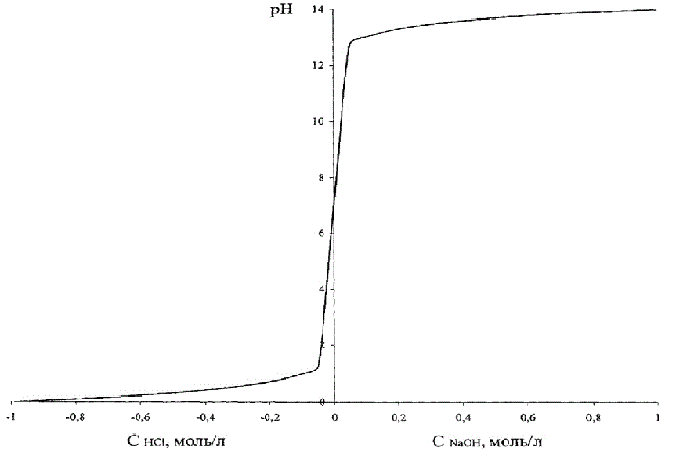
Рисунок 4.2 – Зависимость рН раствора от кислоты (щелочи)
Нелинейную зависимость рН раствора от концентрации кислоты возможно реализовать с помощью блока LookUp Table пакета прикладных программ Matlab-Simulink, приведенного на рис. 4.4. В строках таблицы заданы значения концентрации кислоты, а клетках таблицы – соответствующие значения уровня рН раствора.
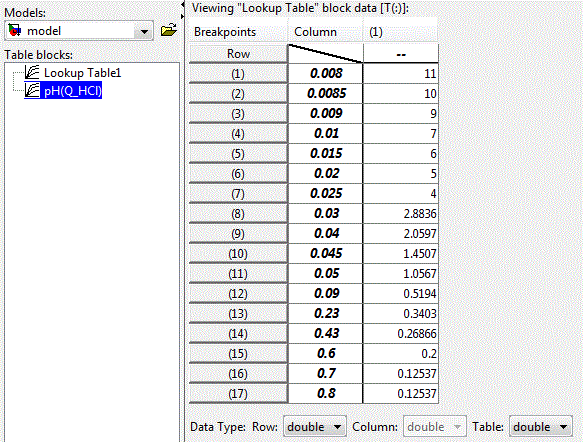
Рисунок 4.3 – Окно настройки блока LookUp Table
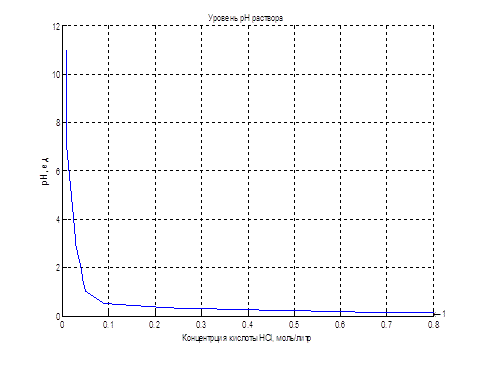
Рисунок 4.4 – Реализация объекта управления с помощью блока LookUp Table
Поскольку идей управления является линейность системы за счет выбора в качестве регулируемой величины не величины рН, а преобразованного значения этой величины, а именно обратной функции зависимости величины рН от концентрации кислоты или щелочи. Реализуем ее вычислительным образом по схеме моделирования, приведенной на рис. 4.5.
Рисунок 4.5 – Схема преобразования значения величины рН в обратную функцию по формуле CHCl = 10-pH
По данной схеме получим графики (рис.4.6), поясняющие постановку задачи на управление.
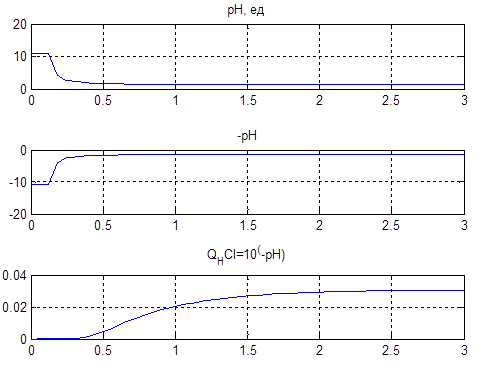
Рисунок 4.6 – Преобразование значения величины рН в обратную функцию по формуле CHCl = 10-pH
На нижнем графике рис. 4.6 по оси абсцисс расположена величина уровня раствора. То есть требуемый уровень рН раствора в 2…3 ед. соответствует линейному изменению концентрации кислоты от 0,02…0,03 моль/литр.
Далее рассмотрим математические модели элементов САУ. Математическая модель насоса будет реализована в виде апериодического звена первого порядка с запаздыванием.
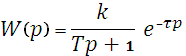 , , |
(4.1) |
где K – статический коэффициент передачи;
Т – постоянная времени;
τ – время запаздывания.
В разрабатываемой системе автоматического управления величины pH эти коэффициенты будут соответственно равны K = 1; Т = 0,1 с.;τ = 0,1 с.
Математическая модель pH-метра также будет реализована в виде апериодического звена первого порядка с запаздыванием. Коэффициенты которого будут равны K = 1; Т = 0,5 с.;τ = 0,5 с.
Построим и проанализируем динамику регулятора концентрации HCl и регулятора соотношения расхода соляной кислоты и рассола. Структурная схема САУ будет построена в соответствии с принципом по отклонению (рис. 4.7)
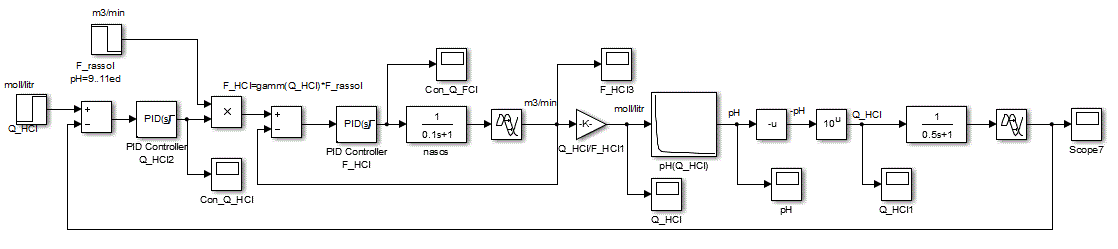
Рисунок 4.7 – Структурная схема моделирования САУ величины pH
Основная задача синтеза САУ заключается в выборе закона регулирования и определении настроечных параметров регулятора. Предполагается, опираясь на практический опыт автоматизации родственных ОУ, применить во внутреннем контуре ПИ-закон управления, а во внешнем контуре ПИД–закон, поскольку объект обладает инерционными свойствами с запаздыванием [6].
Значения параметров настройки, достаточно близкие к оптимальным, могут быть получены в результате исследования динамики замкнутой системы. В качестве метода нахождения настроечных параметров регулятора выберем метод автоматической настройки блока PID-control пакета моделирования Matlab, поскольку методы автоматической оптимизации являются мощным средством современных промышленных контроллеров. Метод автоматической настройки основывается на трех этапах: идентификации модели объекта, определении параметров регулятора и настройку параметров [7].
Выбор вышеупомянутого метода обусловлен тем, что параметры регулятора, определяемые по существующим и широко распространенным методикам Циглера и Никольса, а также CHR (Chien, Hrones и Reswick) затем настраиваются вручную или автоматически в процессе анализа динамики САР.
ПИ-регулятор внутреннего контура задаётся с помощью блока PID-controller со стандартной библиотеки Matlab Simulink. После стандартной настройки ПИ-регулятора в блоке PID-controller (рис. 4.8), коэффициенты пропорциональной и интегральной составляющих регулятора примут вид, представленный на рис. 4.9.
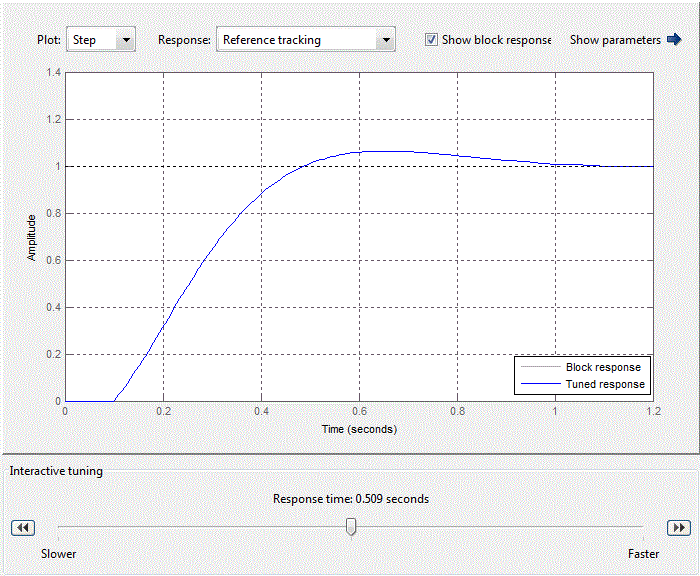
Рисунок 4.8 – Стандартная настройка блока PID-control
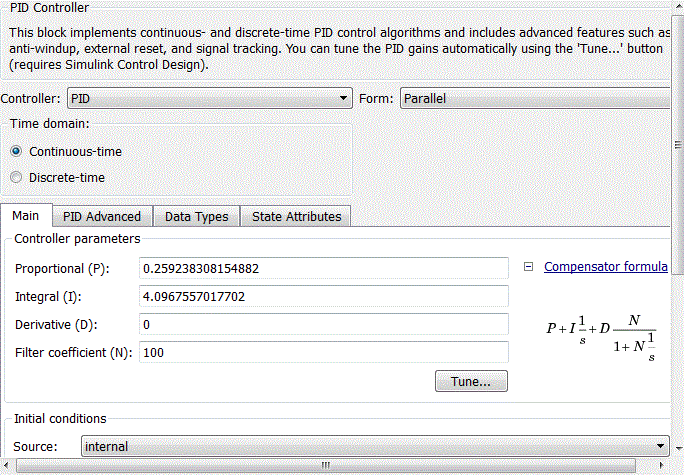
Рисунок 4.9 – Коэффициенты блока PID-controller
При настройке регулятора основное внимание уделяется отработке изменения сигнала уставки, так как контур регулирования расхода соляной кислоты в соотношении с расходом рассола является внутренним контуром САУ величины pH. Таким образом настроечные параметры ПИ-регулятора имеют следующие значения: Kp = 0,25924, Ki = 4,0968 обеспечивающие быстродействие, равное 0,509 с (рис.4.9).
ПИД-регулятор внешнего контура задаётся с помощью блока PID-controller со стандартной библиотеки Matlab Simulink. После стандартной настройки ПИД-регулятора в блоке PID-controller (рис. 4.10), коэффициенты пропорциональной, интегральной и дифференциальной составляющих примут вид, представленный на рис. 4.11.
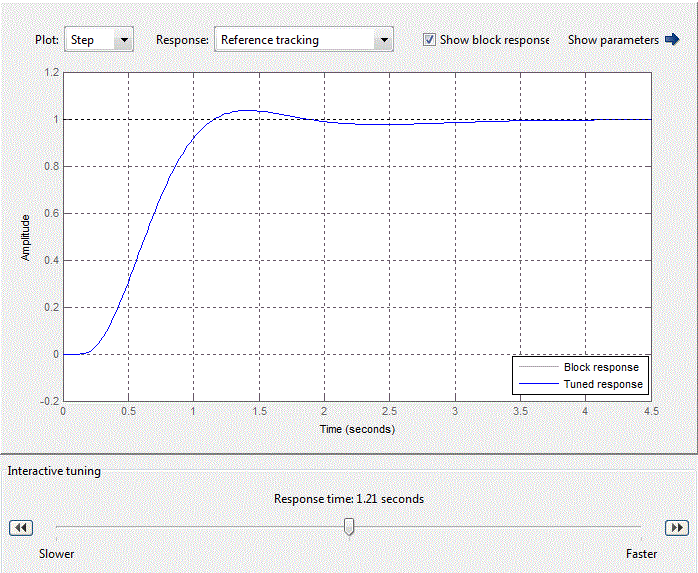
Рисунок 4.10 – Стандартная настройка блока PID-control
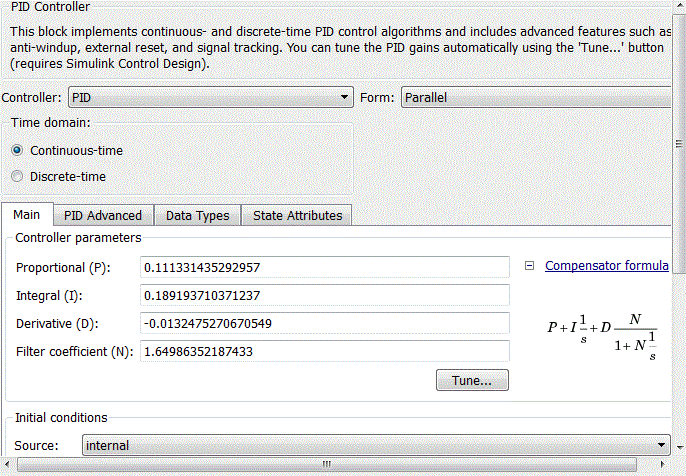
Рисунок 4.11 – Коэффициенты блока PID-controller
Выполним моделирование системы при полученных настройках регуляторов.
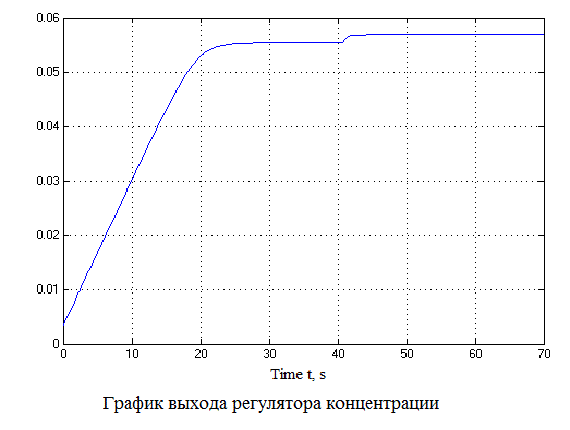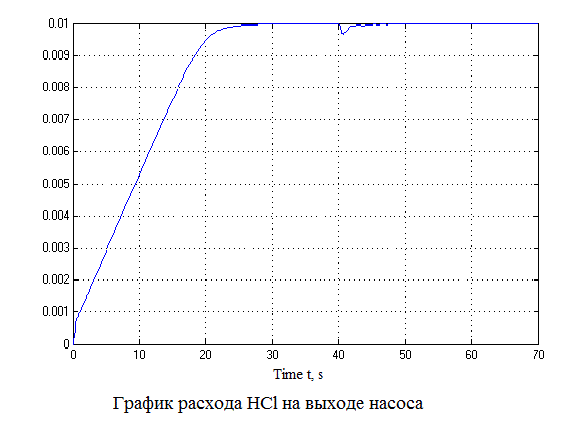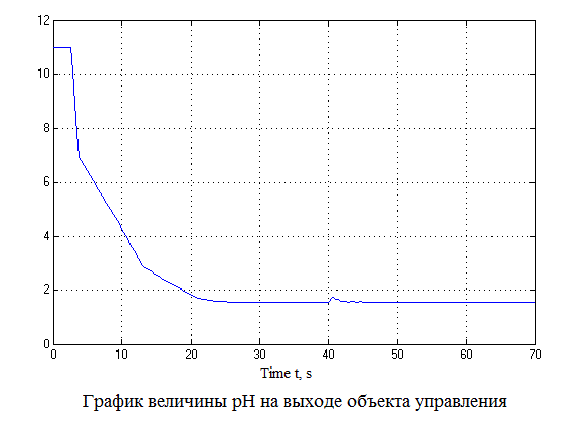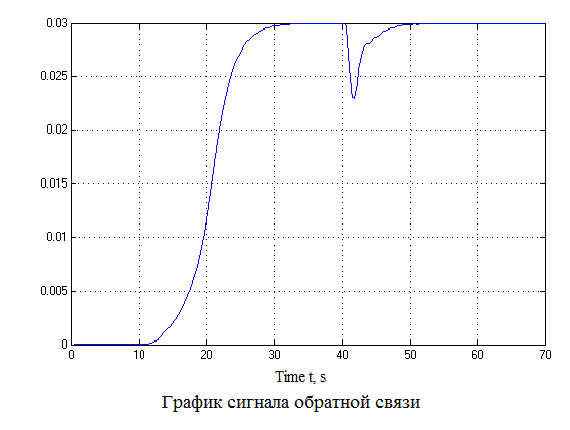
Рисунок 4.12 – Результаты моделирования САУ (анимация: 7 кадров, 7 циклов, 50 килобайт)
Проанализировав результаты моделирования видно, что перерегулирование составляет не более 1%, время регулирования составляет 35 с., что удовлетворяет требованиям системы.
Выводы
Проанализирована технологическая схема процесса получения хлора и каустической соды. Выполнен анализ технологического процесса как объекта управления.
Анализ существующих систем автоматического управления величины pH в условиях диафрагменного и ртутного электролиза позволил выявить недостатки и сформулировать цель работы.
Получено математическое описание САУ величины pH и элементов САУ. Построена структурная схема. Синтезированы регуляторы, расcчитаны коэффициенты для ПИ- и ПИД-регуляторов.
Результаты моделирования САУ подтвердили работоспособность системы в соответствие с требуемыми показателями качества регулирования.
При написании данного реферата магистерская работа еще не завершена. Окончательное завершение: май 2016 года. Полный текст работы и материалы по теме могут быть получены у автора или его руководителя после указанной даты.
Список источников
- Беспалов А. В., Харитонов Н. И. Системы управления химико-технологическими процессами. Учебное пособие для вузов. – М.:Академкнига, 2007 – 690 с.
- Беспалов А. В., Харитонов Н. И. Задачник по системам управления химико-технологическими процессами. Учебное пособие для вузов. – М.:Академкнига, 2007 – 690 с.
- Байназаров З. А., Бурдыгина С. В., Горин В. Н., Дмитриев Ю. К., Зайнетдинов Ф. Ф., Киселев А. П., Лернер А. С., Федоров А. М., Япрынцев В. Н.,Ярошевский В. В. Патент РФ № 2284048. Закрытое акционерное общество
Каустик
, 2006. - Дорф Р., Бишоп Р. Современные системы управления. – М.: Лаборатория Базовых Знаний. – 2002 – 832 с.
- Лукас В. А. Теория управления техническими системами. Учебный курс для вузов. Екатеринбург: Издательство УГГГА, 2002. – 675 с.
- Филлипс Ч., Харбор Р. Системы управления с обратной связью. – М.: Лаборатория Базовых Знаний, 2001 – 616 с.
- Денисенко В. ПИД – регуляторы: принципы построения и модификации. Статья, 8 с.
- Нестеров А. Л. Проектирование АСУТП. Методическое пособие. Книга 1.– СПб.: издательство ДЕАН, 2006. – 552 с.
- Нестеров А. Л. Проектирование АСУТП. Методическое пособие. Книга 2. – СПб.: Издательство ДЕАН, 2009. – 944 с.
- Simatic S7-300. Технические данные. Руководство. Издание 2004 – 308 с.
