Реферат по теме выпускной работы
Содержание
- Введение
- 1. Актуальность работы
- 2. Цель и задачи исследования
- 3. Механизм карбонизации части алюминатного раствора с образованием алюмокарбоната натрия и его превращение в гидроксид алюминия в реакции с раствором алюмината натрия.
- Выводы
- Список источников
Введение
Глинозем является основным исходным материалом для производства алюминия. Кроме этого он используется и в других сферах народного хозяйства: для производства специальных видов спеченной керамики и электрокорунда, высокоглиноземистой плотной и легковесной огнеупорной керамики. Также глинозем применяется для нанесения покрытий для защиты металлов от окисления, действия агрессивных сред и эрозийного износа. Еще глинозем добавляется в стеклянную шихту при варке разных сортов стекол: для производства электронно-лучевых телевизионных прямоугольных трубок и для стекол, стойких к радиоактивным излучениям и нейтронам, для оптических стекол, для производства жаропрочной посуды и стеклянных волокон и т.д.
Алюминий - один из важнейших стратегических металлов. Развитие авиации, судостроения, артиллерии, танкостроение требует применения большого количества алюминия и его сплавов. Алюминий замещает много цветных металлов, особенно медь на линиях электропередачи и в производстве разнообразной аппаратуры. Как заменитель свинца он применяется при производстве защитных оболочек кабелей, тюбиков и др. Алюминий широко применяется в строительстве гражданских сооружений. Затрата алюминия на строительство составляет, например, в Канаде около 30% от общего потребления, в США - свыше 20%, в Японии 14%. Значительное количество алюминия тратится для производства предметов домашнего быта, также упаковка и изготовление контейнеров.
Малая плотность алюминия, высокая электропроводность, пластичность и стойкость к коррозии позволяют использовать его в чистом виде и в сплавах с другими металлами в самых разнообразных отраслях промышленности.
Важнейшие области применения алюминиевых сплавов – машиностроение, электротехническая, автомобильная, химическая и металлургическая промышленности, водяной и железнодорожный транспорт, производство предметов народного потребления, жилищное строительство.
Сырьем для получения глинозема служат следующие минералы и руды: алуниты, каолины, нефелины и бокситы.
Получение глинозема из руд осуществляется тремя основными способами: электролитическим, кислотным и щелочным. Наиболее распространённым способом получения глинозема является щелочной метод Байера, в ходе которого оксид алюминия добывается из бокситов высокого сорта.
Однако определенным недостатком является трудность утилизации красных шламов, которые накапливаются в шламохранилищах.
Актуальность данной работы заключается и в том, что в промышленно развитом Донецком регионе существует потребность в утилизации геотехногенных отходов. Они, с одной стороны, содержат глинозем, а, с другой, представляют экологическую нагрузку на окружающую среду.
Среди возможных схем получения глинозема перспективен способ спекания с известняком или мелом. Так, в случае использования бесщелочного сырья получают саморассыпающиеся спеки, которые в дальнейшем перерабатывают щелочными методами, включающими стадии выщелачивания глинозема, обескремнивание, карбонизацию и кальцинацию.
Технология производства глинозема (Аl2О3) из отходов горнодобывающих предприятий включает следующие основные
- спекание сырья с известняком (CaCO3) с образованием алюмокальциевых соединений;
- выщелачивание спеков содовым раствором с получением раствора алюмината натрия;
- осаждение алюминия в виде гидроксидов;
- прокаливание продуктов с образованием глинозема.
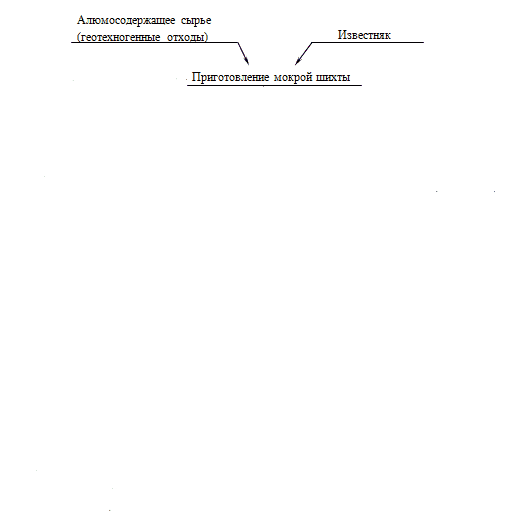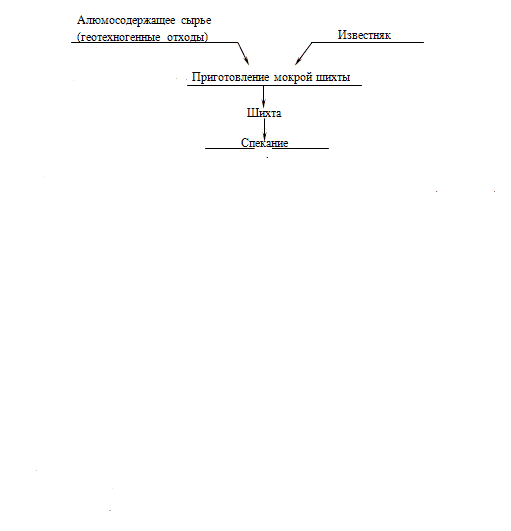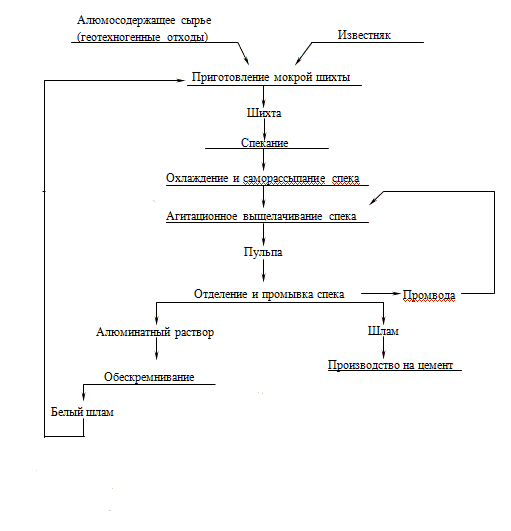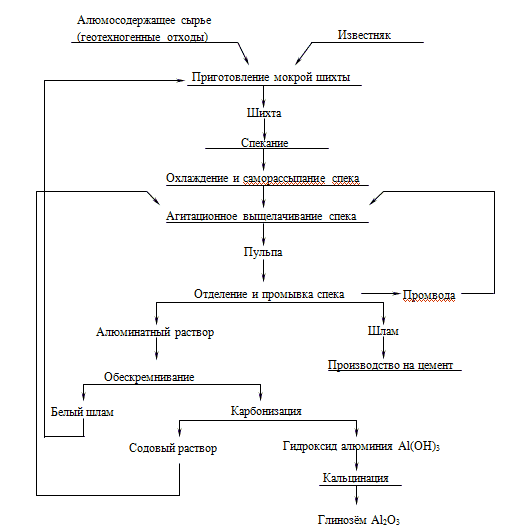
Рисунок 1 – Схема получения глинозема из алюминатных растворов
(анимация: 5 кадров, повторения неограничено, 300 килобайт)
1. Актуальность работы
Реализация способа требует использования такого дорогого компонента как сода, что является экономически нецелесообразным при переработке миллионов тонн отходов[1].
Для выделения Al(OH)3 целесообразно применение карбонизации, так как, наряду с гидроокисью алюминия, получается раствор соды, который используется как оборотный раствор[2].
В работе рассмотрена новая схема процесса карбонизации алюминатных растворов, включающая образование в качестве первичного продукта гидроалюмокарбоната натрия и последующее его превращение в гидроксид алюминия в реакции с алюминатом натрия[1].
2. Цель и задачи исследования
Главной целью является технологическое разделение алюминатного раствора во времени и пространстве. Процесс получения чистого гидроксида алюминия можно осуществить так, чтобы процесс карбонизации проходил с образованием ГАКН и получением из него Al(OH)3[3].
Задача состоит в получении экспериментальных данных, которые подтвердят новую схему процесса карбонизации алюминатных растворов [4].
3. Механизм карбонизации части алюминатного раствора с образованием алюмокарбоната натрия и его превращение в гидроксид алюминия в реакции с раствором алюмината натрия.
Содовые растворы разлагают алюмокальциевые спеки с переходом глинозема в жидкую фазу в виде алюмината натрия в соответствии со схемой [1]:
СаО•Al2O3 + Na2CO3 + 4 Н2О> 2 Na[Al(OH)4] + CaCO3
Извлечение соединений алюминия из алюминатных растворов с регенерацией соды можно осуществить методом карбонизации путем пропускания через растворы дымовых газов, содержащих повышенную концентрацию диоксида углерода СО2, что суммарно соответствует схеме:
2 Na[Al(OH)4] (р) + СО2(г) > 2 Al(OH)3 (тв) + Na2CO3(р) + Н2О,
где (р), (г), (тв) характеризуют агрегатное состояние компонента – раствор, газ, твердое [4].
Несмотря на кажущуюся простоту, на процесс карбонизации и главным образом – на качество получаемого гидрата окиси алюминия.
Установлен ряд факторов, которые способны так или иначе воздействовать на данный процесс, ускоряя или замедляя его. К числу таких факторов относятся следующие:
- концентрация раствора;
- каустический модуль раствора;
- температура раствора;
- содержание в растворе SiO2 и других примесей;
- присутствие в растворе гидроксида алюминия (затравки), преднамерен о введенной в этот раствор;
- обработка раствора CO2;
- механическое воздействие (перемешивание) [5].
Если загрязнение гидроокиси алюминия кремнеземом (SiO2) зависит от чистоты исходного алюминатного раствора, то на загрязнение гидроксида алюминия щелочью и, соответственно, ионами Na+ влияет совокупность многих факторов, поэтому природа (происхождение) щелочи в гидроксиде алюминия не столь проста[6].
В настоящее время общих точек зрения на природу алюминатных растворов окончательно не найдено, большинство исследователей отвергает взгляд на алюминатные растворы как на чисто коллоидную систему. С наибольшей вероятностью водный раствор алюмината натрия приходится рассматривать как истинный (ионный) раствор щелочной соли алюминиевой кислоты[4].
Сложная зависимость стойкости алюминатных растворов от концентрации, а также проявление алюминатными растворами в известной части коллоидных свойств заставляют наряду с этим все же предполагать, что в определенных условиях алюминатный раствор может, по-видимому, представлять и более сложную систему, чем только истинный раствор, одним из компонентов которой является золь гидроксида алюминия[7].
Так как важнейшие и общие для всех щелочных методов производства глинозема технологические процессы связаны с водными растворами алюмината натрия, необходимо рассмотреть наиболее существенные свойства этих растворов.
Важнейшей характеристикой алюминатного раствора служит его каустическое отношение или каустический модуль[2].
Выше мы указывали, что с химической точки зрении алюминат натрия можно рассматривать как щелочную соль алюминиевой кислоты. Однако водный раствор алюмината натрия обладает своеобразными свойствами, отличными от свойств водных растворов таких солей, как например, NaCl, Na2SО4, NaNО3. Это своеобразие заключается в том, что в алюминатном растворе с момента его получения непрерывно протекают процессы, которые неизменно через больший или меньший срок приводят к его распаду с выделением из раствора гидрата оксида алюминия, что значительно усложняет процесс карбонизации [6].
Cчитается, что основные причины загрязнения щелочью гидроксида алюминия являются вторичные процессы, такие как адсорбирование щелочи гидроксидом Al(OH)3 из маточного раствора, образование гидроалюмосиликата натрия и попадание щелочи между гранями отдельных кристаллов гидроокиси в их агрегатах. Примесь щелочи в гидроокиси алюминия, помимо ухудшения качества получаемого глинозема, увеличивает безвозвратные потери Na2CO3[7].
Предложена принципиально новая схема карбонизации алюминатных растворов, исходя из которой следует, что основная причина загрязнения гидроксида алюминия ионами Na4 с механизмом карбонизации и заключается в образовании на первой стадии карбонизации в качестве промежуточного вещества плохо растворимого гидроалюмокарбоната натрия (ГАКН) Na[Al(OH)2СО3]:
Na3[Al(OH)6](р) - Na[Al(OH)4](р) + 2 NaOH(р) ,
2 NaOH(р) + СО2(г) > Na2CO3(р) + Н2О,
Na3[Al(OH)6](р) + СО2(г) > Na[Al(OH)4](р) + Na2CO3(р).
Na[Al(OH)4] (р) + СО2(г) > Na[Al(OH)2СО3] (тв) + Н2О,
Na[Al(OH)2СО3] (тв) + Na[Al(OH)4] (р) > 2 Al(OH)3(тв) + Na2CO3(р).
Проведенное нами математическое моделирование кинетики реакций протекающих по схеме позволяет сделать следующие выводы:
- При карбонизации алюминатных растворов некоторая доля алюминия всегда выделяется в виде ГАКН.
- Увеличение скорости подачи углекислого газа и его концентрации увеличивает долю ГАКН.
- Увеличение температуры способствует образованию ГАКН.
- Увеличение времени карбонизации уменьшает содержание ГАКН и увеличивает содержание Al(OH)3 [7].
Интересно отметить, что данная схема полностью соответствует тем многочисленным экспериментальным данным, которые получены в [3].
Исходя из предложенной схемы следует, что процесс получения чистого гидроксида алюминия можно осуществить так, чтобы процесс карбонизации с образованием ГАКН и получением из него Al(OH)3 разделить технологически во времени и в пространстве.
Для подтверждения данного предположения необходимо полученный алюминатный раствор разделить на две части, одну из которой подвергнуть карбонизации при повышенной температуре и высокой концентрации СО2 в соответствии с уравнениями. Расчеты показывают, что при этом в осадок преимущественно выпадет ГАКН с примесью Al(OH)3 (рис.1 а), а раствор будет насыщаться содой Na2CO3.
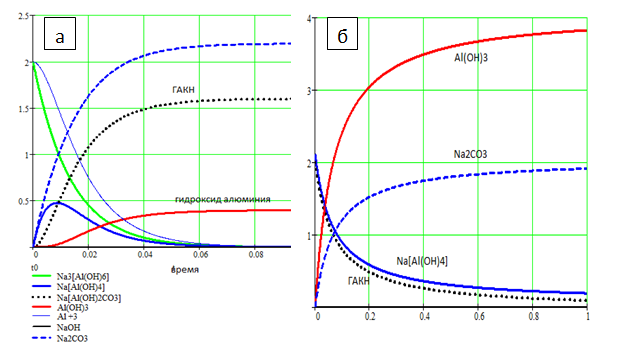
Рисунок 2 – Кинетические кривые образования ГАКН при карбонизации алюминатного раствора (а) и взаимодействия ГАКН с алюминатным раствором с образованием Al(OH)3 (б)
Выделеный осадок следует обработать второй частью раствора алюмината натрия, что приведет к полному превращению как ГАКН так и алюмината натрия в гидроксид алюминия Al(OH)3. Как следует из рис.1 б образование Al(OH)3 должно протекать пропорционально количеству образовавшейся в растворе соды.
Данный факт полностью подтверждается экспериментом. На рис.3 представлена экспериментальная зависимость количества образовавшейся в растворе соды при взаимодействии ГАКН с алюминатным раствором. Видно, что количество образующейся соды прямо пропорционально массе взятого ГАКН, то есть имеет место полное превращение ГАКН в гидроксид алюминия[7]p>
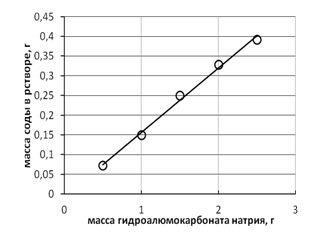
Рисунок 3 – Зависимость массы образующейся соды при взаимодействии гидроа-люмокарбоната натрия с алюминатным раствором. Объем раствора 25 см3.
Подтверждением того, что взаимодействие между ГАКН и алюминатом натрия протекает с образованием гидроксида алюминия являются данные ИК-спектроскопии, которые свидетельствуют о том, что ИК-спектр продукта взаимодействия (рис.3) полностью идентичен, как спектру Al(OH)3 реактивной чистоты, так и данным литературы (таблица).
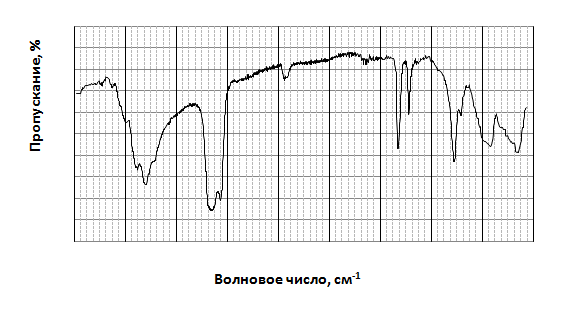
Рисунок 4 – ИК-спектр суспензии продукта полученного при взаимодействии ГАКН с алюминатным раствором в вазелиновом масле. Полосы при 2900 см-1 и 1400 см-1 – поглощение вазелинового масла.
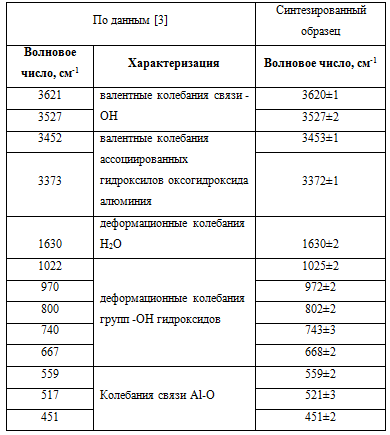
Таблица - данные ИК-спектроскопии Al(OH)3
Выводы
Главной причиной загрязнения гидроксида алюминия и получаемого из него глинозема при карбонизации алюминатных растворов является получение на первом этапе процесса гидроалюмокарбоната натрия. Опыт показывает, что для улучшение качества Al(OH)3 необходимо технологическое разделение процесса на стадию образования гидроалюмокарбоната натрия с последующей стадией переработки его в гидроксид алюминия действием алюминатного раствора. Не смотря на всю простоту процесса на первый взгляд, в данном процессе существует ряд факторов, влияющих на последующий выход Al(OH)3:
- с изменением концентрации алюминатного раствора скорость его распада изменяется. Исключительно велико влияние на стойкость алюминатного раствора его каустического модуля, с повышением которого стойкость раствора возрастает;
- cнижение температуры ускоряет распад алюминатного раствора, однако во всех случаях наибольшая скорость этого распада соответствует, примерно 30°, дальнейшее же снижение, а также значительное повышение температуры снова замедляет скорость распада алюминатного раствора;
- присутствие в растворе небольших количеств примеси SiO2, некоторых органических и коллоидных веществ повышает стойкость алюминатных растворов.
- введенная в раствор затравка свежеосажденного гидроксида алюминия, пропускание через раствор углекислоты и его механическое перемешивание, ускоряют разложение алюминатного раствора[8].
Уже этот краткий обзор факторов, влияющих на стойкость, а следовательно, и на поведение алюминатных растворов, показывает, что, с одной стороны, имеется ряд возможностей, которые позволяют воздействовать на эти растворы, повышая или понижая их стойкость с точки зрения выгоды в данных производственных условиях. С другой же стороны, наличие многочисленных факторов, могущих влиять на поведение алюминатных растворов, говорит, очевидно, о достаточной сложности процессов, протекающих в этих растворах, требуя их более глубокого исследования.
Вследствие протекания ряда последовательно-параллельных реакций карбонизация алюминатного раствора характеризуется высокой чувствительностью к различным факторам, что усложняет технологию получения качественного продукта[9].
Список источников
- Клименко, А.А. О возможности получения глинозема из отходов угле- и горнодобывающей промышленности методом спекания бесщелочного сырья с известняком / А.А.Клименко, В.Н.Вечерко, Л.И. Кукоба, В.В.Шаповалов, В.И. Ванин // Научные труды ДонНТУ. Серия: Химия и химическая технология. – 2012. – №19 (199). – С. 151-157.
- Ханамирова, А. А. Глинозем и пути уменьшения содержания в нем примесей / Ханамирова А. А., отв. ред. И.З. Певзнер. – Ереван: Изд-во АН АрмССР, 1983. – 243 с
- Клименко, А.А. К вопросу о механизме выделения гидроксида алюминия из растворов алюмината натрия / А.А.Клименко, В.В.Шаповалов, Т.В.Колесник, Т.В.Шаповалова, А.А.Осовская // Научные труды ДонНТУ. Серия: Химия и химическая технология. – 2013. – №1 (20). – С. 158-166.
- Колесник, И.В. Инфракрасная спектроскопия / И.В. Колесник, Н.А. Саполетова ? М.: МГУ, 2011.? 88 с.
- Лайнер, А. И. Производство глинозема / А. И. Лайнер, Н. И. Еремин, Ю. А. Лайнер. М.: Металлургия, 1978. 420 с.
- Мазель, В. А. Производство глинозема / В.А. Мазель. - М.: Металлургиздат, 1955. - 430 с.
- Клименко А.А. О возможности получения глинозема из отходов угле- и горнодобывающей промышленности методом спекания бесщелочного сырья с известняком / В.Н. Вечерко, Л.И. Кукоба, В.В. Шаповалов, В.И. Ванин // Наукові праці ДонНТУ. Серія: Хімія і хімічна технологія. 2012. Вип. 19(199). С. 151-157.
- Томилов Н.П. Об условиях образования гидроалюмокарбонатов при взаимодействии алюминия с растворами карбонатов щелочных металлов / Н.П. Томилов, А.С. Бергер, А.И. Бойкова // Ж. нерган. химии. - 1969. Т. 14, № 3. С. 674-680.
- Абрамов, В. Я. Физико-химические основы комплексной переработки алюминиевого сырья / В.Я. Абрамов, И.В. Николаев, Г.Д. Стельмакова. - М.: Металлургия, 1985. - 288 с.
