Реферат по теме выпускной работы
Содержание
- Введение
- 1 Актуальность
- 2 Анализ объекта измерения
- 2.1 Спектр поглощения и флуоресценции листьев растений
- 2.2 Методы измерения
- 2.3 Постановка задачи
- 3 Разработка структурной схемы
- 4 Макетный образец
- Список источников
Введение
Флуориметр, или люминометрический анализатор – это прибор, который позволяет определять концентрацию вещества по уровню возбуждаемого в них свечения. Принцип действия флуориметра основан на явлении флуоресценции – способности молекул излучать световые волны самостоятельно, либо делать это после химической реакции с другими веществами. Зная свечение разных соединений, можно выявлять их наличие в различных составах и веществах.
Хлорофилл – зеленый пигмент растений – непосредственно участвует в нескольких физиологических процессах. Изучая его флуоресценцию, мы косвенно изучаем другие уровни фотосинтеза, например, процессы на уровне пигментов, реакции движения электронов, темновые ферментные реакции и др [1]. Эти показатели часто являются определяющими для физиологического состояния растений. Проявление влияния стрессовых условий у растений происходит на том этапе, когда большинство физиологических процессов уже необратимы. Фотосинтез – наилучший индикатор для определения состояния растения на уровне клеток. Дело в том, что процесс фотосинтеза часто замедляется в растениях, подвергающихся влиянию даже кратковременных неблагоприятных условий – дефицит воды, температура, недостаток питательных веществ, конкуренция сорняков, проникновение возбудителей болезней[2, 3]. Следовательно, анализ параметров флуоресценции хлорофилла считается важным методом для оценки здоровья, внутренней целостности растения в пределах надземной части культуры. Это также быстрый и точный способ диагностики и определения степени устойчивости растения к неблагоприятным или стрессовым условиям.
1 Актуальность
В настоящее время на территории Донецкой области активно развивается сельское хозяйство и выращиваются различные виды культур.
Для выращивания качественной продукции зачастую недостаточно оценивать состояние растений органолептически.
Отклик растения на влияние стресс‑факторов (таких как засуха, избыточная влага, неприемлемый уровень рH и др.) в виде, к примеру,
пожелтевших листьев проявляется слишком поздно для принятия оперативных мер по корректировке стратегии выращивания.
Наиболее оперативным из ныне известных методов является метод оценки прохождения фотосинтеза путем измерения флуоресценции хлорофилла [4].
Данный метод предусматривает применение приборов‑флуориметров, которые облучают лист растения световым потоком,
а затем фиксируют отклик
растения с последующим анализом фиксируемых данных, позволяющим принять меры по оперативному устранению стресса.
Исходя из вышесказанного, актуальным является исследование флуориметрического метода оценки состояния растений.
В свою очередь для исследования данного метода существует необходимость в разработке устройства, способного фиксировать так называемую кривую Каутского,
анализ которой даст возможность определения влияния стресс‑факторов на растение.
Разрабатываемое устройство для регистрации флуоресценции хлорофилла в листьях растений даст возможность определить, как растение чувствует себя в определенных условиях, что поможет выявить и устранить факторы пагубного влияния на растение, спрогнозировать тенденцию развития урожая, смоделировать максимально возможную продуктивность культуры в имеющихся условиях и т. д.
2 Анализ объекта измерения
Флуоресценция хлорофилла – явление не очень сложное. Его суть заключается в способности зеленого пигмента – хлорофилла – поглощать, а потом излучать (отсвечивать) световую энергию и длинные волны света. Длительность такого излучения хлорофиллом определяется двумя факторами: количеством света, поглощенного растением, и уровнем конкуренции за световую энергию с другими энергетическими процессами, которые происходят в растении (в основном, это процессы образования новых веществ и отдачи тепла в растении). Если хлорофилл начинает меньше поглощать света, значит, его конкуренты получают световой энергии больше. Следовательно, изменения в интенсивности флуоресценции отражают изменения в эффективности образования новых веществ – будущего нашего урожая.
2.1 Спектр поглощения и флуоресценции листьев растений
Хлорофилл способен к избирательному поглощению света. Спектр поглощения данного соединения определяется его способностью поглощать свет определенной длины волны (определенного цвета). Он имеет две основные линии поглощения в красных и сине‑фиолетовых лучах (рис. 1). При этом хлорофилл a имеет максимум поглощения 429 и 660 нм, тогда как хлорофилл b – 453 и 642 нм. Однако необходимо учитывать, что в листе спектры поглощения хлорофилла меняются в зависимости от его состояния, степени агрегации, адсорбции на определенных белках [5]. В настоящее время показано, что есть формы хлорофилла, поглощающие свет с длиной волны 700, 710 и даже 720 нм. Эти формы хлорофилла, поглощающие свет с большой длиной волны, имеют особенно важное значение в процессе фотосинтеза.
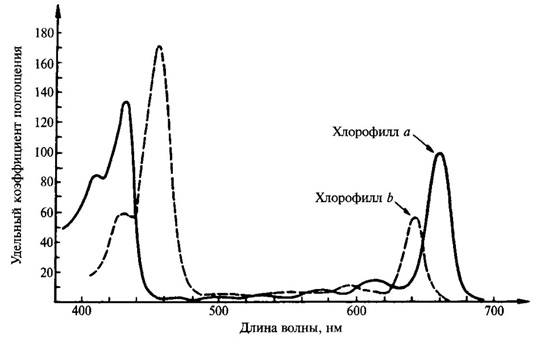
Рисунок 1 – Спектр поглощения хлорофилла a и b
Пигментный состав фотосинтетических антенных комплексов высших растений разнообразен. В него входят 2 вида хлорофиллов (Хл a, Хл b) и несколько видов каротиноидов (лютеин, виолоксантин, зеаксантин, неоксантин, β‑каротин), однако принято считать, что способностью к флуоресценции в естественных условиях обладают только молекулы Хл a, вследствие того, что вся энергия возбуждения, полученная другими пигментами антенны, передается на молекулы Хл a [8]. Спектр флуоресценции зеленого листа располагается в красной области длин волн (660 – 780 нм) и, как правило, имеют два широких максимума (рис. 2): один на длине волны 680 – 690 нм (F685), другой – на длине волны 730 – 740 нм (F740) [8, 9]. Основной вклад в длинноволновый пик спектра вносит реабсорбция длинноволновыми формами хлорофилла флуоресценции, испущенной более коротковолновыми формами [8, 9].
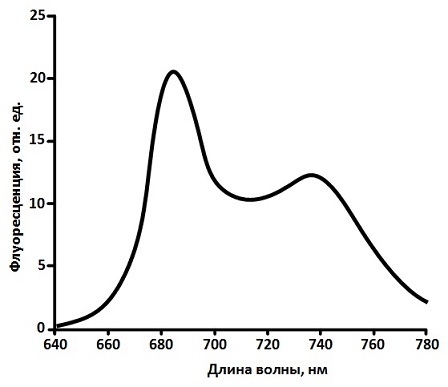
Рисунок 2 – Характерный спектр флуоресценции зеленого листа
2.2 Методы измерения
Наиболее практичными и часто используемыми методами измерения являются прямая регистрация флуоресценции (метод длительной индукции хлорофилла [6]) и модулированная флуоресценция (метод модуляции светового сигнала).
Прямая регистрация флуоресценции хлорофилла
Измерение производится после адаптации фотосинтезирующего объекта к темноте (около 20 – 30 мин), что определяет затухание
процессов,
связанных со световой фазой фотосинтеза. Затем образец освещается непрерывным светом длиной волны короче 670 нм.
С включением возбуждающего света фотоприемник регистрирует свет флуоресценции хлорофилла в диапазоне длин волн примерно от 680 нм до 760 нм.
По характеру кривой индукции флуоресценции можно судить о некоторых характеристиках фотосинтетического аппарата образца и динамике протекания
реакций фотосинтеза.
Описанный метод используется во флуориметрах, которые оценивают уровень стресса в растении (так называемый Plant Strеss Meter). Такие флуориметры могут регистрировать и анализировать кривые индукции флуоресценции хлорофилла за короткие времена облучения действующим светом, как правило – до 10 секунд, но измерение должно проводиться после темновой адаптации растения
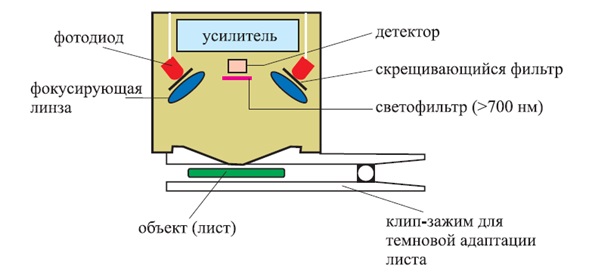
Рисунок 3 – Схема измеряющей головки флуориметра, использующего
При использовании этой методики определяются следующие параметры:
- Fo – начальная (нулевая) флуоресценция;
- FM – максимальный уровень флуоресценции;
- Fv = FM - Fo – переменная флуоресценция;
- Fv / FM – максимальная эффективность ФС2;
- TFM – время для достижения FM;
- AM – площадь поверхности над индукционной кривой флуоресценции хлорофилла.
Модулированная флуоресценция хлорофилла
При этом методе измерения свет включается на короткое время (1 – 3 мкс), этот интервал времени достаточен для определения импульса флуоресценции хлорофилла. На детектор этого аппарата попадают три вида световых сигналов:
- рассеянный от поверхности объекта действующий свет (непрерывное освещение);
- сигнал флуоресценции объекта, индуцированной действующим светом (непрерывный сигнал);
- импульсно‑индуцированный сигнал флуоресценции, возбуждаемой модулированным светом; именно этот сигнал флуоресценции усиливается в электронном виде, а другие, не импульсные сигналы, игнорируются.
Измерения могут проводиться на целых листьях или их частях, а также на суспензиях хлоропластов или клеток водорослей, адаптированных к темноте или на свету.
При использовании системы PAM [7] измерение начинается включением очень слабого импульсного луча модулированного излучения, ML (от англ. Modulated Light), который вызывает флуоресценцию хлорофилла. Источником ML являются светоизлучающие диоды (LED), которые испускают излучение в красной области спектра (как правило, λmax = 650 нм). Это излучение очень слабое и не вызывает индукционные процессы в листьях, а возбуждение флуоресценции хлорофилла происходит в основном из потерь энергии при ее миграции по антенне, и, следовательно, его значение можно принять за Fo (рис. 4). Затем включается насыщающий импульс SP (от англ. Saturating Pulse). Это короткий (например, 0,8 с) и очень мощный импульс света, интенсивность которого может доходить до 16000 мкмоль·м-2·с-1 (LED, λmax = 665 нм). Под влиянием редукции всех акцепторов в ФС 2 временно блокируются фотохимические реакции, в результате чего резко повышается выход флуоресценции. Интенсивность флуоресценции в предварительно адаптированном к темноте объекте достигает максимального значения (FM). После снижения уровня флуоресценции до исходного темнового значения Fo включается непрерывный действующий свет, AL (так называемый Actinic Light), с заданной плотностью потока фотосинтетически активных фотонов, PPFD (от англ. Photosynthetic Photon Flux Density), как правило – от 200 до 500 мкмоль·м-2·с-1 (LED, λmax = 665 нм). При этом наблюдается увеличение выхода флуоресценции, которая достигает максимального значения FP, характерного для данной интенсивности AL. В течение следующих нескольких минут эффективность флуоресценции уменьшается, достигая стационарного уровня FT, что означает уравновешивание всех реакций на различных этапах фотосинтеза.
После 240 секунд с момента включения освещения AL включается второй насыщающий импульс SP, который редуцирует акцепторы электронов ФС 2 и временно блокирует фотохимические реакции. Под влиянием этого импульса наблюдается повышение уровня флуоресценции до F'M, который ниже, чем FM. Разница между FM и F'M связана с нефотохимическим тушением флуоресценции. Измерения флуоресценции хлорофилла с использованием PAM флуориметров обеспечивает быструю оценку эффективности преобразования энергии фотонов ФАР в химическую энергию в процессе фотосинтеза исследуемых объектов и определение ряда важных параметров:
- F'o – начальная (нулевая) флуоресценция, измеренная в адаптированном к свету объекте;
- F'M – максимальная флуоресценция;
- F'v / F'M = (F'M - F'o) / F'M – максимальная эффективность первичной фотохимической реакции в адаптированном к свету объекте;
- ФФС2 = (F'M - F'T) / F'M – действительный квантовый выход фотохимических реакций в ФС 2 на свету;
- qP = (F'M - F'T) / (F'M - F'o) – фотохимическоe тушениe;
- qN = (FM - F'M) / (FM - Fo) – нефотохимическоe тушениe;
- ETR = ФФС2 × 0,50 × PPFDa = 0,84 × 0,50 × PPFDa – скорость линейного переноса электронов (здесь PPFDa означает скорость поглощения света образцом, выраженная в мкмоль·м-2·с-1).
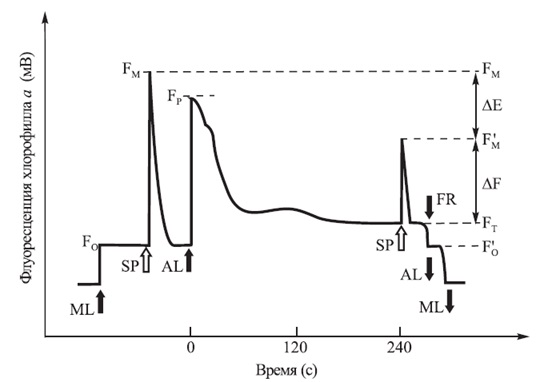
Рисунок 4 – Схематическое представление типичного эксперимента по определению фотосинтетической эффективности при измерении модулированной флуоресценции
- ML – модулированный измеряющий свет;
- SP – насыщающий импульс;
- AL – действующий свет;
- FR – близкий инфракрасный свет (дальний красный);
- FO – минимальная флуоресценция хлорофилла в адаптированных к темноте объектах;
- FM – максимальная флуоресценция хлорофилла в адаптированных к темноте объектах;
- FP – максимальная флуоресценция хлорофилла при возбуждении действующим светом;
- F'M – максимальная флуоресценция хлорофилла в адаптированных к свету объектах;
- FT – стационарный уровень флуоресценции хлорофилла в адаптированных к свету объектах;
- F'o – минимальная флуоресценция хлорофилла в адаптированных к свету объектах;
- ΔЕ = FM - F'M;
- ΔF = F'M - FT.
В проектируемом устройстве в качестве метода измерения выбран первый метод, а именно – прямая регистрация флуоресценции (метод длительной индукции(стимуляции) хлорофилла). Выбор этого метода обоснован сравнительной простой технической реализации, следовательно большей дешевизной относительно второго метода.
2.3 Постановка задачи
Задачей данной работы является разработка устройства для регистрации флуоресценции хлорофилла и её параметров в листьях наземных частей растений,
способное осуществлять измерение непосредственно в местах произрастания этих растений. Если рассматривать современные устройства флуориметры как прототип,
то задачей можно назвать разработку измерительного блока этого устройства, однако этот блок
способен работать самостоятельно,
управляясь при помощи специального программного обеспечения с ПК, следовательно его можно считать полноценным устройством.
Данное устройство, в отличии от потенциальных прототипов будет иметь значительно более низкую стоимость и простую конструкцию,
что сделает его доступным для рядовых пользователей и малых сельских хозяйств с низким бюджетом. Главное достоинство разрабатываемого устройства относительно
аналогов – доступность.
3 Разработка структурной схемы
Разрабатываемое устройство можно представить в виде следующей структурной схемы:
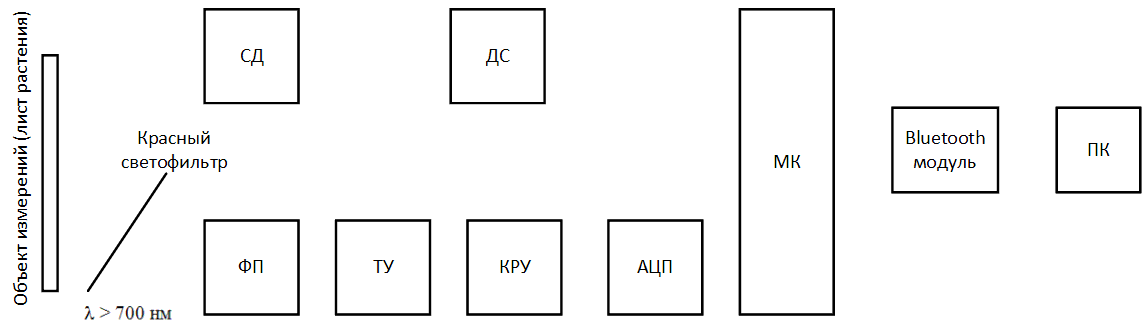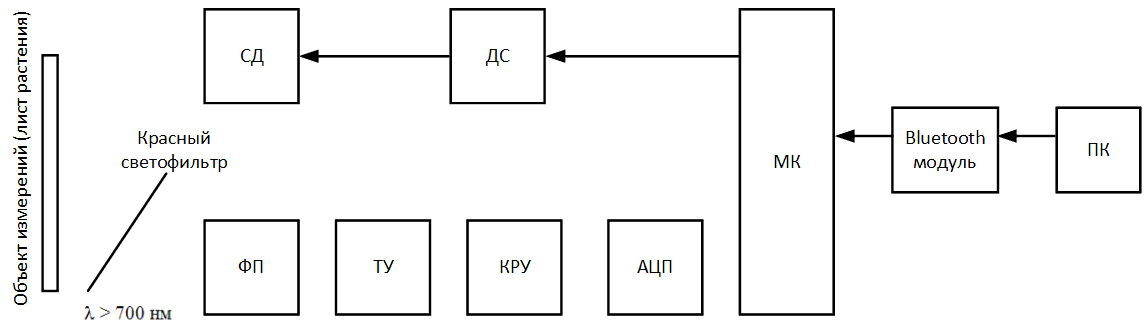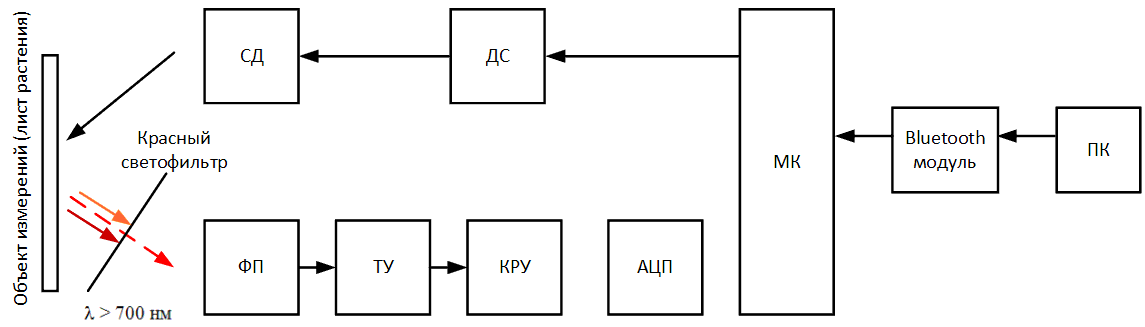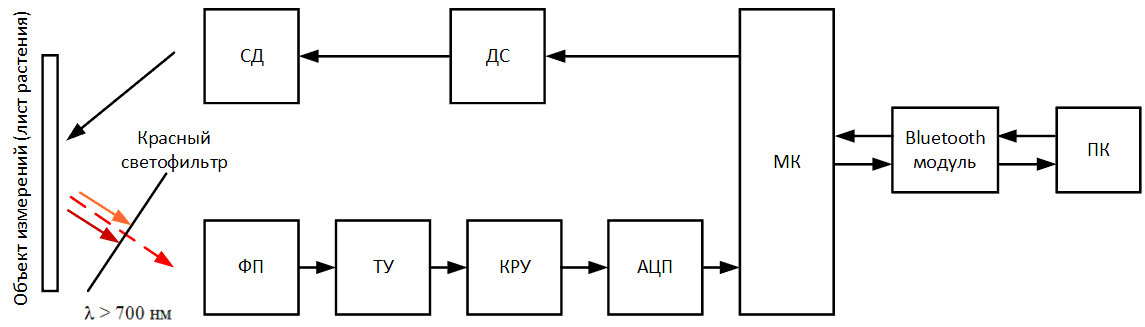
Рисунок 5 – Структурная схема проектируемого устройства (анимированная, 14 КБ, 12 кадров)
- ДС – драйвер светодиода;
- СД – светодиод;
- ФП – фотоприёмник;
- ТУ – трансимпедансный усилитель;
- КРУ – каскад регулировки усиления;
- АЦП – аналого‑цифровой преобразователь;
- МК – микроконтроллер;
- ПК – персональный компьютер.
Схема имеет следующий алгоритм работы. В разработанном программном обеспечении на компьютере или ноутбуке нажимается кнопка Start
,
по беспроводной сети Bluetooth через встроенный в устройство Bluetooth модуль на микроконтроллер (МК) приходит сигнал, сигнализирующий о начале измерения.
Микроконтроллер подаёт электрический сигнал на драйвер светодиода (ДС), тем самым зажигая светодиод (СД) и начиная процесс освещения поверхность листовой
пластины. Одновременно с этим включается фотоприёмник (ФП) и преобразует излучаемую листом флуоресценцию, попавшую на него через красный светофильтр в
электрический сигнал. Сигнал усиливается при помощи трансимпедансного усилителя (ТУ) и попадает в каскад регулировки усиления (КРУ), в котором может быть
уменьшен или увеличен до определенного уровня, во избежание выхода за пределы измеряемого диапазона. Аналоговый сигнал с КРУ попадает на аналого‑цифровой
преобразователь (АЦП), который преобразует аналоговый сигнал в цифровой и передаёт его в микроконтроллер (МК). МК на протяжении всего измерения сохраняет
снимаемые значения флуоресценции (код АЦП) в специальный массив, который в конце измерения через Bluetooth модуль передается на персональный компьютер (ПК)
для последующей обработки в специальном ПО.
В соответствии с описанным алгоритмом в объектно‑ориентированном языке программирования Delphi было создано программное обеспечение, представленное на рисунке 6.
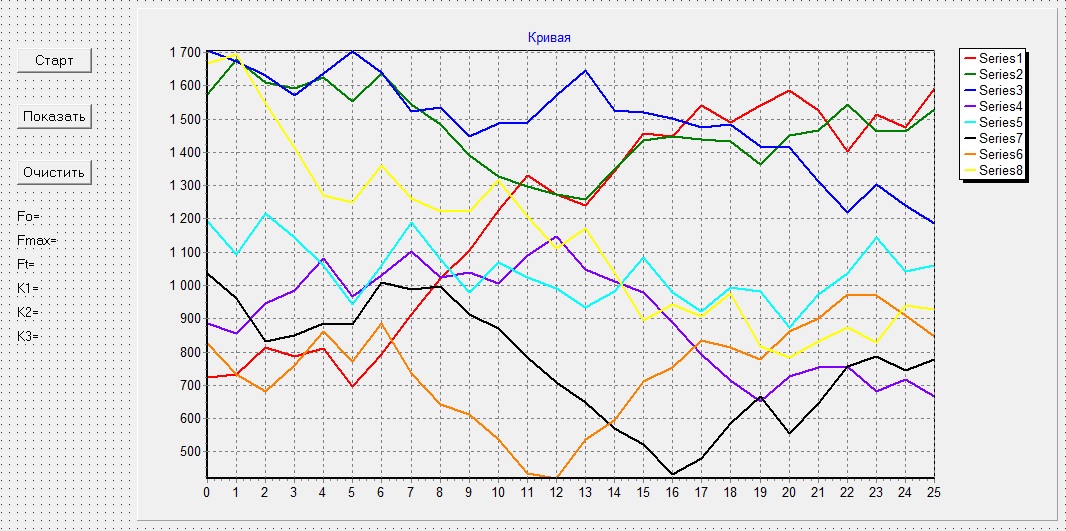
Рисунок 6 – Интерфейс программного обеспечения для ПК
4 Макетный образец
Для тестирования программного обеспечения и более детального практического исследования явления флуоресценции хлорофилла был создан макетный образец разрабатываемого устройства (рис. 7).
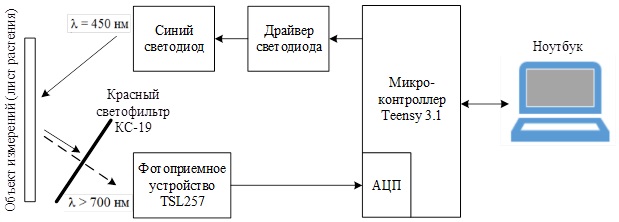
Рисунок 7 – Структурная схема макетного образца разрабатываемого устройства
Принцип работы остаётся тем же: с ноутбука на микроконтроллер по USB приходит сигнал, по которому начинается измерение, МК подаёт сигнал на драйвер синего светодиода, светодиод облучает объект измерения (лист растения), при этом лист переизлучает красной флуоресценцией, которая через красный светофильтр попадает на фотоприёмное устройство, преобразуется в напряжение и попадает в АЦП микроконтроллера, где оцифровывается и сохраняется в оперативной памяти МК. По окончании измерения массив измеренных кодов АЦП через USB передаётся на ноутбук, где обрабатывается в специальном ПО.
Макетный образец был протестирован на листьях растений разных видов, а полученные в результате кривые соответствуют кривым, полученным аналогами разрабатываемого устройства. Одна из зарегистрированных кривых приведена на рисунке 8.
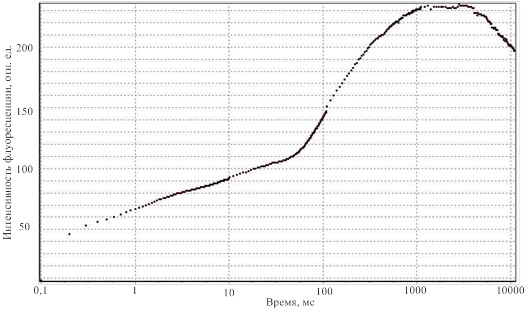
Рисунок 8 – Результат регистрации кривой Каутского с помощью разработанного макета проектируемого устройства
На данном этапе устройство регистрирует только кривую быстрой индукции флуоресценции хлорофилла, проходящую в первые 10 секунд измерения. Это позволяет получить все необходимые параметры для определения состояния растения, за исключением FT, в дальнейшем будет реализована возможность проводить полный цикл измерения и регистрировать все параметры.
Список источников
- В. Н. Гольцев, М. Х. Каладжи, М. А. Кузманова, С. И. Аллахвердиев Переменная и замедленная флуоресценция хлорофилла a – теоретические основы и практическое приложение в исследовании растений. – М.–Ижевск: Институт компьютерных исследований, 2014. – 220 с.
- Л. А. Вадимович Механизмы токсического действия полициклическихароматических углеводородов на фотосинтетический аппарат, 2016.
- Д. А. Тодоренко Характеристики световых реакций фотосинтеза при воздействии токсических веществ, 2016.
- В. С. Лысенко, Т. В. Вардуни, В. Г. Сойер, В. П. Краснов Фундаментальные исследования, 2013, № 4–1. Флуоресценция хлорофилла растений как показатель экологического стресса: теоретические основы применения метода, 2013.
- Т. Э. Кулешова, А. И. Лихачев, Е. С. Павлова, Д. О. Кулешов, А. В. Нащекин, Н. Р. Галль Журнал технической физики, 2018, том 88, вып. 9. Взаимосвязь спектров поглощения пигментов растений и светодиодного освещения с различным спектральным составом
- Д. Ю. Корнеев Информационные возможности метода индукции флуоресценции хлорофилла, 2002.
- Г. В. Мельников, М. И. Лобачев, А. Г. Мельников Вестник СГТУ, 2003, № 1. Высокочувствительный импульсный флуориметр для экологического мониторинга окружающей среды
- C. Buschmann Variability and application of the chlorophyll fluorescence emission ratio red/far‑red of leaves // Photosynth. Res. 2007. V. 92. P. 261–271.
- К. Б. Асланиди, А. А. Шалапенок, В. Н. Карнаухов, Н. Г. Берестовская, В. И. Шавкин Метод определения функционального состояния растений по спектрам флуоресценции хлорофилла (техника биомониторинга). Пущино: НЦБИ АН СССР. 1988.
- N. A. Mir, R. Perez, R. M. Beaudry (1996) Chlorophyll fluorescence and whole fruit senescence in Golden Delicious apple. In: International Postharvest Science Conference Postharvest 96. – Taupo, New Zealand, p. 121–126.
- P. S. Basu, A. Sharma, N. P. Sukumaran (1998) Changes in net photosynthetic rate and chlorophyll fluorescence in potato leaves induced by water stress. Photosynthetica, 35:13–19.
- G. Angelini, P. Ragni, D. Esposito, P. Giardi, M. L. Pompili, R. Moscardelli, M. T. Giardi (2001) A device to study the effect of space radiation on photosynthetic organisms. Physica Medica, v. XVII, Supplement 1, 1st International Workshop on Space Radiation Research and 11th Annual NASA Space Radiation Health Investigators’ Workshop.
