- Вводная часть
Гетероциклические системы изохинолина и индоло[2,3-с]пиридина (В-карболина) служат структурными компонентами большого числа алкалоидов. Именно это стимулирует интерес к этим классам соединений, среди которых найдены и с успехом применяются многие лекарственные средства [1]. Работы по установлению структуры, синтез природных аналогов, поиск новых биологически активных соединений на основе изохинолина и индоло[2,3-с] пиридина оказали существенное влияние на развитие химии гетероциклических соединений и органической химии в целом.
Подавляющее большинство изохинолинов, В-карболинов и поликонденсированных гетероциклов на их основе получены в результате использования давно открытых и хорошо изученных реакций – Померанца-Фрича, Бишлера-Напиральского, Пикте-Шпенглера и некоторых других [2]. Каждому из этих методов присущи определенные недостатки: невысокие выходы (Померанц-Фрич), необходимость дегидрирования промежуточных дигидроизохинолинов (Бишлер-Напиральский) и т.д. В связи с этим актуальным является поиск новых путей синтеза этих соединений на основе доступных реагентов.
В последнее время одним из перспективных путей получения таких соединений является реакция кислотно-катализируемой циклизации арилзамещенных аминогетероциклов с карбонильными соединениями. Этот метод позволяет с помощью доступных реагентов, в приемлемых условиях и с высокими выходами получить конденсированные гетероциклические системы с ядром изохинолина и В-карболина. Целью данной работы является изучение циклизации различных арилзамещенных аминогетероциклов. Также в перечень подлежащих решению задач входит получение новых гетероциклических систем, обладающих интересными и полезными свойствами, разработка удобных препаративных методик получения труднодоступных производных изохинолина и изучение свойств полученных гетероциклов. По данной работе, на IV Международной научной конференции студентов и аспирантов "Охрана окружающей среды и рациональное использование природных ресурсов" была представлена статья "Получение прекурсоров лекарственных препаратов на основе аминоазолов", в которой рассмотрены основные особенности исследуемого метода, а также синтезы гетероциклических изохинолиновых систем [3]. Современные исследования по данному вопросу направлены на изучение гипотензивной активности производных изохинолина. Этот вид действия характерен для папаверина и других 1-бензил-изохинолинов. Основываясь на влиянии производных изохинолина на процессы свертывания крови синтезируются новые прекурсоры лекарственных препаратов, в частности тиклид, представляющий собой по структуре тиофеновый аналог N-бензил-изохинолина. Он является "чистым" (избирательным) антиагрегантом в отношении тромбоцитов. С целью поиска новых антиагрегантных средств были получены производные N-бензил-изохинолина с различными заместителями в фенильном цикле бензильного фрагмента (Br, Me, MeO и др.). По уровню антиагрегантной активности в отношении тромбоцитов данное вещество близко к папаверину [4]. Также актуальным на сегодняшний день является изучение особенностей оптической изомерии гетероциклических соединений, а также её влияния на фармакологическую активность лекарственных соединений [5].
- Основная часть
Значительное количество природных алкалоидов имеет изохинолиновую структуру. Классические методы синтеза изохинолинов заключаются в пристройке пиридинового ядра к бензольному кольцу и отличаются друг от друга исходными соединениями и условиями проведения процесса.
Синтез Померанца-Фрича обычно проводят в две стадии. На первой происходит образование альдимина в результате конденсации бензальдегида с аминоацеталем. На второй стадии альдимин циклизуется под действием сильных кислот. С циклизацией конкурирует процесс гидролиза имина, что приводит к снижению выхода продукта циклизации (рисунок 1) [6].
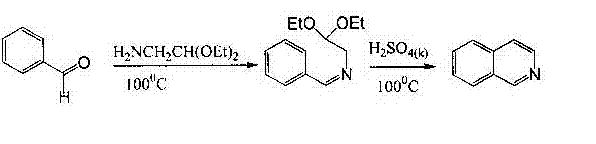
Рисунок 1-Синтез Померанца-ФричаЭлектрофильный характер циклизации объясняет тот факт, что присутствие электродонорных заместителей у ароматического кольца бензальдегида благоприятным образом сказывается на результатах синтеза, а наличие электроноакцепторных дезактивирующих групп у бензальдегида наименее благоприятствует циклизации.
Изохинолины, замещенные по С1-атому, трудно синтезировать по методу Померанца-Фрича. Первая стадия синтеза – образование кетамина из аминоацеталя и кетона идёт далеко не так гладко, как аналогичная реакция с бензальдегидом. Чтобы устранить это затруднение, предложен другой способ проведения синтеза: замещенный бензиламин конденсируют с полуацеталем глиоксаля; образовавшийся имин циклизуют обычным способом (рисунок 2) [2].
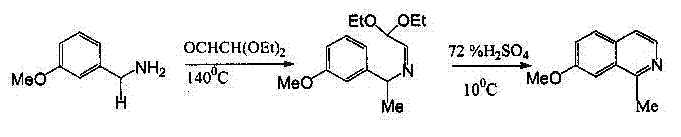
Рисунок 2-Синтез Померанца-Фрича для С1-замещенных изохинолиновВ синтезе Бишлера-Напиральского при взаимодействии фенилэтиламина с карбоновой кислотой или с её хлорангидридом образуется амид; циклизация этого амида, сопровождающаяся отщеплением воды, приводит к получению 3,4-дигидроизохинолина. В качестве конденсирующих агентов для циклизации используют пятиокись фосфора, хлорокись фосфора или пятихлористый фосфор. Полученный дигидроизохинолин легко дегидрируется в изохинолин (рисунок 3) [2].
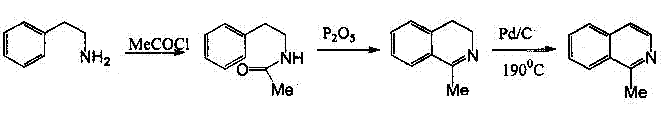
Рисунок 3-Синтез Бишлера-НапиральскогоИ в этом случае циклизация происходит в результате электрофильной атаки ароматического кольца, следовательно, лучше всего идёт реакция, если ароматическое кольцо активировано. Если исходить из потенциально ненасыщенных фенилэтиламинов, то по методу Бишлера-Напиральского можно непосредственно получать ароматические изохинолины – это Модификация Пикте-Гамса [7]. С этой целью В-метокси- или В-окси-В-фенилэтиламиды нагревают с обычно применяемыми конденсирующими агентами. Предполагается, что при этом сначала отщепляется метанол (или вода), я затем происходит циклизация образовавшегося ненасыщенного амида в изохинолин (рисунок 4) [2].
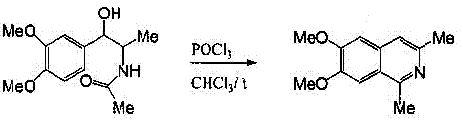
Рисунок 4-Модификация Пикте-ГамсаВ синтезе Пикте-Шпенглера фенилэтиламин легко реагирует с альдегидами, давая с хорошими выходами имины. Циклизация последних приводит к образованию тетрагидроизохинолинов и может катализироваться кислотами (рисунок 5).
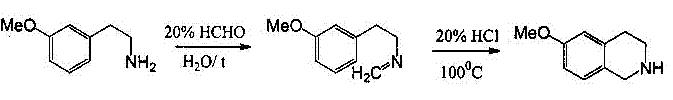
Рисунок 5-Синтез Пикте-ШпенглераПри протонировании атома азота образуется иммониевое основание – сравнительно слабый электролит, для успешной циклизации которого необходимо присутствие мощных активирующих группировок в ароматическом кольце. Влияние метоксигруппы оказывается достаточным только в том случае, если она находится в пара-положении к месту, по которому происходит замыкание; при наличии этой группы в других положениях кольца циклизация не идёт.
Пиразолоизохинолины с алкильным заместителем и без него в положении 8 и с фенильным в положении 3 обладают потенциальной фармакологической активностью [8], кроме того, установлено, что они обладают электролюминесценцией, что способствует их возможному широкому применению в качестве материала для покрытия экранов мониторов и других специальных покрытий [9].
Для изучения этих свойств была поставлена задача синтеза пиразоло[4,5-с]изохинолинов замещенных пиридильным и метильным заместителем (в м – положении по отношению к азоту пиридина) в положение 3 и с различными замещенными фенильными заместителями в положении 8, что предположительно способствует улучшению предполагаемых свойств. Использовался уже изученный нами путь циклизации 5-амино4-(3,4-диметоксифенил) азолов, так как использование замещенных аминоазолов – один из наиболее перспективных методов, позволяющих с помощью доступных реагентов, в приемлемых условиях и с хорошими выходами получить азолоизохинолины.
В качестве исходного соединения мы используем более менее доступный гомовератронитрил. Далее синтез протекает в три стадии (рисунок 6). 1-ой стадией синтеза выступает ацилирование гомовератронитрила (1) этилникотинатом в присутствии изопропилата натрия. 2-ой стадией является получение 5-аминопиразола путем взаимодействия полученного кетонитрила (2) с гидразином (рисунок 6).
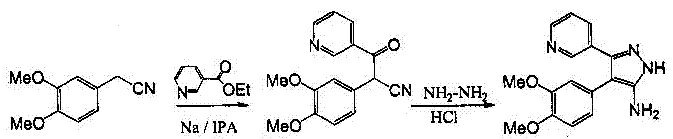
1 2 3
Рисунок 6-Получение 3-(3-пиридил)-4-(3,4-диметоксифенил)-5-аминопиразолаЦиклизация 3-(3-пиридил)-4-(3,4-диметоксифенил)-5-аминопиразола(3) в пиразоло[4,5-с]изохинолины(4-7) проводится хорошо знакомым методом ароматическими альдегидами в трифторуксусной кислоте (рисунок 7).
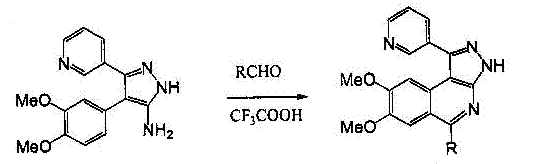
3 4 — 7
4: R=2-Me-Ph
5: R=4-Me-Ph
6: R=2-OH-Ph
7: R=4-OH-Ph
Рисунок 7-Циклизация 3-(3-пиридил)-4-(3,4-диметоксифенил)-5-аминопиразолаСтруктуры полученных веществ подтверждены ПМР-спектрами. Спектры ЯМР записаны на спектрометре Gemini-200 с рабочей частотой 200МГц, внутренний стандарт – ТМС.
Таблица 1 Характеристики полученных пиразоло[4,5-с]изохинолинов
![пиразоло[4,5]изохинолин](image1.gif)
N R Mr Wвых,% Tпл,град.Цельсия Спектр ПМР
м.д4 2-метилфенил 396,4 47 280-282 2,39 (3H,c,CH3);3,82(3H,c,CH3O);
3,86(3H,c,CH3O);7.40...7.51 (4H,м,H аром.),
7.49 (1H,c,H аром.);7.50(1H,c,H аром.);
7.70...9.00(4H,м,H аром.)5 4-метилфенил 396,4 64 283-285 2,42 (3H,c,CH3);3.70 (3H,c,CH3O);
3.72 (3H,c,CH3O);7.40...7.65 (4H,м,H аром.),
7.40 (1H,c,H аром.);7.41 (1H,c,H аром.);
7.70...9.00(4H,м,H аром.); 14,02 (1H,c,NH)6 2-оксифенил 398,4 67 289-291 3,85 (3H,c,CH3O);3.90 (3H,c,CH3O);
6.90 (2H,д,H аром.);7.38 (1H,c,H аром.),
7.48 (1H,c,H аром.);7.60...9.00 (4H,м,H аром.);
9.85 (1H,c,OH); 14.00(1H,c,NH)7 4-оксифенил 398,4 68 293-295 3,83 (3H,c,CH3O);3.91 (3H,c,CH3O);
6.80...7.40 (4H,м,H аром.);7.15(1H,c,H аром.),
7.32 (1H,c,H аром.);7.60...9.05 (4H,м,H аром.);
9.66 (1H,c,OH); 14.01(1H,c,NH)
Таблица 2 Данные элементного анализа пиразоло[4,5-с]изохинолинов
№ R С
вычислено %H
вычислено %N
вычислено %Формула С
найдено %H
найдено %N
найдено %4 2-метилфенил 72.71 5.08 14.13 C24H20N4O2 72.67 4.95 14.05 5 4-метилфенил 72.71 5.08 14.13 C24H20N4O2 72.65 4.90 14.10 6 2-оксифенил 69,34 4,55 14.06 C23H18N4O3 69,29 4.42 14.00 7 4-оксифенил 69,34 4,55 14.06 C23H18N4O3 69,31 4.45 14.03
Методика синтеза
- 3-Оксо-3-(3-пиридил)-2-(3,4-диметоксифенил)-пропионитрил(2). В трехгорлую колбу, оснащенную мешалкой и обратным холодильником, наливают 250 мл пропанола-2 и помещают 5,9 г (0,255 моль) порезанного на небольшие куски натрия. Нагревают и перемешивают, пока натрий не растворится. Затем дают колбе остыть и добавляют раствор 30 г (0,17 моль) гомовератронитрила (1) в 35 мл (0,255 моль) этилникотината. Начинают перемешивать и через некоторое время нагревают до кипения. Кипятят 8 ч. На следующий день упаривают реакционную смесь под вакуумом и наливают в образовавшийся осадок 0,5 л воды. Полученный раствор соли кетонитрила в воде промывают на делительной воронке эфиром (2-3 раза по 150 мл). После помещаем раствор в стакан и прибавляем 15 мл ледяной уксусной кислоты. Перекристаллизация в этаноле. Выход 85%. Тпл 151-153 град. Цельсия.
5-Амино-3-(3-пиридил)-4-(3,4-диметоксифенил)пиразол (3). В колбе с обратным холодильником растворяют 3,31 мл (0,054 моль) 80%-ного гидразингидрата в 100 мл этанола. Затем добавляют 5 г (0,018 моль) соединения (2), 15 мл концентрированной соляной кислоты (до красного цвета на универсальной индикаторной бумаге) и 50 мл воды. Добиваются растворения всех исходных и кипятят 8 ч. Затем упаривают реакционную смесь под вакуумом. Добавляют по 50 мл воды и раствора аммиака в воде. Через некоторое время выпавший осадок отфильтровывают, промывая водой. Перекристаллизация в пропаноле-2. Выход 75%.Тпл 206-208 град. Цельсия.
2. Циклизация 5-амино-3-(3-пиридил)-4-(3,4-диметоксифенил)пиразола - 5,6-Диметокси-3-(3-пиридил)-8-(2-метилфенил)-пиразоло[4,5-с]изохинолин (4). В колбе с обратным холодильником смешивают 1,5 г (0,005 моль) соединения (3), 0,61 мл (0,0053 моль) 2 – метилбензальдегида и 5 мл трифторуксусной кислоты. Кипятят 12 ч. Упаривают под вакуумом, добавляют по 25 мл воды и раствора аммиака в воде. На следующий день отфильтровывают, промывая водой. Перекристаллизовывают в пропаноле-2. Выход 47%.
- 5,6-Диметокси-3-(3-пиридил)-8-(4-метилфенил)-пиразоло[4,5-с]изохинолин (5). Получен по методике для соединения (4) из (3) и 4 – метилбензальдегида. Выход 64%.
- 5,6-Диметокси-3-(3-пиридил)-8-(2-оксифенил)-пиразоло[4,5-с]изохинолин (6). Получен по методике для соединения (4) из (3) и 2 – оксибензальдегида. Выход 67%.
- 5,6-Диметокси-3-(3-пиридил)-8-(4-оксифенил)-пиразоло[4,5-с]изохинолин (7). Получен по методике для соединения (4) из (3) и 4 – оксибензальдегида. Выход 68%.
1. Синтез 5-амино-3-(3-пиридил)-4-(3,4-диметоксифенил)пиразола
Анимационная иллюстрация синтеза пиразоло[4,5-с]изохинолинов
- 3-Оксо-3-(3-пиридил)-2-(3,4-диметоксифенил)-пропионитрил(2). В трехгорлую колбу, оснащенную мешалкой и обратным холодильником, наливают 250 мл пропанола-2 и помещают 5,9 г (0,255 моль) порезанного на небольшие куски натрия. Нагревают и перемешивают, пока натрий не растворится. Затем дают колбе остыть и добавляют раствор 30 г (0,17 моль) гомовератронитрила (1) в 35 мл (0,255 моль) этилникотината. Начинают перемешивать и через некоторое время нагревают до кипения. Кипятят 8 ч. На следующий день упаривают реакционную смесь под вакуумом и наливают в образовавшийся осадок 0,5 л воды. Полученный раствор соли кетонитрила в воде промывают на делительной воронке эфиром (2-3 раза по 150 мл). После помещаем раствор в стакан и прибавляем 15 мл ледяной уксусной кислоты. Перекристаллизация в этаноле. Выход 85%. Тпл 151-153 град. Цельсия.
5-Амино-3-(3-пиридил)-4-(3,4-диметоксифенил)пиразол (3). В колбе с обратным холодильником растворяют 3,31 мл (0,054 моль) 80%-ного гидразингидрата в 100 мл этанола. Затем добавляют 5 г (0,018 моль) соединения (2), 15 мл концентрированной соляной кислоты (до красного цвета на универсальной индикаторной бумаге) и 50 мл воды. Добиваются растворения всех исходных и кипятят 8 ч. Затем упаривают реакционную смесь под вакуумом. Добавляют по 50 мл воды и раствора аммиака в воде. Через некоторое время выпавший осадок отфильтровывают, промывая водой. Перекристаллизация в пропаноле-2. Выход 75%.Тпл 206-208 град. Цельсия.
- Заключительная часть
В ходе проведенной работы были изучены методы синтеза различных гетероциклов с ядром изохинолина, многие из которых обладают фармакологической активностью. Была разработана методика получения пиразоло[4,5-c]изохинолинов с различными заместителями в положении 8, дающая приемлемые выходы, не требующая использования дополнительной ароматизации продуктов и дающая возможность получения соответствующих соединений на основе доступных реагентов.
Были синтезированы 5-амино-3-(3-пиридил)-4-(3,4-диметоксифенил)пиразол, 5,6-Диметокси-3-(3-пиридил)-8-(2-метилфенил)-пиразоло[4,5-с]изохинолин, 5,6-Диметокси-3-(3-пиридил)-8-(4-метилфенил)-пиразоло[4,5-с]изохинолин, 5,6-Диметокси-3-(3-пиридил)-8-(2-оксифенил)-пиразоло[4,5-с]изохинолин, 5,6-Диметокси-3-(3-пиридил)-8-(4-оксифенил)-пиразоло[4,5-с]изохинолин.
Последующая работа в данном направлении позволит разработать и внедрить новые методики получения прекурсоров лекарственных препаратов на основе изохинолинов и гетероциклических систем на их основе, получить новые поликонденсированные гетероциклы с интересными и полезными свойствами, пересмотреть ранее разработанные методы [10]. На сегодняшний день проблема здоровья населения Земли стоит довольно остро, поэтому поиск и синтезирование новых лекарственных препаратов является актуальным направлением научной деятельности.
ЛИТЕРАТУРА
- Использование производных изохинолина в качестве лекарственных средств
http://www.pharmasvit.com/v3/Spravochniki/2134.html - Джоуль Дж., Смит Г. Основы химии гетероциклических соединений. - М.: Мир, 1975. – 398 С.
- Получение прекурсоров лекарственных препаратов на основе аминоазолов
А.В.Булавин, А.В.Ефанов IV Международная научная конференция студентов и аспирантов "Охрана окружающей среды и рациональное использование природных ресурсов". - Синтез и сердечно-сосудистая активность новых производных изохинолина
Михайловский А.Г., Вахрин М.И., Сыропятов Б.Я., Долженко А.В, Институт технической химии Уро РАН, Пермь, Пермская ФА. - Оптическая изомерия и фармакологическая активность лекарственных препаратов
В. В. Алексеев, Военно-медицинская академия, Санкт-Петербург. - Иванский В.И. Химия гетероциклических соединений. – М.: Высш. школа, 1978. – 559 С.
- Пример изохинолинового синтеза
Джоуль Дж.,Смит Г.Основы химии гетероциклических соединений.-М.:Мир,1975.-398с (137с). - Богза С.Л. Функциональнозамещенные соли бензо[с]пирилия. Синтез и реакции: Дис. кандидата хим. наук. – Донецк, 1992. – 111 С.- Машинопись.
- Богза С.Л., Иванов А.В., Дуленко В.И., Кобраков К.И. Циклодезаминирование N-азолилформамидинов. Синтез полиазогетероциклов со структурными фрагментами изохинолина и индоло[2,3-с]пиридина // Журн. орган. хим. – 1993. - 29. – 1480 – 1484
- Гетероциклические соединения в биологии и медицине
А.Ф.Пожарский, Ростовский государственный университет, Ростов-на-Дону.
- Использование производных изохинолина в качестве лекарственных средств