






В ход╕ сво╓╖ д╕яльност╕ людство вза╓мод╕╓ з навколишн╕м середовищем. Для свого життя воно витягу╓ з не╖ сировину ╕ поверта╓ в не╖ в╕дходи. Ц╕ в╕дходи мають р╕зний агрегатний стан. Викиди газ╕в мають найб╕льше значення, оск╕льки ╖х вплив в╕дчува╓ться на значних в╕дстанях в╕д джерела викиду, ╕ забруднюються при цьому не т╕льки навколишн╕ ╜рунти, але також водоймища згубно д╕ють на рослинн╕ орган╕зми. Об'╓ми викид╕в в св╕т╕ досягають значень 400 млн. тонн/р╕к. Всього в св╕т╕ в атмосферу викида╓ться 100-150 млн. тонн д╕оксиду с╕рки антропогенного походження. Викиди SO2 в Укра╖н╕ складають близько 1,02 млн. тонн, зокрема 0,36 млн. тонн доводиться на Донецьку область. Найб╕льша к╕льк╕сть викид╕в SO2 доводиться на чорну ╕ кольорову металург╕ю, теплову енергетику, вуг╕льну промислов╕сть (гор╕ння терикон╕в)[1].
Д╕оксид с╕рки (SO2) - ╓ сильно токсичним газом, його максимальна разова ПДК - 0,5 мг/м3. Кр╕м того д╕оксид окислю╓ться в атмосфер╕ до триоксиду с╕рки, який з'╓дну╓ться з водяною парою ╕ утворю╓ с╕рчану кислоту, яка в свою чергу розчиняючись в атмосферн╕й волоз╕ випада╓ на землю у вигляд╕ кислотних дощ╕в. Вплив кислотних дощ╕в на рослинн╕сть згубний. Нав╕ть слабк╕ розчини с╕рчано╖ кислоти порушують процеси фотосинтезу в лист╕ рослин. Хвоя хвойних дерев гине при концентрац╕╖ д╕оксиду с╕рки в пов╕тр╕ 0,05 мг/м3 [2]. У зв'язку з цим необх╕дно попереджати надходження в атмосферу д╕оксиду с╕рки. Отже питання вивчення вза╓мод╕╖ д╕оксиду с╕рки з рядом сполук лужноземельних метал╕в ма╓ особливу актуальн╕сть в перспектив╕ розробки нових промислових поглинач╕в д╕оксиду с╕рки.
Мета роботи: вивчити процес поглинання д╕оксиду с╕рки сполуками лужноземельних метал╕в
Проблема очищення промислових газ╕в, що викидаються в атмосферу, в╕д д╕оксиду с╕рки ╓ глобальною. Необх╕дно враховувати що процеси спалювання с╕рчистих палив або проведення металург╕йних процес╕в - активно застосовуються у вс╕х кра╖нах з розвиненою ╕нфраструктурою. Це забезпечу╓ актуальн╕сть питання розробки поглинач╕в оксиду с╕рки (IV).
Так в Рос╕╖ ТОВ НВО «Д╤ОМАР» на г╕рничо-х╕м╕чному комб╕нат╕ в м. Кингисепп (Лен╕нградська область) виробля╓ сорбенти на основ╕ железомарганцевих сполук. До складу сорбент╕в входять оксиди ╕ гидроокисли зал╕за, марганцю, алюм╕н╕ю: зм╕ст Fe2O3 вар╕ю╓ться в межах 15-30%, МnО - 15-25%, Al2O3 - 7-10%. Нов╕ сорбенти волод╕ють прекрасними сорбц╕йними властивостями ╕ можуть розглядатися як ун╕версальний матер╕ал для очищення р╕зних середовищ в╕д с╕рчистих сполук (д╕оксид с╕р╕, с╕рководень, мет╕лмеркаптан ╕ ╕н.). Для оц╕нки сорбционних ╕ катал╕тичних властивостей железомарганцевих сорбент╕в проведений ряд досл╕джень в лабораторних ╕ досв╕дчено-промислових умовах ╕з залученням фах╕вц╕в НД╤ ВодГео (р. Москва), ВН╤УС (р. Казань), ╤нституту катал╕зу ╕м Р. К. Борецкого АН (р. Новосиб╕рськ). Проведен╕ досл╕дження показали, що сорбенти проявляють високу сорбционную ╕ катал╕тичну активн╕сть практично у вс╕х р╕дких ╕ газових середовищах. Встановлено, що вони ефективно сорбують нафтопродукти, ╕они зал╕за, марганцю ╕ розчинений с╕рководень з питно╖ ╕ ст╕чно╖ води в динам╕чному ╕ статичному режимах. За допомогою Fe-Mn-сорбент╕в можливе очищення нафтових фракц╕й (бензин, ав╕ац╕йний гас) в╕д мет╕лмеркаптана ╕ ╕нших с╕рчистих сполук. При проведенн╕ лабораторних досл╕джень було встановлено, що сорбенти очищають гази, що в╕дходять, ╕ в╕д с╕рчистого анг╕дриду. Лабораторн╕ експерименти проводили силами лаборатор╕╖ ТОВ НВО «Д╤ОМАР». Через колонку, заповнену сорбентом, пропускали 100% SO2 ╕ газо-воздушную сум╕ш ╕з зм╕стом SO2 10%. Процес насичення с╕рчистим газом 3159 г сорбенту (у перерахунку на суху речовину) при пропусканн╕ 168 л SО2 через в╕дбувся через 2 годин 48 хвилин. При розбавленн╕ в 10 раз╕в SО2 пов╕трям ╕ пропусканн╕ газо-воздушной сум╕ш╕ через колонку ╕з швидк╕стю 1 л/хв повне насичення газами в╕дбува╓ться протягом 16 годин п╕сля проходу через колонку 960 л газо-воздушной сум╕ш╕. Якщо змоделювати процес на промислов╕й установц╕ газоочистки, то колона ╕з сп╕вв╕дношенням висоти до д╕аметру 1:5, заповнена 2,75 т сорбенту вогк╕стю 8%, може поглинути до 400 кг SО2, що при об'╓мному вм╕ст╕ д╕оксиду с╕рки в газо-пов╕трян╕й сум╕ш╕ 4% в╕дпов╕да╓ пропусканню 3,5 тис. м3 сум╕ш╕. При проведенн╕ х╕м╕чного анал╕зу у в╕дпрацьованому сорбент╕ була знайдена елементарна с╕рка. Це дозволило припустити, що Fe-Mn-сорбенти волод╕ють катал╕тичними властивостями. Одним з результат╕в сум╕сних з ╤нститутом катал╕зу СО РАН роб╕т стало створення катал╕затора для процесу в╕дновлення д╕оксиду с╕рки до елементарно╖ с╕рки. [3]
У орловському державному техн╕чному ун╕верситет╕, Рос╕я, на кафедр╕ х╕м╕╖ проводилися роботи за оц╕нкою термодинам╕чних равновесий в системах CaCO2 – CO2 – SO2 ╕ MgCO2–CO2–SO2. У роботах виконаний розрахунок ╕ анал╕з р╕вноважних склад╕в вищеназваних систем при р╕зних температурах шляхом р╕шення системи нел╕н╕йних р╕внянь закону д╕ючих мас щодо ступен╕в повноти незалежних реакц╕й. Встановлена можлив╕сть практично повного очищення топочних газ╕в в╕д сполук с╕рки при використовуванн╕ вапняку або вапна в ╕нтервал╕ температур в╕д 500 до 1300 – 1600 оС [4,5].
Для отримання к╕льк╕сних оц╕нок можливост╕ зд╕йснення сорбц╕╖ д╕оксиду с╕рки р╕зними сполуками, були зд╕йснен╕ термодинам╕чн╕ розрахунки реакц╕й, що прот╕кають. Зробити висновок про можлив╕сть прот╕кання реакц╕╖ м╕ж х╕м╕чними сполуками можна, використовуючи дан╕ про зм╕ну енерг╕╖ Г╕ббса в ход╕ ц╕╓╖ реакц╕╖. Термодинам╕чний потенц╕ал визнача╓ться р╕зницею м╕ж ентальп╕йним (ΔH) та ентроп╕йним (TΔS) чинниками, як╕ д╕ють на систему в ход╕ х╕м╕чно╖ вза╓мод╕╖:
ΔG = ΔH - T * ΔS
Характер зм╕ни енерг╕╖ Г╕ббса дозволя╓ говорити про принципову можлив╕сть зд╕йснення процесу. При ΔG < 0 процес може прот╕кати, при ΔG > 0 процес прот╕кати не може (╕ншими словами, якщо енерг╕я Г╕ббса в початковому стан╕ системи б╕льше, н╕ж в к╕нцевому, то процес принципово може прот╕кати, якщо навпаки – то не може). Якщо ж ΔG = 0, то система знаходиться у стан╕ х╕м╕чно╖ р╕вноваги. Анал╕з р╕вняння дозволя╓ встановити, який з чинник╕в, що становлять енерг╕ю Г╕ббса, в╕дпов╕да╓ за напрям прот╕кання х╕м╕чно╖ реакц╕╖:
ΔH <0 ╕ ΔS> 0, то ΔG <0 завжди ╕ реакц╕я можлива за будь-яко╖ температури;
ΔH> 0 ╕ ΔS <0, то ΔG> 0 ╕ реакц╕я неможлива н╕ за яких умов;
у решт╕ випадк╕в (ΔH <0, ΔS <0 и ΔH> 0, ΔS> 0) знак ΔG залежить в╕д сп╕вв╕дношення ΔH ╕ TΔS.
Реакц╕я можлива, якщо вона супроводжу╓ться зменшенням ╕зобарного потенц╕алу; за к╕мнатно╖ температури, коли значення T невелике, значення TΔS також невелике, ╕ звична зм╕на ентальп╕╖ б╕льше TΔS. Чим вище температура, тим б╕льше TΔS, ╕ нав╕ть ендотерм╕чн╕ реакц╕╖ стають зд╕йснюваними. [6]
Для наочност╕ представля╓ться демонстрац╕йний ролик впливу температури на повед╕нку молекул газу, ╕ ╖╖ рол╕ в зд╕йсненн╕ х╕м╕чно╖ вза╓мод╕╖:
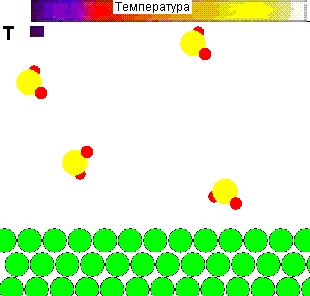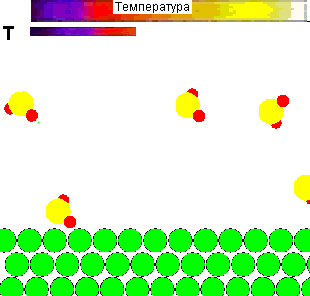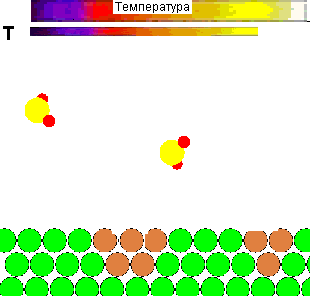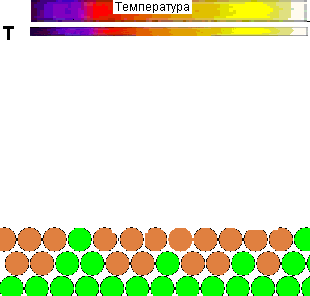
Рисунок 1 - Вплив температури на повед╕нку молекул газу ╕ вза╓мод╕ю ╖х з адсорбентом
(Характеристики ан╕мац╕╖: 28 кадр╕в, ╕нтервал м╕ж кадрами - 0,1 секунди, повторюван╕сть - 15 раз╕в)
Для розрахунку енерг╕╖ Г╕ббса початковими даними ╓ значення зм╕н ентальп╕╖ ╕ ентроп╕╖ х╕м╕чно╖ реакц╕╖ за певно╖ температури. У розрахунках приймалася температура 298 К, за яко╖ розраховувалися значення ентальп╕╖ ╕ ентроп╕╖ реакц╕й. Розрахунок зроблений для оксид╕в ╕ карбонат╕в ряду Mg – Ca – Sr – Ba, що проявля╓ сорбц╕йну активн╕сть, фосфат╕в ╕ н╕трат╕в цих метал╕в, як╕ можуть бути використан╕ як модиф╕куюч╕ добавки в поглиначах, а також деяких сполук лужних метал╕в, як╕ можуть використовуватися як активатори процесу сорбц╕╖ д╕оксиду с╕рки сполуками лужноземельних метал╕в. Дан╕, одержан╕ при розрахунку енерг╕╖ Г╕ббса, зведен╕ в таблицю.
Таблиця 1 - Дан╕ розрахунку термодинам╕чних оц╕нок сорбционной активност╕ сполук лужноземельних метал╕в
| № | Реакция | ΔH, кДж/моль | ΔS, Дж/моль*К | ΔG, кДж/моль |
| 1 | MgO + SO2 -> MgSO3 | -116,54 | -188,91 | -60,24 |
| 2 | CaO + SO2 -> CaSO3 | -227,40 | -186,4 | -171,85 |
| 3 | SrO + SO2 -> SrSO3 | -299,80 | -189,53 | -243,32 |
| 4 | BaO + SO2 -> BaSO3 | -351,80 | -199,6 | -292,32 |
| 5 | MgO + SO2 + O2 -> MgSO4 | -386,40 | -286,15 | -301,13 |
| 6 | CaO + SO2 + O2 -> CaSO4 | -492,00 | -283,615 | -407,48 |
| 7 | SrO + SO2 + O2 -> SrSO4 | -555,10 | -283,315 | -470,67 |
| 8 | BaO + SO2 + O2 -> BaSO4 | -611,50 | -289,115 | -525,34 |
| 9 | Mg(NO3)2 + SO2 -> MgSO4 + 2NO2 | -130,90 | 159,7 | -178,49 |
| 10 | Ca(NO3)2 + SO2 -> CaSO4 + 2NO2 | -122,50 | 145,6 | -165,89 |
| 11 | Sr(NO3)2 + SO2 -> SrSO4 + 2NO2 | -102,50 | 159,2 | -149,94 |
| 12 | Ba(NO3)2 + SO2 -> BaSO4 + 2NO2 | -113,70 | 149,9 | -158,37 |
| 13 | Mg3(PO4)2 + 3SO2 -> 3MgSO3 + 0,5P4O10 | 94,06 | -560,5 | 261,09 |
| 14 | Ca3(PO4)2 + 3SO2 -> 3CaSO3 + 0,5P4O10 | 12,00 | -561,67 | 179,38 |
| 15 | Sr3(PO4)2 +3SO2 -> 3SrSO3 + 0,5P4O10 | -33,62 | - | - |
| 16 | Ba3(PO4)2 + 3SO2 -> 3BaSO3 + 0,5P4O10 | - | - | - |
| 17 | 2LiNO3 + SO2 -> Li2SO4 + 2NO2 | -106,32 | 204,372 | -167,22 |
| 18 | 2NaNO3 + SO2 -> Na2SO4 + 2NO2 | -84,90 | 148,5 | -129,15 |
| 19 | 2KNO3 + SO2 -> K2SO4 + 2NO2 | -80,94 | 141,63 | -123,15 |
| 20 | MgCO3 + SO2 -> MgSO3 + CO2 | -15,85 | -14,01 | -11,68 |
| 21 | CaCO3 + SO2 -> CaSO3 + CO2 | -50,01 | -26,00 | -42,26 |
| 22 | SrCO3 + SO2 -> SrSO3 + CO2 | -65,21 | -18,90 | -59,58 |
| 23 | BaCO3 + SO2 -> BaSO3 + CO2 | -99,91 | -27,80 | -91,63 |
| 24 | MgCO3 + SO2 + O2 -> MgSO4 + CO2 | -285,71 | -111,12 | -252,60 |
| 25 | CaCO3 + SO2 + O2 -> CaSO4 + CO2 | -314,61 | -123,21 | -277,89 |
| 26 | SrCO3 + SO2 + O2 -> SrSO4 + CO2 | -320,51 | -112,4 2 | -287,01 |
| 27 | BaCO3 + SO2 + O2 -> BaSO4 + CO2 | -359,61 | -117,32 | -324,65 |
З одержаних термодинам╕чних оц╕нок видно, що енерг╕я Г╕ббса реакц╕й з д╕оксидом с╕рки у ряд╕ сполук Mg – Ba менше 0, за винятком фосфат╕в, що визнача╓ ╖х ╕нертн╕сть в╕дносно SO2. При розгляд╕ ряду Mg – Ca – Sr – Ba енерг╕я Г╕ббса законом╕рно убува╓, як насл╕док в багатокомпонентних системах пр╕оритет в реакц╕╖ матимуть сполуки метал╕в з б╕льшою молекулярною вагою. З цього виходить, що термодинам╕чно можливе застосування вс╕х оксид╕в ╕ карбонат╕в лужноземельних метал╕в для ф╕ксац╕╖ д╕оксиду с╕рки з газових сум╕шей.
Процеси вза╓мод╕╖ д╕оксиду с╕рки ╕з сполукам лужноземельних метал╕в зд╕йснювали на установц╕, представлен╕й на рисунку 2.
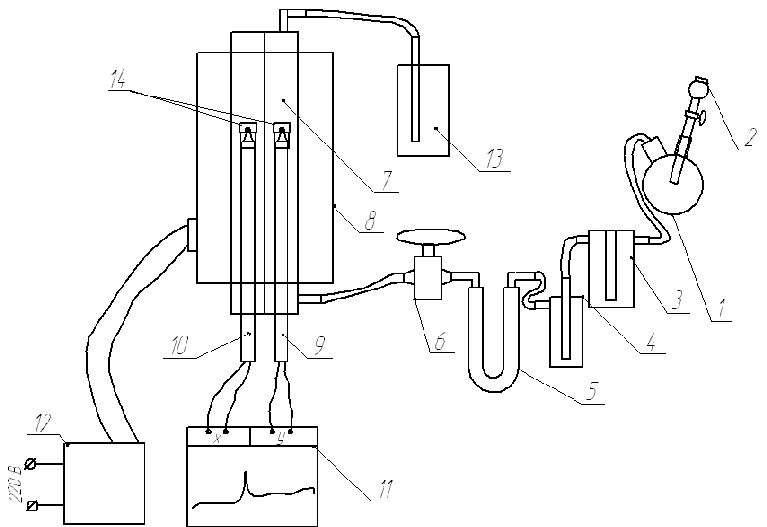
1 – колба для отримання д╕оксиду с╕рки, 2 – краплинна воронка, 3 - склянка Т╕щенко, 4 – каплеуловлювач, 5 – поглинювальна трубка, 6 – кран, 7 – реакц╕йна судина, 8 – трубчаста п╕ч, 9 – термопара зразка, 10 – еталонна термопара, 11 – самописець, 12 – лабораторний автотрансформатор, 13 – склянка з поглинювальним розчином, 14 - т╕гл╕
Рисунок 2- Принципова схема лабораторно╖ установки
Д╕оксид с╕рки одержують в колб╕ 1 при вза╓мод╕╖ розраховано╖ к╕лькост╕ суспенз╕╖ сульф╕ту натр╕ю з концентрованою с╕рчаною кислотою, яку додають невеликими порц╕ями через краплинну воронку 2 [9]. Додавати в╕дразу велику к╕льк╕сть кислоти не можна, унасл╕док того, що при цьому в╕дразу утворю╓ться великий об'╓м газу, який через високий г╕дравл╕чний оп╕р системи, прорива╓ться через воронку з кислотою, ╕ може викинути ╖╖ назовн╕. К╕льк╕сть сульф╕ту розрахову╓ться виходячи з 10 % надлишку, по в╕дношенню до стех╕ометрично╖ к╕лькост╕ сульф╕ту, необх╕дного для отримання об'╓му газу здатного 10-кратно промити всю експериментальну установку в╕д пов╕тря. Дал╕ одержаний газ проходить осушення концентрованою с╕рчаною кислотою в склянц╕ Т╕щенко 3. Для запоб╕гання надходженню аерозоля кислоти в реактор газ проходить каплеуловлювач 4, а пот╕м проходить доосушку сил╕кагелем в поглинювальн╕й трубц╕ 5, п╕сля чого поступа╓ в реакц╕йну судину 7 [10].
Реактор ╓ двома кварцовими трубками, що проходять паралель подовжн╕й ос╕ трубчасто╖ печ╕. Максимальна температура нагр╕ву печ╕ 1000оС. Температура ╖╖ нагр╕ву регулю╓ться за допомогою лабораторного автотрансформатора 12, який обладнаний н╕зькообертовим електродвигуном з редуктором для плавного п╕двищення вих╕дно╖ напруги. Одна з кварцових трубок ╓ реакц╕йною судиною, а друга необх╕дна для прим╕щення в не╖ «еталонно╖» термопари. У реакц╕йну судину пом╕ща╓ться досл╕джуваний зразок, що пом╕ща╓ться в реакц╕йний тигель, який надяга╓ться на кульку «робочо╖» термопари. Термопари п╕дключен╕ диференц╕ально до самописця 11 для ф╕ксац╕╖ теплових ефект╕в вза╓мод╕╖ д╕оксиду с╕рки ╕ досл╕джуваного зразка при зм╕н╕ температури. Газ з реакц╕йно╖ судини в╕дводиться в склянку з поглинювальним розчином 13, для уникнення надходження д╕оксиду с╕рки в атмосферу лаборатор╕╖ [10]. Т╕гл╕ 14 для розм╕щення зразк╕в виконан╕ з жарост╕йкого скла.
Для вивчення як╕сного складу початкових ╕ утворених в результат╕ х╕м╕чно╖ вза╓мод╕╖ речовин була використана методика ре╓страц╕╖ ╤К-спектр╕в поглинання, яка реал╕зувалася на прилад╕ «Specord 75IR» Принципова схема спектрофотометра приведена на рисунку 3.
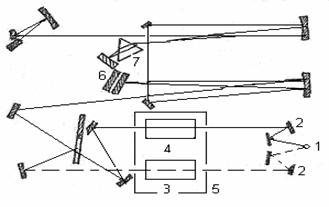
1 – джерело випром╕нювання; 2 – система дзеркал; 3 – зразок досл╕джувано╖ речовини; 4 – еталон; 5 – кюветне в╕дд╕лення; 6 – дифракц╕йн╕ грати; 7 – призма.
Рисунок 3 – Оптична схема ╕нфрачервоного спектрофотометра
Випром╕нювання, яке проходить з джерела (1), розд╕ля╓ться на два потоки за допомогою системи дзеркал (2). Потоки випром╕нювання йдуть на досл╕джувану ╕ еталонну проби в кюветно╓ в╕дд╕лення (5) спектрофотометра. Дал╕ обидва потоки випром╕нювання з'╓днуються ╕ прямують системою дзеркал на вх╕д монохроматора. Основною частиною монохроматора ╓ дифракц╕йн╕ грати (6) ╕ призма (7), як╕ вид╕ляють ╕з загального випром╕нювання д╕лянку з в╕дпов╕дною довжиною хвил╕. Пот╕м пром╕ння потрапля╓ на термоелемент, який в комплект╕ з п╕дсилювальною системою форму╓ сигнал, що управля╓ рухом п╕р'я самописця. Залежно в╕д кута повороту дифракц╕йних грат ╕ призми на приймач потрапля╓ монохроматичне випром╕нювання з р╕зною довжиною хвил╕. Обертаючи грати ╕ призму, наприклад, за допомогою електродвигуна, можна забезпечити безперервну розгортку випром╕нювання по довжинах хвиль. За допомогою приймача можна зм╕ряти ╕нтенсивн╕сть випром╕нювання, що пройшло через зразок, як функц╕ю довжини хвил╕, яка ╓ ╕ч-спектром. [11]
При вза╓мод╕ях речовин з д╕оксидом с╕рки сигналом про прот╕каюч╕ в матер╕ал╕ процеси була температура. Термочутливими датчиками були дв╕ хромель-капельов╕ термопари, як╕ перетворювали терм╕чний сигнал в електричний, ре╓стрований самописцем. В результат╕ самописець викреслював граф╕к - термограмму, що ╓ залежн╕стю р╕зниц╕ температур м╕ж еталонною ╕ робочою термопарами в╕д температури в печ╕. Р╕зниця температур з'явля╓ться внасл╕док прот╕кання процес╕в, що супроводжуються в╕дчутними тепловими ефектами.
Досл╕дження поглинання д╕оксиду с╕рки пероксидними сполуками в лабораторних умовах показали, що вза╓мод╕я почина╓ться вже при незначному нагр╕ванн╕ ╕ йде ╕з значним екзотерм╕чним ефектом. По крив╕й диференц╕ально терм╕чн╕й крив╕й можна судити про ╕нтенсивн╕сть прот╕кання процесу. Прир╕ст маси п╕сля процесу поглинання склав 8% в╕д початково╖ маси зразка. Низький ступ╕нь поглинання може бути пояснена поверхневою вза╓мод╕╓ю зразка ╕ оксиду с╕рки з утворенням ╕нертного продукту, ╕золюючого нижн╕ шари матер╕алу в╕д газово╖ фази [12]. Анал╕з ╕ч – спектру продукту реакц╕╖ дозволя╓ зробити висновок про те, що в даному зразку ╓ ан╕они SO42-, O2 2-. Що доводить хорош╕ сорбц╕йн╕ властивост╕ пероксидних сполук до д╕оксиду с╕рки. Наявн╕сть O22- п╕дтверджу╓ недостатню повноту прот╕кання процесу. Досл╕дження поглинання д╕оксиду с╕рки пероксидом кальц╕ю в лабораторних умовах показали, що вза╓мод╕я почина╓ться при температур╕ б╕ля 430 оС ╕ йде ╕з значним екзотерм╕чним ефектом. На рисунку 4 представлена крива ДТА процесу поглинання.
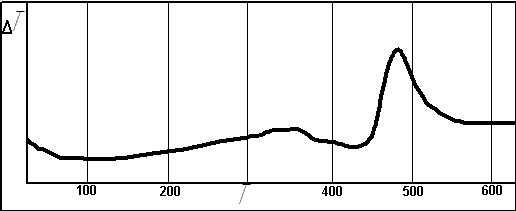
Рисунок 4 - Крива ДТА процесу поглинання д╕оксиду с╕рки пероксидом кальц╕ю
По крив╕й ДТА поглинання д╕оксиду с╕рки пероксидом кальц╕ю можна судити про ╕нтенсивн╕сть прот╕кання процесу. Прир╕ст маси п╕сля цього процесу поглинання склав 12% в╕д початково╖ маси зразка. Пор╕вняння значень довжин хвиль ╕к – спектра продукту реакц╕╖ з таблицями характеристичних частот дозволя╓ зробити висновок про те, що в даному зразку також ╓ ан╕они SO42-, O22-. Що доводить хорош╕ сорбц╕йн╕ властивост╕ пероксидних сполук до д╕оксиду с╕рки.
За даними про зм╕ну мас зразк╕в в реакц╕ях ╕ одержаним спектрограмам можна зробити висновок про те, що процес поглинання д╕оксиду с╕рки пероксидами проходить з утворенням сульфат╕в. Що обумовлене окислювальною д╕╓ю пероксид-╕она по в╕дношенню до д╕оксиду с╕рки. Оксиди лужноземельних метал╕в проявляють кращ╕ сорбц╕йн╕ властивост╕ н╕ж в╕дпов╕дн╕ карбонати. Так при анал╕з╕ термограмм процес╕в поглинання д╕оксиду с╕р╕ оксидами магн╕ю ╕ стронц╕ю, а також ╖х карбонатам╕ було встановлено, що оксид магн╕ю почина╓ вза╓мод╕яти з д╕оксидом с╕рки при температурах зверх 300оС, оксид стронц╕ю в╕дпов╕дно - 400 оС. Вза╓мод╕я карбонату стронц╕ю почина╓ться в д╕апазон╕ 300 - 400 оС. При проведенн╕ анал╕зу зразк╕в п╕сля проведення процеса поглинання була встановлена наявн╕сть в ╖х склад╕ ан╕он╕в SO42-, SO32- ╕ СO32- при проведенн╕ поглинання карбонатами. В╕домо, що сульф╕ти зд╕бн╕ до диспропорц╕онування, що приводить до утворення сульф╕д╕в [13]. У св╕тл╕ цього якнайкращ╕ поглинювальн╕ властивост╕ проявляють пероксиди в╕дразу в процес╕ хемосорбци╕ окисляюч╕ с╕рку до ступеня окислення +6. Що перешкоджа╓ прот╕канню окислювально-в╕дновних процес╕в, що приводять до утворення сульф╕д╕в, здатних вид╕ляти с╕рководень.
На зак╕нчення можна сказати про те, що якнайкращ╕ результати по поглинанню д╕оксиду с╕рки дають речовини проявляюч╕ окислювально - в╕дновн╕ властивост╕, пот╕м сл╕дують сполуки лужно-земельних метал╕в проявляюч╕ основн╕ властивост╕, ╕ нарешт╕ на останньому м╕сц╕ по поглинювальн╕й здатност╕ знаходяться сполуки лужноземельних метал╕в, обм╕нююч╕ вх╕дний в ╖х склад анг╕дрид кислоти слабк╕шо╖ н╕ж с╕рчиста, на молекулу д╕оксиду с╕рки.
© Жебель А.В., ДонНТУ 2009