






В ходе своей деятельности человек взаимодействует с окружающей средой. Для своей жизни он извлекает из неё сырье и возвращает в неё отходы. Эти оходы имеют различное агрегатное состояние. Выбросы газов имеют наибольшее значение, так как из влияние ощущается на значительных расстояниях от источника выброса, и загрязняют не только окружающие почвы, но также водоемы губительно действуют на растительные организмы. Объемы выбросов в мире достигают значений 400 млн. тонн/год. Всего в мире в атмосферу выбрасывается 100-150 млн. тонн диоксида серы антропогенного происхождения. Выбросы SO2 в Украине составляют около 1,02 млн. тонн, в том числе 0,36 млн. тонн приходится на Донецкую область. Наибольшее количество выбросов SO2 приходится на черную и цветную металлургию, тепловую энергетику, угольную промышленность (горение терриконов)[1].
Диоксид серы (SO2) - является сильно токсичным газом, его максимальная разовая ПДК - 0,5 мг/м3. Кроме того диоксид оксиляется в атмосфере до триоксида серы, который соединяется с водяным паром и образует серную кислоту, которая в свою очередь растворяясь в атмосферной влаге выпадает на землю в виде кислотных дождей. Влияние кислотных дождей на растительность губительно. Даже слабые растворы серной кислоты нарушают процессы фотосинтеза в листьях растений, а хвоя хвойных деревьев гибнет при концентрации диоксида серы в воздухе 0,05 мг/м3 [2]. В связи с этим необходимо предупреждать поступление в атмосферу диоксида серы. Следовательно вопрос изучения взаимодействия диоксида серы с рядом соединений щелочноземельных металлов имеет особую актуальность в переспективе разработки новых промышленных поглотителей диоксида серы.
Цель работы: изучить процесс поглощения диоксида серы соединениями щелочноземельных металлов
Так в России ООО НПО «ДИОМАР» на горно-химическом комбинате в г. Кингисепп (Ленинградская область) производит сорбенты на основе железомарганцевых соединений. В состав сорбентов входят окислы и гидроокислы железа, марганца, алюминия: содержания Fe2O3 варьирует в пределах 15-30%, МnО - 15-25%, Al2O3 - 7-10%. Новые сорбенты обладают прекрасными сорбционными свойствами и могут рассматриваться как универсальный материал для очистки различных сред от сернистых соединений (диоксид серы, сероводород, метилмеркаптан и др.). Для оценки сорбционных и каталитических свойств железомарганцевых сорбентов проведен ряд исследований в лабораторных и опытно-промышленных условиях с привлечением специалистов НИИ ВодГео (г. Москва), ВНИУС (г. Казань), Института катализа им Г. К. Борецкого СО АН (г. Новосибирск). Проведенные исследования показали, что сорбенты проявляют высокую сорбционную и каталитическую активность практически во всех жидких и газовых средах. Установлено, что они эффективно сорбируют нефтепродукты, ионы железа, марганца и растворенный сероводород из питьевой и сточной воды в динамическом и статическом режимах. С помощью Fe-Mn-сорбентов возможна очистка нефтяных фракций (бензин, авиационный керосин) от метилмеркаптана и других сернистых соединений. При проведении лабораторных исследований было установлено, что сорбенты очищают отходящие газы и от сернистого ангидрида. Лабораторные эксперименты проводили силами лаборатории ООО НПО «ДИОМАР». Через колонку, заполненную сорбентом, пропускали 100% SO2 и газо-воздушную смесь с содержанием SO2 10%. Процесс насыщения сернистым газом 3159 г сорбента (в пересчете на сухое вещество) при пропускании 168 л SО2 через произошел через 2 часа 48 минут. При разбавлении в 10 раз SО2 воздухом и пропускании газо-воздушной смеси через колонку со скоростью 1 л/мин полное насыщение газами происходит в течение 16 ч после прохода через колонку 960 л газо-воздушной смеси. Если смоделировать процесс на промышленной установке газоочистки, то колонна с соотношением высоты к диаметру 1:5, заполненная 2,75 т сорбента влажностью 8%, может поглотить до 400 кг SО2, что при объёмном содержании диоксида серы в газо-воздушной смеси 4% соответствует пропусканию 3,5 тыс. м3 смеси. При проведении химического анализа в отработанном сорбенте было обнаружено присутствие элементарной серы. Это позволило предположить, что Fe-Mn-сорбенты обладают каталитическими свойствами. Одним из результатов совместных с Институтом катализа СО РАН работ стало создание катализатора для процесса восстановления диоксида серы до элементарной серы. [3]
В орловском государственном техническом университете, Россия, на кафедре химии проводились работы по оценке термодинамических равновесий в системах CaCO3 – CO2 – SO2 и MgCO3–CO2–SO2. В работах выполнен расчет и анализ равновесных составов вышеназванных систем при различных температурах путем решения системы нелинейных уравнений закона действующих масс относительно степеней полноты линейно-независимых реакций. Установлена возможность практически полной очистки топочных газов от соединений серы при использовании известняка или извести в интервале температур от 500 до 1300 – 1600 К [4,5].
Для получения количественных оценок, возможности осуществления сорбции диоксида серы различными соединениями, были осуществлены термодинамические расчеты реакций. Сделать вывод о возможности протекания реакции между химическими соединениями, можно используя данные об изменении энергии Гиббс в ходе этой реакции. Термодинамический потенциал определяется разницей между энтальпийным (ΔH) и энтропийным (TΔS) факторами, действующими на систему в ходе химического взаимодействия:
ΔG = ΔH - T * ΔS
Характер изменения энергии Гиббса позволяет судить о принципиальной возможности осуществления процесса. При ΔG <0 процесс может протекать, при ΔG> 0 процесс протекать не может (другими словами, если энергия Гиббс в начальном состоянии системы больше, чем в конечном, то процесс принципиально может протекать, если наоборот - то не может). Если же ΔG = 0, то система находится в состоянии химического равновесия. Анализ уравнения позволяет установить, какой из факторов, представляющих энергию Гиббса, ответственен за направление протекания химической реакции:
ΔH <0 и ΔS> 0, то ΔG <0 всегда, и реакция возможна при любой температуре;
ΔH> 0 и ΔS <0, то ΔG> 0 всегда, и реакция невозможна ни при каких условиях;
В остальных случаях (ΔH <0, ΔS <0 и ΔH> 0, ΔS> 0) знак ΔG зависит от соотношения ΔH и TΔS.
Реакция возможна, если она сопровождается уменьшением изобарного потенциала; при комнатной температуре, когда значение T небольшое, значение TΔS также небольшое, и изменение энтальпии больше TΔS. Чем выше температура, тем больше TΔS, и даже эндотермическое реакции становятся осуществляемым. [6]
Для наглядности представляется демонстрационный ролик влияния температуры на поведение молекул газа, и её роли в осуществлении химического взаимодействия:
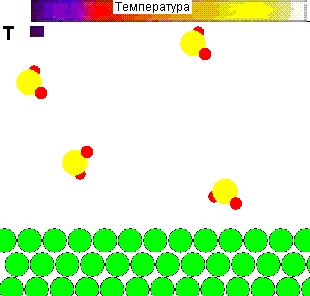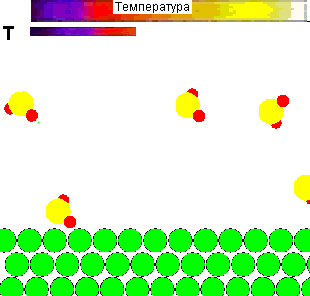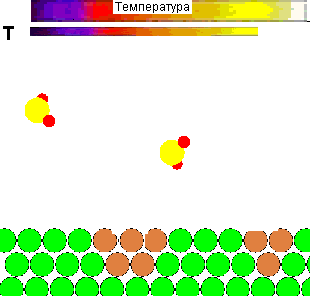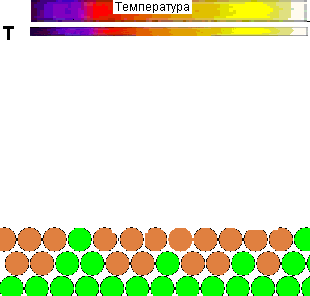
Рисунок 1 - Влияние температуры на поведение молекул газа и взаимодействие их с адсорбентом
Для расчета энергии Гиббса начальными данными являются значения изменений энтальпии и энтропии химической реакции при определенной температуре. В расчетах принималась температура 298 К, при которой рассчитывались значения энтальпии и энтропии реакций [7,8]. Расчет сделан для оксидов и карбонатов ряда Mg - Ca - Sr - Ba, проявляют сорбционную активность, фосфатов и нитратов этих металлов, которые могут быть использованы как модифицирующие добавки поглотителей, а также некоторых соединений щелочных металлов, которые могут использоваться как активаторы процесса сорбции диоксида серы соединениями щелочноземельных металлов. Данные, полученные при расчете энергии Гиббса, сведены в таблицу.
| № | Реакция | ΔH, кДж/моль | ΔS, Дж/моль*К | ΔG, кДж/моль |
| 1 | MgO + SO2 -> MgSO3 | -116,54 | -188,91 | -60,24 |
| 2 | CaO + SO2 -> CaSO3 | -227,40 | -186,4 | -171,85 |
| 3 | SrO + SO2 -> SrSO3 | -299,80 | -189,53 | -243,32 |
| 4 | BaO + SO2 -> BaSO3 | -351,80 | -199,6 | -292,32 |
| 5 | MgO + SO2 + O2 -> MgSO4 | -386,40 | -286,15 | -301,13 |
| 6 | CaO + SO2 + O2 -> CaSO4 | -492,00 | -283,615 | -407,48 |
| 7 | SrO + SO2 + O2 -> SrSO4 | -555,10 | -283,315 | -470,67 |
| 8 | BaO + SO2 + O2 -> BaSO4 | -611,50 | -289,115 | -525,34 |
| 9 | Mg(NO3)2 + SO2 -> MgSO4 + 2NO2 | -130,90 | 159,7 | -178,49 |
| 10 | Ca(NO3)2 + SO2 -> CaSO4 + 2NO2 | -122,50 | 145,6 | -165,89 |
| 11 | Sr(NO3)2 + SO2 -> SrSO4 + 2NO2 | -102,50 | 159,2 | -149,94 |
| 12 | Ba(NO3)2 + SO2 -> BaSO4 + 2NO2 | -113,70 | 149,9 | -158,37 |
| 13 | Mg3(PO4)2 + 3SO2 -> 3MgSO3 + 0,5P4O10 | 94,06 | -560,5 | 261,09 |
| 14 | Ca3(PO4)2 + 3SO2 -> 3CaSO3 + 0,5P4O10 | 12,00 | -561,67 | 179,38 |
| 15 | Sr3(PO4)2 +3SO2 -> 3SrSO3 + 0,5P4O10 | -33,62 | - | - |
| 16 | Ba3(PO4)2 + 3SO2 -> 3BaSO3 + 0,5P4O10 | - | - | - |
| 17 | 2LiNO3 + SO2 -> Li2SO4 + 2NO2 | -106,32 | 204,372 | -167,22 |
| 18 | 2NaNO3 + SO2 -> Na2SO4 + 2NO2 | -84,90 | 148,5 | -129,15 |
| 19 | 2KNO3 + SO2 -> K2SO4 + 2NO2 | -80,94 | 141,63 | -123,15 |
| 20 | MgCO3 + SO2 -> MgSO3 + CO2 | -15,85 | -14,01 | -11,68 |
| 21 | CaCO3 + SO2 -> CaSO3 + CO2 | -50,01 | -26,00 | -42,26 |
| 22 | SrCO3 + SO2 -> SrSO3 + CO2 | -65,21 | -18,90 | -59,58 |
| 23 | BaCO3 + SO2 -> BaSO3 + CO2 | -99,91 | -27,80 | -91,63 |
| 24 | MgCO3 + SO2 + O2 -> MgSO4 + CO2 | -285,71 | -111,12 | -252,60 |
| 25 | CaCO3 + SO2 + O2 -> CaSO4 + CO2 | -314,61 | -123,21 | -277,89 |
| 26 | SrCO3 + SO2 + O2 -> SrSO4 + CO2 | -320,51 | -112,4 2 | -287,01 |
| 27 | BaCO3 + SO2 + O2 -> BaSO4 + CO2 | -359,61 | -117,32 | -324,65 |
Из полученных термодинамических оценок видно, что энергия Гиббса реакций с двуокись серы в ряде соединений Mg - Ba меньше 0, за исключением фосфатов, что определяет их инертность по отношению к SO2. При рассмотрении ряда Mg - Ca - Sr - Ba энергия Гиббса закономерно убывает, как следствие в многокомпонентных системах приоритет в реакции иметь соединения металлов с большим молекулярным весом. Из этого следует, что термодинамически возможно применение всех оксидов и карбонатов щелочноземельных металлов для фиксации диоксида серы из газовых смесей.
Процессы взаимодействия диоксида серы с соединениями щелочноземельных металлов осуществляли на установке, представленной на рисунке 2.
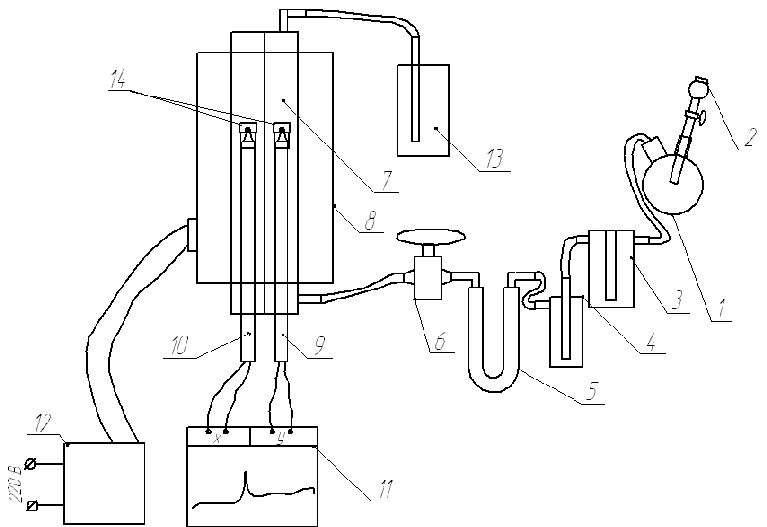
1 – колба для получения диоксида серы, 2 – капельная воронка, 3 - склянка Тищенко, 4 – каплеуловитель, 5 – поглотительная трубка, 6 – кран, 7 – реакционный сосуд, 8 – трубчатая печь, 9 – термопара образца, 10 – эталонная термопара, 11 – самописец, 12 – лабораторный автотрансформатор, 13 – склянка с поглотительным раствором, 14 - тигли
Рисунок 2 - Принципиальная схема лабораторной установки
Диоксид серы получают в колбе 1 при взаимодействии рассчитанного количества суспензии сульфита натрия с концентрированной серной кислотой, которую добавляют небольшими порциями через капельную воронку 2 [9]. Добавлять сразу большое количество кислоты нельзя, вследствие того, что при этом сразу образуется большой объём газа, который из-за высокого гидравлического сопротивления системы, прорывается через воронку с кислотой, и может выбросить её наружу. Количество сульфита расчитывается исходя из 10 % избытка, по отношению к стехиометрическому количеству сульфита, необходимого для получения объёма газа способного 10-кратно промыть всю экспериментальную установку от воздуха. Далее полученный газ проходит осушку концентрированной серной кислотой в склянке Тищенко 3. Для предотвращения поступления аэрозоля кислоты в реактор газ проходит каплеуловитель 4, а затем проходит доосушку силикагелем в поглотительной трубке 5, после чего поступает в реакционный сосуд 7 [10].
Реактор представляет собой две кварцевые трубки, проходящие параллельно продольной оси трубчатой печи. Максимальная температура нагрева печи 1000оС. Температура её нагрева регулируется с помощью лабораторного автотрансформатора 12, который оборудован низкооборотным электродвигателем с редуктором для плавного повышения выходного напряжения. Одна из кварцевых трубок представляет собой реакционный сосуд, а вторая необходима для помещения в неё «эталонной» термопары. В реакционный сосуд помещается исследуемый образец, помещаемый в реакционный тигель, который надевается на шарик «рабочей» термопары. Термопары подключены дифференциально к самописцу 11 для фиксации тепловых эффектов взаимодействия диоксида серы и исследуемого образца при изменении температуры. Газ из реакционного сосуда отводится в склянку с поглотительным раствором 13, для избежания поступления диоксида серы в атмосферу лаборатории [10]. Тигли 14 для размещения образцов выполнены из жаростойкого стекла.
Для изучения качественного состава исходных и образующихся в результате химического взаимодействия веществ была использована методика регистрации ИК-спектров поглощения, которая реализовалась на приборе «Specord 75IR»
Принципиальна схема спектрофотометра приведена на рисунке 3.
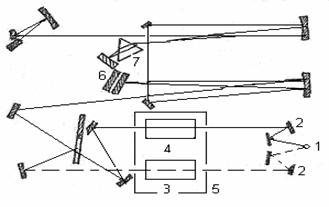
1 – источник излучения; 2 – система зеркал; 3 – образец исследуемого вещества; 4 – эталон; 5 – кюветное отделение; 6 – дифракционная решетка; 7 – призма.
Излучение, которое проходит из источника (1), разделяется на два потока с помощью системы зеркал (2). Потоки излучения идут на исследуемую и эталонную пробы в кюветное отделение (5) спектрофотометра. Дальше оба потока излучения соединяются и направляются системой зеркал на вход монохроматора. Основной частью монохроматора являются дифракционная решетка (6) и призма (7), которые выделяют из общего излучения участок с соответствующей длиной волны. Потом лучи попадают на термоэлемент, который в комплекте с усилительной системой производит сигнал, управляющий движением пера самописца. В зависимости от угла поворота дифракционных решеток и призмы на приемник попадает монохроматическое излучение с разной длиной волны. Вращая решетку и призму, например, с помощью электродвигателя, можно обеспечить непрерывную развертку излучения по длинам волн. С помощью приёмника можно измерить интенсивность излучения, прошедшего через образец, как функцию длины волны, которая является ИК-спектром. [11]
При взаимодействиях веществ с диоксидом серы сигналом о протекающих в материале процессах являлась температура. Термочувствительными датчиками являлись две хромель-капелевые термопары, которые преобразовывали термический сигнал в электрический, регистрируемый самописцем. В результате самописец вычерчивал график - термограмму, представляющую собой зависимость разности температур между эталонной и рабочей термопарами от температуры в печи. Разность температур появляется вследствии протекания процессов сопровождающихся ощутимыми тепловыми эффектами.
Исследование поглощения диоксида серы пероксидом бария в лабораторных условиях показали, что взаимодействие начинается уже при незначительном нагревании и идет со значительным экзотермическим эффектом. По дифференциально термической кривой можно судить об интенсивности протекания процесса. Прирост массы после процесса поглощения составил 8% от исходной массы образца. Низкая степень поглощения может быть объяснена поверхностным взаимодействием образца и оксида серы с образованием инертного продукта, изолирующего нижележащие слои материала от газовой фазы [12]. Анализ ИК – спектра продукта реакции позволяет сделать вывод о том, что в данном образце имеются анионы SO4 2-, SO3 2-. Что доказывает хорошие сорбционные свойства пероксидных соединений к диоксиду серы. Наличие SO32- - подтверждает недостаточную полноту протекания процесса.
Исследование поглощения диоксида серы пероксидом кальция в лабораторных условиях показали, что взаимодействие начинается при температуре около 430оС и идет со значительным экзотермическим эффектом. На рисунке 4 представлена кривая ДТА процесса поглощения.
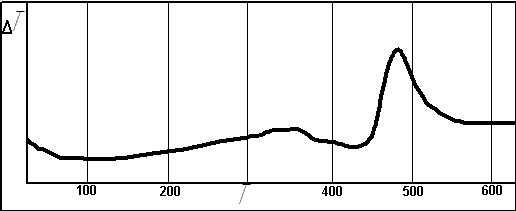
По кривой ДТА поглощения диоксида серы пероксидом кальция можно судить об интенсивности протекания процесса. Прирост массы после этого процесса поглощения составил 12% от исходной массы образца. Сравнение значений длин волн ИК –спектра продукта реакции с таблицами характеристических частот позволяет сделать вывод о том, что в данном образце также имеются анионы SO4 2-, SO3 2-. Что доказывает хорошие сорбционные свойства пероксидных соединений к диоксиду серы.
По данным об изменении масс образцов в реакциях и полученным спектрограммам можно сделать вывод о том, что процесс поглощения диоксида серы пероксидами проходит с образованием сульфатов. Что обусловлено окислительным действием пероксид-иона по отношению к диоксиду серы.
Оксиды щелочноземельных металлов проявляют лучшие сорбционные свойства чем соответствующие карбонаты. Так при анализе термограмм процессов поглощения диоксида серы оксидами магния и стронция, а также их карбонатами было установлено, что оксид магния начинает взаимодействовать с диоксидом серы при температурах свыше 300оС, оксид стронция соответственно - 400 оС. Взаимодействие карбоната стронция начинается в диапазоне 300 - 400 оС. При проведении анализа образцов после проведения процеса поглощения было установлено наличие в их составе анионов SO4 2-, SO3 2- и СO3 2- при проведении поглощения карбонатами. Известно, что сульфиты способны к диспропорционированию приводящему к образованию сульфидов [13]. В свете этого наилучшие поглотительные свойства проявляют пероксиды сразу в процессе хемосорбции окисляющие серу до степени окисления +6. Что препятствует протеканию окислительно-восстановительных процессов, приводящих к образованию сульфидов, способных выделять сероводород.
В заключение можно сказать о том, что наилучшие результаты по поглощению диоксида серы дают вещества проявляющие окислительно - восстановительные свойства, потом следуют соединения щелочно-земельных металлов проявляющие основные свойства, и наконец на последнем месте по поглотительной способности находятся соединения щелочноземельных металлов, обменивающие входящий в их состав ангидрид кислоты более слабой чем сернистая, на молекулу диоксида серы.
© Жебель А.В., ДонНТУ 2009