

 |
 Факультет экологии и химической технологииКафедра химической технологии топливаСпециальность: Химическая технология высокомолекулярных соединенийТема выпускной работы:Исследование свойств высокопредохранительных взрывчатых соединенийНаучный руководитель: Манжос Юрий Викторович |
   |
Реферат по теме выпускной работыСодержаниеВведениеКраткий обзор основных этапов развития промышленных взрывчатых веществПрактические исследования
Выводы Введение Непрерывное развитие промышленности требует постоянного увеличения добычи угля, одного из основных видов энергетического и химического сырья. Важной технологической операцией, используемой при добыче угля из шахт, являются взрывные работы. Взрывы метана в угольных шахтах стали наблюдаться, начиная с XVIII века, когда появилась необходимость разрабатывать пласты, залегающие на больших глубинах и обладающие высокой газообильностью. На сегодняшний день средняя глубина разрабатываемых пластов превышает 720 м., тринадцать шахт Донбасса работают на глубине 1000…1400 м. Приблизительно 90 % шахт Украины являются газовыми, 60 % - опасные из-за взрыва угольной пыли [5].
В угольных шахтах, опасных по газу и взрывам угольной пыли разрешается применять лишь предохранительные взрывчатые вещества (ПВВ). В последние годы существенно снизилось использование ПВВ V и VI классов. До 1986 г. часть ПВВ V класса составляла 30-40 % от общего количества ПВВ, а VI класса – 10-15 %. В 2008 г. удельное количество ПВВ V класса снизилось в три раза, а ПВВ VI класса – в два раза. Падение спроса связано с высокой стоимостью и небольшой эффективностью при проведении взрывных работ по сравнению с аммонитами IV класса[3]. Перспективной задачей является разработка новых рецептур ПВВ, которые бы имели высокие предохранительные свойства, достаточную эффективность при проведении взрывных работ и относительно низкую себестоимость. Целью моей работы является исследование ионообменного взрывчатого вещества на основе сульфата аммония. Актуальность работы состоит в том, что высокопредохранительные взрывчатые вещества позволяют уменьшить количество воспламенений метано-воздушной смеси (МBС)и угольной пыли, которые приводят к трагическим последствиям.  Краткий обзор основных этапов развития промышленных взрывчатых веществЧерный порох и динамит Первым взрывчатым веществом, которое стали применять в горнодобывающей промышленности, был черный порох. Его начали использовать с середины XVII века. При применении черного пороха получали хорошую степень дробления угля, но его использование в шахтах, опасных по газу или пыли, сопровождалось большим количеством воспламенений. При внедрении в угольную отрасль динамита, снизилось количество воспламенений в шахтах, по сравнению с порохом. Это объясняется различными режимами взрывчатого превращения порохов и динамитов. Было установлено, что для воспламенения МBС достаточно взорвать меньше одного грамма пороха или несколько грамм динамита.
Предохранительные взрывчатые вещества Первые исследования, связанные с разработкой ПВВ, были проведены французскими учеными Малляром и Ле-Шателье. Они предположили, что для обеспечения безопасности взрывных работ, достаточно снизить температуру взрыва до 1500 0С. Это возможно при использовании:
Немецкий исследователь К. Бейлинг в качестве основной причины воспламенения МВС предполагал выброс в газовую смесь дефлагрирующих твердых частиц. Основным требованием к ПВВ, по мнению Бейлинга, являлось исключение возможности образования при взрыве горящих частиц. Это предполагало разработку ПВВ с высокой детонационной способностью. Бейлинг создал смеси нитроглицерина с большим количеством инертных солей (бикарбиты), при взрыве которых не образовывались горящие частицы. Однако из-за низкой работоспособности их не стали применять, а использовали в качестве активных предохранительных оболочек. Согласно гипотезе Е. Одибера, воспламенение газовой смеси зависит от общей энергии заключенной в продуктах взрыва. При взрыве заряда ВВ продукты взрыва, имеющие высокую температуру, смешиваются с МВС. Если в процессе разбавления продуктов взрыва МВС будет достигнута температура вспышки, произойдет воспламенение смеси. Опыты Одибера показали, что ВВ с положительным и отрицательным кислородными балансами являются опасными в отношении воспламенения метана. Наименьшую опасность имеют составы, кислородный баланс которых близок к нулю. Взрывчатые вещества в предохранительных оболочках Необходимость введения большого количества инертных добавок и обеспечение высокой детонационной способности ВВ, привела разработчиков к идеи помещения зарядов ВВ в предохранительные оболочки из инертного материала. Изменяя толщину оболочки, можно придать заряду необходимую степень предохранительности. Так оболочка из 100 г бикарбоната натрия на патрон ВВ массой 100 г. предотвращает воспламенения МВС при взрыве такого опасного ВВ, как гремучий студень. В Германии разрабатывались активные предохранительные оболочки, которые состояли из бикарбоната натрия, хлористого натрия и 10% жидких нитроэфиров. Применение таких оболочек приводило к более равномерному распылению пламягасителя, к тому же она покрывала патрон со всех сторон, что повышало его предохранительность.
Патроны с предохранительной оболочкой имеют ряд недостатков: нарушение целостности оболочки при изготовлении, транспортировке и применении патронов ; сложность обеспечения равномерной толщины оболочки, усложнение технологического процесса и увеличение стоимости готового продукта. Эквивалентные взрывчатые вещества Основное отличие новых ПВВ состояло в том, что инертная соль, из которой ранее состояла оболочка, вводилась непосредственно в состав ВВ и равномерно в нем распределялась, т.е. исследователи вновь вернулись к «классическому» принципу построения ПВВ. Наиболее широко ПВВ данного типа применялись в Великобритании, были разработаны следующие составы: юниджекс, юнибел, юниред, юникол и др. Во время разработоки составов эквивалентных ВВ были проведены большие работы по изысканию наиболее эффективных добавок. Были определены ряд ингибиторов воспламенения метана. В настоящее время используется только хлористый натрий и калий, это объясняется их высокой эффективностью, недефицитностью и приемлемы физико-химическими свойствами. Роль инертных добавок сводится к следующему:
Высокопредохранительные взрывчатые вещества Первые высокопредохранительные ВВ составлялись по «классическому» принципу, введением большого количества инертных добавок. Однако такие ВВ имели низкую эффективность, их применение стало экономически не выгодным. Так работоспособность английского ВВ № 1235 составляла 50 см3. Высокую эффективность могут дать ВВ построенные на принципе селективной детонации. При взрыве открытого заряда реакция взрывчатого превращения затрагивает только сенсибилизатор, остальные компоненты разбрасываются продуктами детонации без разложения. Когда же заряд такого ВВ взрывается в условиях замкнутости, тогда выделяется полная потенциальная энергия взрыва. Первое селективно-детонирующее ВВ было разработано в ФРГ, оно содержало 15 % нитроэфиров и смесь порошкообразных медленно реагирующих невзрывчатых компонентов, один из которых являлся окислителем, а другой – горючим. В другом варианте ВВ данного типа древесная мука была заменена хлористым аммонием. В результате химической реакции хлористый натрий получался в ультрадисперсном виде. Такие ВВ получили название ионообменные. Эти ВВ имели высокую работоспособность по сравнению с ВВ построенными на «классическом» принципе. Так фугасность веттеркарбонита А составляла 100 см3. Применение селективно детонирующих ВВ позволило значительно повысить безопасность взрывных работ в угольных шахтах [2].  Практические исследованияИонообменное взрывчатое вещество на основе сульфата аммония Сегодня в основе ионообменного процесса лежит реакция взаимодействия нитрата натрия с хлоридом аммония, которая была предложена в 1902 г. Бихелем. В 2003 г. Зениним В. И. было внесено предложение, использовать в качестве ионообменной пары соли нитрата натрия и сульфата аммония. Был создан опытный образец ВВ на основе угленита П52. Этот выбор основан на следующих заключениях:
Расчет энергетических характеристик Для определения, какое из ПВВ эффективнее и безопаснее при проведенные взрывных работ в шахтах, опасных по газу и взрывам угольной пыли, проведен расчет их энергетических характеристик. Этот расчет был выполнен на ЭВМ, с использованием пакета Mathcad. В программе приведен расчет теплоты взрывчатого превращения, температуры взрыва, полной идеальной работы взрыва, коэффициента полезного действия взрыва и давления продуктов взрыва, составлены уравнения взрывчатого превращения. После проведения расчета были получены реакции взрывчатого превращения для ПВВ V класса. Реакция взрывчатого превращения для угленита 13П: 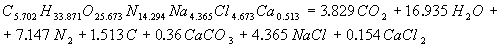 Реакция взрывчатого превращения для угленита П52: 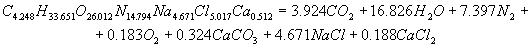 Реакция взрывчатого превращения для нового образца: 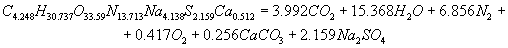 Реакция взрывчатого превращения для угленита VІ класса: 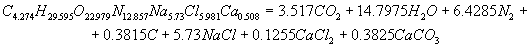 Рассчитанные энергетические показатели ПВВ приведены в таблице 2
На базе завода им. Петровского были проведены испытания на предохранительные свойства угленита П52 и образца подобного новому. Была определена предельная масса заряда ВВ при которой не происходит воспаления МВС, во время испытания в угловой мортире с отражательной стенкой на расстоянии 0.6 м. Для угленита П52 эта масса составляет 300 г. Для нового образца масса предельного заряда не меньше, чем у угленита 10П. Сульфонитрат аммония Полученный на заводе им. Петровского образец после хранения потерял сыпучесть, превратившись в сплошной монолитный заряд. Монолитные заряды теряют способность детонировать от электродетонатора. Целью моей дальнейшей работы стало изучение причины потери сыпучести нового образца, а так же нахождение путей решения данной проблемы. После изучения литературных источников была выявлена причина образования монолитного заряда. В результате взаимодействия аммиачной селитры и сульфата аммония образуется двойная соль - сульфонитрат аммония. Сульфонитрат аммония применяют в Германии в качестве удобрения, которое носит название лейна-селитра. В сульфонитрате аммония содержится (в пересчете на сухое вещество) 25.5 % – 26.5 % N , кислотность не превышает 0.3%, а влажность 2.5 %. Преимущество этой соли (по сравнению с составляющими ее компонентами) является: меньшая гигроскопичность по сравнению с аммиачной селитрой, меньшая слеживаемость и взрывоопасность.
Диаграмма тройной системы (NH4)2SO4 - NH4NO3 – H2O является основой для изучения процессов, протекающих при получении сульфонитрата аммония. Политермная диаграмма растворимости системы (NH4)2SO4 - NH4NO3 – H2O при 0, 30, 70 и 1000 приведены на рис.1 Точки b1, b2, b3 и b4 – эвтонические точки. Пунктиром разделены области существования (NH4)2SO4, NH4NO3 и двойной соли. В интервале температур от 0 до 1000 в присутствии жидкой фазы совместно могут существовать две твердые фазы: NH4)2SO4 *2 NH4NO3 + (NH4)2SO4 и NH4)2SO4 *2 NH4NO3 + NH4NO3, что определяет возможность получения двойной соли с избытком одной из солей. Существование двойной соли было доказано микроскопическим путем Иенекке, Эйснером и Брилем, которые также доказали что двойная соль NH4)2SO4 *3 NH4NO3 , ранее описанная Шрейнемекерсом и Хёненом, и Массинком не существует и что предположение о ее существовании обязано методу непрямого определения твердых солей в контакте с насыщенным раствором. Сульфонитрат аммония можно получать различными способами. Наиболее простой способ получения это смешивание во влажном виде эквимолекулярных весовых количеств сульфата аммония и нитрата аммония. Отдельные соли должны содержать влагу в таком количестве, чтобы вес воды составлял не более 4% их общего веса. Если соблюдать эту предосторожность, то влага испаряется в таком количестве, что смесь получается в виде сухого продукта. Теплота, вызывающая это испарение, выделяется вследствие образования двойной соли. Следующий способ образования основан на смешении нагретых компонентов. Перед поступлением в смеситель соли отсеиваются от крупных слежалых кусков, подвергающихся дроблению, и нагреваются – сульфат аммония до 1200, а нитрат – до 40-600. Более совершенный способ получения сульфонитрата аммония является смешение сухого сульфата аммония с 83% раствором нитрата аммония. Смешение проводят в шнековых аппаратах, их которых выходит масса с содержанием около 6% влаги. Эта масса измельчается между двумя чугунными валами с шипами, высушивается до влажности 0.1-0.2% в барабанной сушилке и рассеивается. Фракция с величиной кусков больше 4 мм подвергается размолу и возвращается на сито, а фракция с частицами менее 0.8 мм возвращается в смеситель. Можно получить сульфонитрат аммония нейтрализацией смеси серной и азотной кислоты. В реактор-сатуратор, снабженный мешалкой, одновременно подают 50%-ную азотную кислоту, 68%-ную серную кислоту и аммиак. В результате экзотермической реакции нейтрализации температура в сатураторе достигает 145-1500 и тепла хватает для испарения воды, вводимой с кислотами. Отходящие из сатуратора газы (аммиак) и пары воды поступают в ректификационную колонну, откуда аммиак возвращается в сатуратор. Непрерывно вытекающий из сатуратора плав содержит 2.5-3% свободной кислоты. Избыточная кислотность плава снижается до 0.1-0.3% введением в него аммиака в донейтрализаторе. Из донейтрализатора плав, содержащий 97-98% сухой соли и 2-3% влаги, направляют на кристаллизацию на поверхности охлаждающего барабана [6], [7], [4]. Лабораторные исследованияДля решения поставленной задачи, мной было предложено предварительное получение двойной соли, ее измельчение и введение в состав нового образца. В лабораторных условиях было проведено получение двойной соли путем обычного сплавления и путем смешения сульфата аммония и 83%-ного раствора нитрата аммония.
Для получения двойной соли методом сплавления проводят предварительное измельчение компонентов, взятие их навесок, тщательное перемешивание и установка в термошкаф на 2 с половиной часа при температуре 65-700. После извлечение препаратов из термошкафа можно увидеть, что часть смеси превратилась в прочный, монолитный кусок, а часть осталась в сыпучем состоянии. Наибольший объем монолитного куска был получен при соотношении компонентов, которое равняется 2:1 (рис.2). Для извлечения куска и его измельчения необходимо приложить большое усилие. Дальнейшее исследование направлено на определение сыпучести составов после их хранения. Для этого полученные составы помещают в бумажную упаковку и оставляют для выдержки.  Рис 3 - Схема процесса изготовления сульфонитрата аммония методом смешения сульфата аммония с раствором аммиачной селитры (40 кадров, 5 циклов, ширина 400, высота 242, 93.1 КБ, gif animator)
После извлечения препаратов из термошкафа можно увидеть, что препарат, который имеет наибольшее количество влаги, имеет рыхлую структуру (рис 4), а второй и третий препараты представляют собой прочный монолитный кусок, для извлечения и дробления которого необходимо приложить большое усилие. Измельченные составы помещают в бумажную упаковку и хранят в тех же условиях что и препараты первого опыта. После 22 дней хранения препаратов были получены следующие результаты:
ВыводыПосле проведенной работы можно сделать следующие выводы:
 Список литературы
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||