

 |
 Факультет екології і хімічної технологиїКафедра хімічної технології паливаСпеціальність: Хімічна технологія високомолекулярних сполукТема выпускной работы:Дослідження властивостей високозапобіжних вибухових сполукНаучний керівник: Манжос Юрій Вікторович |
| |
Реферат за темою випускної роботиСодержаниеВступКороткий огляд основних етапів розвитку промислових вибухових речовинПрактичні дослідження
Висновки Вступ Безперервний розвиток промисловості вимагає постійного збільшення видобутку вугілля, одного з основних видів енергетичної і хімічної сировини. Важливою технологічною операцією, що використовується під час видобутку вугілля з шахт, є вибухові роботи. Вибухи метану у вугільних шахтах стали спостерігатися, починаючи з XVIII століття, коли з'явилася необхідність розробляти пласти, що залягають на великих глибинах і володіють високою газоносністю. На сьогодні середня глибина пластів, що розробляються, перевищує 720 м, тринадцять шахт Донбасу працюють на глибині 1000...1400 м. Приблизно 90% шахт України є газовими, 60% - небезпечні із-за вибуху вугільного пилу [5] .
У вугільних шахтах, небезпечних за газом і вибухам вугільного пилу, дозволяється застосовувати лише запобіжні вибухові речовини (ЗВР). Останніми роками істотно знизилося використання ЗВР V і VI класів. До 1986 р. Частка ЗВР V класу складала 30-40% від загальної кількості ЗВР, а VI класу - 10-15%. У 2008 р. Питома кількість ЗВР V класу знизилася в три рази, а ЗВР VI класу - в два рази. Падіння попиту пов'язане з високою вартістю і невеликою ефективністю при проведенні вибухових робіт щодо амонітів IV класу [3]. Перспективним завданням є розробка нових рецептур ЗВР, які б мали високі запобіжні властивості, достатню ефективність при проведенні вибухових робіт і відносно низьку собівартість. Метою моєї роботи є дослідження іонообмінної вибухової речовини на основі сульфату амонія. Актуальність роботи сполягає в тому, що високозапобіжні вибухові речовини дозволяють зменшити кількість займань метано-повітряної суміші (МПС), які приводять до трагічних наслідків.  Короткий огляд основних етапів розвитку промислових вибухових речовинЧорний порох і динаміт Першою вибуховою речовиною, яку стали застосовувати в гірничодобувній промисловості, був чорний порох. Його почали використовувати з середини XVII століття. При застосуванні чорного пороху одержували хороший ступінь дроблення вугілля, але його використання в шахтах, небезпечних за газом або пилом, супроводжувалося великою кількістю займань. Після впровадження у вугільну галузь динаміту, різко знизилася кількість займань в порівнянні з порохом. Це пояснюється різними режимами вибухового перетворення порохів і динаміту. Було встановлено, що для займання МПС досить підірвати менше одного грама пороху або декілька грам динаміту.
Запобіжні вибухові речовини Перші дослідження, пов'язані з розробкою ЗВР, були проведені французькими вченими Малляром і Ле-Шателье. Вони припустили, що для забезпечення безпеки вибухових робіт, досить понизити температуру вибуху 1500 0С. Це можливо при використанні:
Німецький дослідник К. Бейлінг в якості основної причини займання МПС припускав викид в газову суміш дефлагруючих твердих часток. Основною вимогою до ЗВР, на думку Бейлінга, було виключення можливості утворення під час вибуху часток, що горять. Це припускало розробку ЗВР з високою детонаційною здатністю. Бейлінг створив суміші нітрогліцерину з великою кількістю інертних солей (бікарбіти), при вибуху яких не утворювалися частинки, що горять. Проте із-за низької працездатності їх не стали застосовувати, а використовували як активні запобіжні оболонки. Згідно з гіпотезою Е. Одібера, займання газової суміші залежить від загальної енергії, що міститься в продуктах вибуху. Під час вибуху заряду ВР продукти вибуху, що мають високу температуру, змішуються з МПС. Якщо в процесі розбавлення продуктів вибуху МПС буде досягнута температура спалаху, відбудеться займання суміші. Досліди Одібера показали, що ВР з позитивним і негативним кисневими балансами є небезпечними відносно займання метану. Найменшу небезпеку мають склади, кисневий баланс яких близький до нуля. Вибухові речовини в запобіжних оболонках Необхідність введення великої кількості інертних добавок і забезпечення високої детонаційної здатності ВР, привела розробників до ідеї виготовлення зарядів ВР в запобіжній оболонці з інертного матеріалу. Змінюючи товщину оболонки, можна отримати заряд необхідного ступінню запобіжності. Так оболонка з 100 г бікарбонату натрію на патрон ВР масою 100 г. запобігає займанням МПС під час вибуху такої небезпечної ВР, як гримучий студінь. У Німеччині розроблялися активні запобіжні оболонки, які складалися з бікарбонату натрію, хлористого натрію і 10% рідких нітроефірів. Застосування таких оболонок приводило до більш рівномірного розпилювання полум’ягасника, до того ж вона покривала патрон з усіх боків, що підвищувало його запобіжність.
Патрони із запобіжною оболонкою мають ряд недоліків: порушення цілісності оболонки під час виготовлення, транспортування і застосування патронів; складність забезпечення рівномірної товщини оболонки, ускладнення технологічного процесу і збільшення вартості готового продукту. Еквівалентні запобіжні вибухові речовини Основна відмінність нових ЗВР полягало в тому, що інертна сіль, з якої раніше полягала оболонка, вводилася безпосередньо до складу ВР і рівномірно в ньому розподілялася, тобто дослідники знов повернулися до „класичного” принципу побудови ЗВР. Найширше ЗВР даного типа застосовувалися у Великобританії. Були розроблені наступні склади: юніджекс, юнібел, юніред, юнікол і ін. Під час розробок складів еквівалентних ВР були проведені великі роботи по дослідженню найбільш ефективних домішок. Були визначені ряд інгібіторів займання метану. Сьогодні використовується тільки хлористий натрій і калій, це пояснюється їх високою ефективністю, недефіцитністю і прийнятні фізико-хімічні властивості. Роль інертних добавок зводиться до наступного:
Високозапобіжні вибухові речовини Перші високозапобіжні ВР складалися за „класичним” принципом, введенням великої кількості інертних добавок. Проте такі ВР мали низьку ефективність, їх застосування стало економічно не вигідним. Так працездатність англійського ВР №1235 складала лише 50 см3. Високу ефективність можуть дати ВР побудовані на принципі селективної детонації. За умови вибуху відкритого заряду реакція вибухового перетворення зачіпає тільки сенсибілізатор, решта компонентів розкидається продуктами детонації без розкладання. Коли ж заряд такої ВР вибухає в умовах замкнутості, тоді виділяється повна потенційна енергія вибуху. Перша селективно-детонуюча ВР була розроблена у ФРН, вона містила 15% нітроефірів і суміш порошкоподібних поволі реагуючих невибухових компонентів, один з яких був окислювачем, а інший - пальним. В іншому варіанті ВР даного типа деревна мука була замінена хлористим амонієм. В результаті хімічної реакції хлористий натрій утворювався в ультрадисперсному вигляді. Такі ВР одержали назву іонообмінні. Вони мали високу працездатність порівняно, з ВР побудованими на „класичному” принципі. Так фугасність веттеркарбоніту А складала 100 см3. Застосування селективно-детонуючих ВР дозволило значно підвищити безпеку вибухових робіт у вугільних шахтах [2].  Практичні дослідженняІонообмінна вибухова речовина на основі сульфату амонію Сьогодні в основі іонообмінного процесу лежить реакція взаємодії нітрату натрію з хлоридом амонію, яка була запропонована в 1902 р. Біхелем. У 2003 р. Зенінім В. І. була винесена пропозиція, використовувати в якості іонообмінної пари солі нітрату натрію і сульфату амонію. Був створений дослідний зразок ВР на основі вугленіту П52. Цей вибір обґрунтований наступними принципами:
Розрахунок енергетичних характеристик Для визначення, яке з ЗВР ефективніша і безпечніша при проведені вибухових робіт в шахтах, небезпечних за газом і вибухам вугільного пилу, проведено розрахунок їх енергетичних характеристик. Цей розрахунок був розроблен на ЕОМ, з використанням пакету Mathcad. У програмі приведений розрахунок теплоти вибухового перетворення, температури вибуху, повної ідеальної роботи вибуху, коефіцієнта корисної дії вибуху і тиску продуктів вибуху, складені рівняння вибухового перетворення. Після проведення розрахунку були одержані реакції вибухового перетворення для ЗВР V класу. Реакція вибухового перетворення для вугленіту 13П: 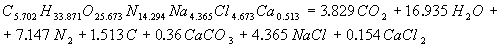 Реакція вибухового перетворення для вугленіту П52: 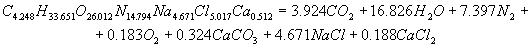 Реакція вибухового перетворення для нового зразка: 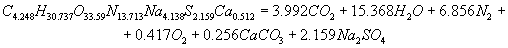 Реакція вибухового перетворення для вугленіту VІ класу: 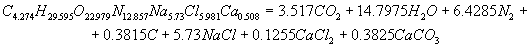 Розраховані енергетичні показники ЗВР приведені в таблиці 2
На базі заводу ім. Петровського були проведенні випробування на запобіжні властивості вугленіту П52 і нового зразку. Була визначена певна гранична маса заряду ВР при якій не відбувається запалення МПС, під час випробування в кутовій мортирі з відбивною стінкою на відстані 0.6 м. Для вугленіту П52 ця маса складає 300 г, для нового зразку маса граничного заряду не менша, ніж у вугленіту 10П. Сульфонітрат амоніюОтриманий на заводі ім. Петровського зразок після зберігання втратив сипучість, перетворившись на суцільний монолітний заряд. Монолітні заряди втрачають здатність детонувати від електродетонатора. Метою моєї подальшої роботи стало вивчення причини втрати сипучості нового зразка, а також знаходження шляхів вирішення цієї проблеми.Після вивчення літературних джерел була виявлена причина утворення монолітного заряду. В результаті взаємодії аміачної селітри і сульфату амонію утворюється подвійна сіль - сульфонітрат амонію. Сульфонітрат амонію застосовують в Німеччині як добриво, яке носить назву лейна-селітра. У сульфонітраті амонію міститься (у перерахунку на суху речовину) 25.5 % – 26.5 % N, кислотність не перевищує 0.3%, а вологість 2.5 %. Перевага цієї солі (в порівнянні з складовими її компонентами) є: менша гігроскопічність і вибухонебезпека в порівнянні з аміачною селітрою, вона менше злежується.
Діаграма потрійної системи (NH4)2SO4 - NH4NO3 – H2O є основою для вивчення процесів, що протікають при отриманні сульфонітрата амонію. Політермная діаграма розчинності системи (NH4)2SO4 - NH4NO3 – H2O при 0, 30, 70 і 1000 приведені на рис.1 Крапки b1, b2, b3 і b4 – евтонічеські крапки. Пунктиром розділені області існування (NH4)2SO4, NH4NO3 і подвійної солі. В інтервалі температур від 0 до 1000 у присутності рідкої фази спільно можуть існувати дві тверді фази: (NH4)2SO4 *2 NH4NO3 + (NH4)2SO4 і (NH4)2SO4 *2 NH4NO3 + NH4NO3, що визначає можливість отримання подвійної солі з надміром однієї з солей. Існування подвійної солі було доведено мікроскопічним шляхом Ієнекке, Ейснером і Брілем, які також довели що подвійна сіль (NH4)2SO4 *3 NH4NO3, раніше описана Шрейнемекерсом і Хененом, і Массинком не існує і що припущення про її існування зобов'язане методу непрямого визначення твердих солей у контакті з насиченим розчином. Сульфонітрат амонію можна одержувати різними шляхами. Найбільш простий спосіб отримання це змішування у вологому виді еквімолекулярних вагових кількостей сульфату амонію і нітрату амонію. Окремі солі повинні містити вологу в такій кількості, щоб вага води складала не більше 4% їх загальної ваги. Якщо дотримувати цю обережність, то волога випаровується в такій кількості, що суміш виходить у вигляді сухого продукту. Теплота, що викликає це випаровування, виділяється унаслідок утворення подвійної солі. Наступний спосіб освіти заснований на змішанні нагрітих компонентів. Перед надходженням в змішувач солі відсіваються від крупних злежалих шматків, що піддаються дробленню, і нагріваються – сульфат амонію до 1200, а нітрат – до 40-600. Більш довершений спосіб отримання сульфонітрату амонію є змішання сухого сульфату амонію з 83% розчином нітрату амонію. Змішання проводять в шнекових апаратах, з яких виходить маса із змістом близько 6% вологи. Ця маса подрібнюється між двома чавунними валами з шпильками, висушується до вологості 0.1-0.2% в барабанній сушарці і розсівається. Фракція з величиною шматків більше 4 мм. піддається помелу і повертається на сито, а фракція з частинками менше 0.8 мм. повертається в змішувач. Можна одержати сульфонітрат амонію нейтралізацією суміші сірчаної і азотної кислоти. У реактор-сатуратор, забезпечений мішалкою, одночасно подають 50%-ную азотну кислоту, 68%-ную сірчану кислоту і аміак. В результаті екзотермічної реакції нейтралізації температура в сатураторі досягає 145-1500 і тепла вистачає для випаровування води, що вводиться з кислотами. Гази (аміак), що відходять з сатуратора, і пари води поступають в колону, ректифікації, звідки аміак повертається в сатуратора. Плав, що безперервно витікає з сатуратора, містить 2.5-3% кислоти. Надмірна кислотність плава знижується до 0.1-0.3% введенням в нього аміаку в донейтралізатор. З донейтралізатора плав, що містить 97-98% сухої солі і 2-3% вологи, направляють на кристалізацію на поверхні охолоджуючого барабана [6], [7], [4]. Лабораторні дослідженняДля лабораторних досліджень беруться компоненти, які використовувалися на заводі ім. Петровського для виготовлення нового зразка: аміачна селітра ЖВК і сульфат амонію. Для проведення випробувань беруться навішування, які відповідають еквімолекулярній ваговій кількості сульфату і нітрату амонію в співвідношенні 1:1, 2:1 і 3:1. Навішування аміачної селітри складає 8 г., навішування сульфату амонію дорівнюють 11.4 г. для співвідношення 1:1, - 22.8 г. для співвідношення 2:1, і 34.2 г. для співвідношення 3:1.
Після витягання препаратів з термошафи можна побачити, що частина суміші перетворилася на міцний, монолітний шматок, а частина залишилася в сипкому стані. Найбільший об'єм монолітного шматка був одержаний при співвідношенні компонентів, яке дорівнює 2:1 (рис.2). Для витягання шматка і його подрібнення необхідно докласти велике зусилля. Подальше дослідження направлене на визначення сипучості складів після їх зберігання. Для цього одержані склади поміщаємо в паперову упаковку і залишаємо для витримки.  Рис 3 - Схема процесу виготовлення сульфонітрату амонію методом змішування сульфату амонію з розчином аміачної селітри (40 кадрів, 5 циклів, ширина 400, висота 242, 93.1 КБ, gif animator)
Після витягання препаратів з термошафи можна побачити, що препарат, який має найбільшу кількість вологи, має рихлу структуру (рис 3), а другий і третій препарати є міцним монолітним шматком, для витягання і дроблення яких необхідно докласти велике зусилля. Подрібнені склади поміщають в паперову упаковку і зберігають в тих же умовах, що і препарати першого дослідження. Після 22 днів зберігання препаратів були отримані наступні результати:
ВисновкиПісля проведенної роботи можна зробити наступні висновки:
 Перелік літератури
 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||