Реферат за темою випускної роботи
Зміст
- Вступ
- Введение
- 1. Мета, задачі й об'єкт досліджень
- 2. Вплив діоксиду сірки на людину, рослинний і тваринний світ
- 3. Огляд сухих і мокрих методів очищення газів, що відходять містять діоксид сірки
- 3.1 Методи на основі суспензій природних сорбентів
- 3.2 Методи на основі застосування розчинів солей натрію і амонію
- 3.3 Поглинання діоксиду сірки твердими поглиначами
- 3.4 Сухі методи сіркоочищення
- 4. Методика експеременту
- Висновки
- Перелік посилань
Вступ
1. Мета, задачі й об'єкт досліджень
Мета і завдання досліджень активації оксиду і карбонату кальцію є:
- Визначення температури сплаву активатора і карбонату кальцію, активатора та оксиду кальцію;
- Температури початку взаємодії з діоксидом сірки систем МеNO3 – CaCO3, МеNO3 – CaO;
- Визначення ефективності поглинання діоксиду сірки оксидом і карбонатом кальцію з використанням різних активаторів.
Об'єктом дослідження: взаємодія систем МеNO3 – CaCO3 и МеNO3 – CaO с SO2.
2. Вплив діоксиду сірки на людину, рослинний і тваринний світ
Діоксид сірки є одним з найбільш великих і важко піддаються очищенню забруднювачів атмосферного повітря. Він несприятливо впливає наздоров'я людини: викликає подразнення слизової оболонки очей, дихальних шляхів, спазм бронхів і збільшення опору дихальнихшляхів.
Крім впливу на здоров'я людини, діоксид сірки справляє негативний вплив на навколишнє середовище, зокрема, на рослинність,на будівлі та споруди.
Неодноразово вченими був вивчений вплив викидів теплоелектростанцій на здоров'я людей, що проживають в районах з різною інтенсивністюзабруднення атмосферного повітря, в результаті чого було встановлено наявність несприятливого впливу викидів на санітарно-побутові умови і здоров'я населення в зоні задимлення при максимальній концентрації S02 в атмосфері 3,3-4,0 і пилу 2,5-4,6 мг/м3. Загальне числоскарг і частота захворювань верхніх дихальних шляхів за деякими формами в цій зоні виявилася в два рази вище, ніж у відносно чистому районі. В основній групі школярів (зона задимлення) у більшості дітей відзначено знижений вміст гемоглобіну, виявлено наявність SO2 в крові (від слідів до 0,02 мг), висока захворюваність коньюнктивитами (13,3% порівняно з 3,8% у контрольному районі).
Результати дослідження впливу S02 на організм людини наведені в табл.1.
| Концентрація S02 у повітрі, мг/м3 | Концентрація пилу в повітрі, мг/м3 | Тривалість дії, год | Результати дії |
| 2600 | - | - | Миттєво призводить до смерті |
| 1400–1600 | - | 0.5–1 | Приводить до смерті |
| 400–500 | - | 0.5–1 | Викликає небезпечне для життя захворювання |
| 40–60 | - | 0.5–1 | Викликає подразнення слизових оболонок, чхання, кашель |
| 20 | - | - | Поріг дратівної дії |
| 8–10 | - | - | Викликає нюхові відчуття |
| 2–3 | - | - | Концентрація невідчутна за запахом |
| 0.72 | 0.75 | 24 | Частковий смертельний результат |
| 0.5 | Незначна | 24 | Підвищена смертність серед осіб певної категорії |
| 0.1–0.27 | 0.185 (дим) | Річна | Зростання захворювань верхніх дихальних шляхів і бронхіт |
| 0.115 | 0.16 (дим) | - | Підвищена смертність осіб з бронхіальною астмою і бронхітом |
Середня концентрація SO2 у повітрі змінюється залежно від кількості палива, що спалюється і вмісту в ньому сірки. Зазвичай ватмосферному повітрі діоксид сірки не міститься у великій концентрації. Зміст SO2 в атмосфері закономірно підвищується вкілька разів з настанням опалювального сезону, а також період несприятливих метеорологічних умов.
За наявності окремих випадків перевищення ГДК в цілому атмосферне повітря не характеризується екстремальними рівнями забруднення діоксидомсірки по відношенню до людини, в теж час ці рівні є небезпечними для рослинності, оскільки ГДК лісу в 3 рази нижче ГДК для повітрянаселених місць. При цьому багато інгредієнти, в тому числі SO2, при спільному перебуванні можуть створювати ефекти сумації абопотенціювання, у зв'язку з чим екологічна обстановка може бути небезпечною. Тому необхідно вести регулярний контроль за вмістомдіоксиду сірки в атмосфері і розробляти способи очищення [1].
Існує безліч методів для знешкодження газових викидів від SO2, але всі їх прийнято ділити на «сухі» і «мокрі».
Кожен з них може бути поділені на три групи:
- Перша забезпечує тільки санітарну очистку газу;
- Друга група передбачає циклічні процеси з отриманням товарного SO2 або сполук сірки;
- Третя група включає процеси, в результаті яких поглинач не повертається процес, а використовується для отримання нових хімічнихречовин. Нижче по докладніше розглянемо деякі з них [2].
3. Огляд сухих і мокрих методів очищення газів, що відходять містять діоксид сірки
3.1 Методи на основі суспензій природних сорбентів
Вапняковий (вапняний) метод
Метод очищення заснований на нейтралізації сірчистої кислоти, получающейся в результаті розчинення двоокису сірки, що міститься в димових газах,лужними реагентами: гидратом окису кальцію (вапном) або карбонатом кальцію (вапняком). При цьому протікають наступні реакції:
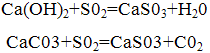
У результаті цих реакцій виходить сульфіт кальцію, частково окислюється в сульфат. У більшості випадків продукти нейтралізації не використовуються і спрямовуються у відвал.
Перевагами вапнякового (вапняного) методу є простота технологічної схеми, доступність в дешевизні сорбенту, щодомалі капітальні витрати, можливість очищення газу без попереднього охолодження і знепилювання.
До недоліків методу відносяться низький коефіцієнт використання вапняку, що залежить від типу застосовуваного мінералу і що досягає, якправило, 40-50%, отримання як продукту утилізації невикористаного шламу, відносно низька ефективність очищення, схильністьзабивання кристалічними відкладами абсорбційної апаратури та рідинних комунікацій.
Магнезитовий метод
Зв'язування двоокису сірки відбувається при взаємодії її з магнезитом по реакції:
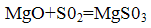
Утворився сульфіт магнію знову взаємодіє з двоокисом сірки і водою, утворюючи бісульфіт магнію:
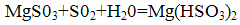
Утворився бісульфіт нейтралізується додаванням магнезиту:
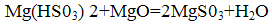
Утворився сульфіт магнію в процесі випалу при температурі 800-900 °С піддається термічному розкладанню з утворенням вихіднихпродуктів по реакції:
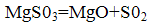
Окис магнію повертається в процес, а концентрований S02 може бути перероблений в сірчану кислоту або елементарну сірку.
Газ очищається від оксидів сірки до концентрації 0,03% в скрубері (рис. 1), а що утворився розчин бісульфіту магнію з концентрацією 50-70 г/л надходить в циркуляційний збірник, звідки частина розчину подається в напірний бак і повертається на зрошення скрубера, а інша частина внейтралізатор для виділення сульфіту магнію. Розчин з нейтралізатора виводиться в гідроціклоіи, потім пульпа прямує на стрічковийвакуум-фільтр і потім в випалювальну піч, де утворюються двоокис сірки і магнезит, повторно використовуваний в циклі.
Маточний розчин і промивна вода після фільтр-преса надходить до збірки освітленого розчину, куди додається магнезит з обпалювальнепечі. Розчин із збірки подається в напірний бак, де змішується з кислим розчином з циркуляційного збірника і прямує на зрошенняскрубера. Ступінь очищення газів від SO2 становить 90-92%.
Перевагою магнезитового способу є можливість досягнення високого ступеня очищення газів без попереднього їх охолодження. Випалсульфіту магнію може вироблятися на хімічному підприємстві за межами ТЕС, так як висушені і зневоднені кристали можутьдосить зручно транспортуватися.
Основним недоліком магнезитового способу є наявність численних операцій з твердими речовинами (кристалами сульфіту, окисумагнію, золи), що пов'язано з абразивним зносом апаратури і пилением. Для сушіння кристалів і видалення гідратної вологи потрібно значнекількість тепла.
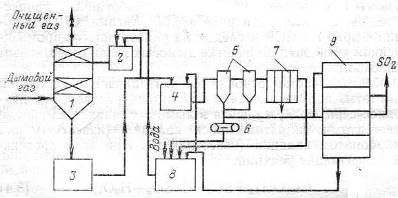
Рисунок 1 – Схема очищення димових газів від SO2 магнезитовим методом: 1 – скрубер; 2 – напірний бак; 3 – циркуляційний збірник; 4 – нейтралізатор; 5 – гідроциклони; 6 – стрічковий вакуум-фільтр; 7 – фільтр-прес; 8 – збірник освітленого розчину; 9 – обпалювальна піч [3].
3.2 Методи на основі застосування розчинів солей натрію і амонію
Аміачні методи
Аміачно-циклічний спосіб очищення газу дозволяє отримати зріджений 100%-іий сірчистий ангідрид і сульфат амонію - продукти, якіможуть знайти широке застосування в народному господарстві. Кількість відходів при цьому способі очищення невелика.
До числа недоліків способу слід віднести необхідність попереднього глибокого охолодження димових газів перед абсорбцією сірки. Глибокеохолоджування досягається водою, яка вступає в безпосередній контакт з газами і нагрівається при цьому до 40-50 °С. Така вода не може бутискинута у водойми загального користування, а її рециркуляція в системі охолодження вимагає нейтралізації кислоти вапном і охолодження вградирні. При нейтралізації утворюються солі кальцію, які можуть кристалізуватися в системі охолодження. Очищені охолоджені газивимагають значної кількості теплоти для їх підігріву перед викидом в атмосферу.
Викиди повітря з градирень, охолоджуючих рідина, що витікає із скруберів, містять деяку кількість аміаку, яке можезабруднювати атмосферу. Додатковий витрата палива, пов'язаний із споживанням пари на регенерацію розчину, випарки і сушку сульфату амонію,витрата електроенергії на установку і палива на підігрів очищених газон складають близько 10% палива, що витрачається на ТЕС. Апаратурасероулавливающих установки досить громіздка і має високу вартість.
Методи з застосуванням розчинів соди
Сутність цього методу полягає в промиванні відведених газів водними розчинами кальцинованої соди. При цьому протікають реакції:
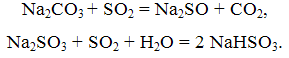
Процес поглинання SO2 содовим розчином здійснюється в апаратах насадочного або барботажного типів. Газ проходитьпослідовно дві вежі, перша з яких зрошується розчином NaHSO3, друга – розчином Na2SO3.Содовий спосіб забезпечує хорошу очищення відведених газів від SO2 з одночасним отриманням товарної солі NaHSO3 і Na2SO3.
Перевагами методів, заснованих на застосуванні водних розчинів солей натрію, є висока ефективність очищення, відсутність вабсорбенті твердих складових, отримання в якості продуктів утилізації цінних для народного господарства речовин.
До недоліків зазначених методів відносяться підвищена окислюваність солей в циклі сорбції та регенерації, що призводить до додаткових витратсорбенту; відносна дефіцитність сорбенту; складність технологічної схеми; підвищені витрати пари на регенерацію в циклічнихпроцесах; підвищена корозійна активність абсорбенту.
Кислотно-каталітичні методи
Кислотно-каталітичний метод заснований на отриманні в зоні абсорбції слабкою сірчаної кислоти (10-15 вагу.%), Що знаходить обмежене застосування.
До недоліків методу, що послужило перешкодою для його широкого розповсюдження в промисловості, відноситься низька швидкість окислення SO2 у розчинах сірчаної кислоти, незважаючи на застосування різних каталізаторів, а також різке зниження активності каталізаторівпід дією інгібуючих органічних домішок, наприклад, присутніх у газах ТЕС [5].
3.3 Поглинання діоксиду сірки твердими поглиначами
Недоліки мокрих методів очищення викидних газів від SO2 (зниження температури і зволоження викидається газового потоку, корозія апаратури, громіздкість і висока вартість установки) викликали необхідність розробки процесів, заснованих на поглинанні SO2 з газових потоків адсорбентами і хімічно активними поглиначами при температурі, що перевищує точку роси газу. такі роботи останнім часом широко проводяться у всіх промислово розвинених країнах. Багато дослідників вважають сухі процеси дуже перспективними для очищення викидних газів, особливо в енергетичній промисловості та кольорової металургії.
Капітальні витрати на спорудження установок для очищення газів сухими методами, як правило, нижче, а експлуатаційні витрати часто буваютьзначними. З умовами регенерації сорбентів і очищення викидаються газів від пилу поглотительного матеріалу пов'язана появазмішаних процесів, де поряд з сухими застосовуються мокрі цикли.
3.4 Сухі методи сіркоочищення
З сухих методів сіркоочищення розглянуті тільки процеси, що використовують природні реагенти. Існують і інші сухі способи, наприклад,процеси, розроблені фірмою «Бергбау-Форшунг», «УОП-Шелл» і деякі ін Однак ці технології складні і малоперспективні в умовахелектростанцій [6].
Сухий адитивний метод
Метод полягає в тому, що тонкоразмолотий вапняк вводиться в топку котла. При цьому вапняк обпалюється (кальцинується) з утвореннямокису кальцію і вуглекислоти
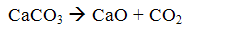
При температурі димових газів 500 ... 900 ОС окис кальцію взаємодіє з сірчистим ангідридом з утворенням сульфіту кальцію
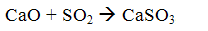
потім, за рахунок кисню, що міститься в димових газах, частина сульфіту кальцію доокісляется в сульфат
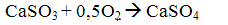
Після котла суміш сульфіту і сульфату кальцію разом з попелом і непрореагіровавшей вапном вловлюється в золоуловлювачах.
Цей метод випробуваний у багатьох країнах у різних модифікаціях, як на стендових, так і промислових установках. Введення Аддітіва в топкуздійснювався за різними схемами:
- шляхом добавки до палива;
- вдмухуванням у надфакельное простір;
- через пальники в периферійну область факела.
Сухий адитивний метод технологічно найбільш простий з усіх відомих на сьогодні методів знесірчування димових газів. У порівнянні зіншими методами він вимагає найменших капітальних і експлуатаційних витрат, легко реалізується в умовах діючої електростанції.Фактором, що стримує застосування методу, є його низька ефективність, складова в середньому 30 ... 40%. Крім того, можливостізастосування методу обмежуються умовами безшлаковочной роботи екранів топки і високотемпературних поверхонь нагріву.
Через те, що кінцевий продукт містить хімічно активний сульфіт виникає проблема складування відходів.
У той же час на основі цього методу розроблена технологія «SONOX» (Канада) в енергосистемі «ONTARIO HYDRO», для одночасного зниженнявикидів окислів сірки а азоту. У ній, при використанні як реагенту вапняку ККД сіркоочищення становить 70%, а азотоочистки 90%. Придодаванні в суспензію вапняку 5-ти відсоткової присадки доломіту каменю ККД сероочістнкі вдалося підвищити до 80% [7].
Метод «Ліфак»
Процес «Ліфак», розроблений фінською фірмою «Тампелла» по суті є поєднанням сухого адитивного і напівсухого методів сероулавліванія.
Принципова технологічна схема установки «Ліфак» показано на рис.2.
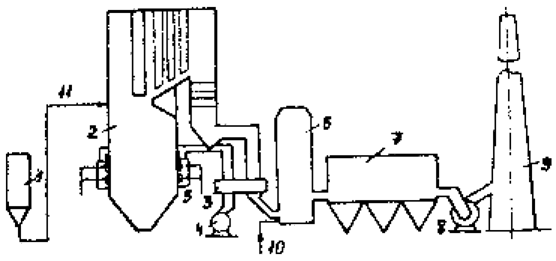
Рисунок 2 – Схема установки «Ліфак»: 1 – бункер вапняку; 2 – котел; 3 – регенеративний повітронагрівач; 4 – дуттєвий вентилятор; 5 – пальники; 6 – активаційний реактор; 7 – електрофільтр; 8 – димосос; 9 – труба; 10 – підведення воды; 11 – введення вапняку до топки
Вапняк а вигляді дрібнодисперсного пилу, 80% фракцій якої мають розмір не більше 32 мкм, вводиться за допомогою пневматичних сопел в потікдимових газів з температурою 950 ... 1100 ° С. У цьому інтервалі відбуваються кальцинування вапняку з реакції (1). Далі по тракту котлавідбувається зв'язування частини діоксиду сірки по реакціях (2) і (3). Ступінь уловлювання діоксиду в цій фазі процесу становить 30 ... 35%. На цьомуетапі і не ставиться завдання досягнення максимального ступеня зв'язування SО2. Не менш важливо забезпечити оптимальний процескальцинування – максимально можливий перехід вапняку в окис кальцію. З зміною навантаження зона оптимальних для кальцинуваннягазових температур переміщується. Тому вузли введення вапняку доцільно виконувати принаймні в двох перетинах газового тракту.
Після котла димові гази, що містять суміш твердих речовин у вигляді золи, сульфіту і сульфату кальцію і непрореагіровавшей вапна надходить уактиваційний реактор, в який впорскується вода. Распиліваніе води до оптимального розміру крапель забезпечується за допомогою системисопел, розробленої фірмою Тампелла.
У реакторі негашене вапно СаО в результаті контакту з водою переходить в активну гашене, яка з'єднується з SО2 зутворенням сульфіту кальцію:
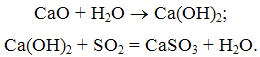
Під час руху газового потоку в реакторі краплі рідини випаровуються, температура газів знижується. На виході з реактора залишається суха сумішзоли, сульфіту і сульфату кальцію, яка потім уловлюється в електрофільтрі або в рукавному фільтрі.
Загальна ступінь очищення досягає величини при молярному співвідношенні Са/S рівному 2 (рис.3). Ефективність очищення тим вище, чим ближчетемпература потоку до температури точки роси.
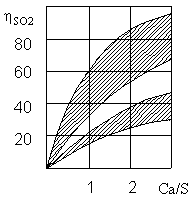
Рисунок 3 – Залежність ступеня очищення ηSО2 димових газів від сірчистого ангідриду від співвідношення Са/S [7]
Температура димових газів в реакторі підтримується на 10 ... 15 ° С вище температури точки роси, що забезпечує отримання продуктів реакції всухому вигляді.
- летюча зола – 50 ... 70;
- сульфат кальцію – 10 ... 15;
- сульфіт кальцію – 10 ... 15;
Залишок аддитива (СаО, СаСО3, Са(ОН)2) – 10...20.
Основні об'єкти автоматизації процесу такі:
- введення вапняку регулюється залежно від кількості подаваного палива. З огляду на те, що якість надходить палива (серосодержаніе,вологість, зольність і ін) змінюється, кількість подаваного вапняку автоматично коригується по концентрації SО2 у димовихгазах після котла;
- кількість введеної в реактор води регулюється залежно від кінцевої температури газів в реакторі, перевищує на 10 ... 15 °С температуру точки роси.
Високий ступінь автоматизації установки, дистанційне керування обладнанням з щита управління спрощує її обслуговування,здійснюване, як правило, тільки обхідниками.
Додатково вимагаються площі виявляються мінімальними, оскільки реактор розміщується в дещо модифікованому газоході котла, щоособливо важливо в разі оснащення сероулавливающих установками діючих ТЕС. Капітальні та експлуатаційні витрати на установку «Ліфак» значно нижче витрат на сіркоочисної установки з будь-якого іншого методу [7].
4. Методика эксперементу
Але всі представлені методи не досконалі, у зв'язку з цим виникає необхідність у створенні універсального поглинача, який зміг бипрацювати в широкому діапазоні температур і концентрацій, а також не вимагав подальшої переробки або утилізації.
В якості такого поглинача може виступати оксид і карбонат кальцію, реакція процесу:
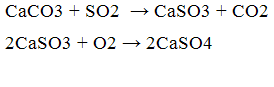
Також використання в якості поглинача карбонату і оксиду кальцію представляється раціональним з наступних причин:
- імовірно висока реакційна здатність стосовно до оксиду сірки (IV);
- відсутність необхідності в додатковій обробці;
- виділення тепла, яке в перспективі можна використовувати.
Ще одним важливим достоїнством таких поглиначів є його низька вартість, широке розповсюдження в природі, а також можливістьпереробляти відходи виробництв з отримання соди. Що в свою чергу, вирішує відразу кілька проблем, утилізація відходів, отримання сировини,поглинача, без вилучення природних ресурсів. У зв'язку з цим, дана робота є дуже актуальною і затребуваною по рядувищевикладених причин.
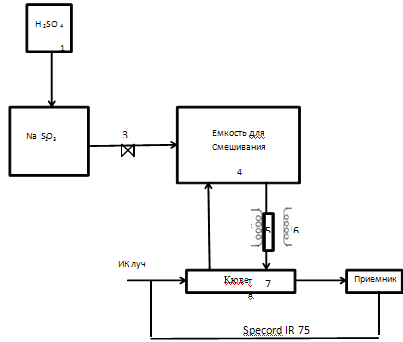
Рисунок 4 – Принципова лабораторна схема установки поглинання діоксиду сірки оксидом і карбонатом кальцію.
У колбу 2, яка є реакційною ємністю для отримання сірчистого газу засипається навіс Na2SO3. Отриманий SO2 через осушувач, в ролі якого виступає силикогель, подається насосом 3 в ємність змішання, яка представляє собою 20 л.балон 4, необхідний для досягнення рівномірно малих концентрацій SO2 близько 6 г/л. Далі усереднити газ проходить черезпоглинальну трубку 5, вміщену в трубчасту піч 6, температура якої варіюється а широких інтервалах. Далі газ проходить через кювету 7 при цьому на приладі (Specord IR 75) фіксується зміст SO2 у вигляді піків на спектрограмі.
Далі отримані дані аналізуються і досвід повторюється.
Спочатку отримані дані проведені нижче.
Для наочності наводиться таблиця температур взаємодії сполук кальцію і активатора.
Таблиця 2 – Температура сплавки активаторів і з'єднань кальцію
| З'єднання кальцію | Активатор | Температура взаємодії активатора і сполуки кальцію, оС |
| СаСО3 | Активатор 1 | 215 |
| Активатор 2 | 272 | |
| СаО | Активатор 1 | 210 |
| Активатор 2 | 260 |

Рисунок 5 – ІК спектри поглинання SO2 з додаванням активатора 1 – CaCO3 залежно від температури
(анімація: 9 кадрів, 5 циклів повторення, 16,3 кілобайт)
З представлених даних, видно що на першому і другому ділянці спостерігаються максимальні концентрації SO2 = 6 г/л. Це говорить, протому, що від кімнатної температури до +194 оС ніяких змін не спостерігається, а в інтервалі температур від + 194 оС до +210 оС йде інтенсивнепоглинання діоксиду сірки, про що свідчить зменшення піків SO2, а вже на останній ділянці ми можемо спостерігати повнезникнення піків SO2. Про повноту поглинання свідчить так само той факт, що чутливість ІЧ спектроскопії на SO 2 становить 0,09 мг/л.
Висновки
Перелік посилань
- Ганз С.Н., Кузнецов И.Е. Очистка промышленных газов.– Киев, 1967
- Алиев Г.М.-А. Техника пылеулавливания и очистки промышленных газов. Справочник М.: Металлургия, 1986. – 544 с.
- Э.М. Соколов, В.М. Панарин, А.А. Зуйкова, Н.А. Криничная. Абсорбционно-каталитический способ очистки дымовых газов от диоксида серы [Электронный ресурс]. – Режим доступа: http://www.eco-oos.ru/biblio/konferencii/ekologiya-obrazovanie-i-zdorovyi-obraz-jizni/07/
- А.В. Гладкий «Абсорбционные методы очистки газов от двуокиси серы» / М. ЦИНТИХИМНЕФТЕМАШ, 1978.
- Абсорбционно-каталитический способ очистки дымовых газов от диоксида серы [Электронный ресурс]. – Режим доступа: http://works.tarefer.ru/94/100077/index.html
- Носков А.С., Пай З.П. Технологические методы защиты атмосферы от вредных выбросов на предприятиях энергетики. Аналит. обзор СО РАН, ГПНТБ, Институт катализа, Новосибирск, 1996. Вып.40.
- Кочетков А.Ю., Коваленко Н.А., Кочеткова Р.П. и др. Катализаторы жидкофазного каталитического окисления сернистых соелинений в сточных водах//Катализ в промышленности, 2003. № 4.
- В.И. Смола, Н.В. Кельцев «Защита атмосферы от двуокиси серы» / М. «Металлургия», 1976.
