






ВСТУП
Метою роботи є вивчення реакцій комплексоутворення та оборотного зв'язування молекулярного кисню з утворенням однорідних та змішанолігандних комплексів кобальту(ІІ). Об'єктом дослідження є оксигеновані комплекси кобальту з дипіридилом і гліцилаланіном. Предметом дослідження є змішанолігандна система кобальт – дипіридил – гліцилаланін – кисень. Необхідно відмітити необхідність досягення даної мети з екологічної точки зору. Координаційні з'єднання перехідних металів в низьких ступенях окислення здатні оборотно зв'язувати молекулу кисню. Ці з'єднання є моделями активних центрів в складних біологічних з'єднаннях (гемоглобіні, міоглобіні, гемеритрині, гемоцианіні, хлорокруорині, гемованадіні). Oсобливо близьким до природних перенощиків кисню є комплесні сполуки кобальту, які здатні оборотно зв'язувати молекулу кисню в водних середовищах, аналогічно природним активним центрам, і являють собою моделі природних переносників киcню.
Синтетичні переносники кисню, такі як комплексні сполуки кобальту, можуть знайти застосування при створенні нових лікарських препаратів, застосовуватися в киснетерапії. Також, вони мають широке застосування в сфері промисловості. Вони можуть служити джерелами чистого кисню для різних технологічних цілей. Основні кількості одержуваного таким шляхом кисню використовуються в металургії. Кисневе, (а не повітряне) дуття в домнах дозволяє істотно підвищити швидкість доменного процесу, економити кокс і одержувати чавун кращої якості. Кисневе дуття застосовують в кисневих конвертерах при переробці чавуну в сталь. Чистий кисень або повітря, що збагачене киснем, використовується при отриманні і багатьох інших металів.
АКТУАЛЬНІСТЬ
Актуальність полягає в наступному. По-перше здатність комплексних сполук кобальту оборотно приєднувати молекулу кисню є важливою з екологічного погляду. Оскільки ці з'єднання є моделями активних центрів в складних біологічних сполуках (гемоглобіні, міоглобіні, гемеритрині, гемоцианіні). Тому можуть розглядатися як природні переносники кисню. Вже розроблені такі препарати, як перфторан, перфукол на основі перфторорваних вуглеводнів, проте вони не досконалі і володіють рядом недоліків, які перешкоджають їх застосуванню в клінічних умовах. У ряді країн ведеться пошук комплексних поліфункціональних замінників під назвою «штучна кров», які мають інгредієнти, що забезпечують стабільне наповнення судин, перенесення кисню, поживних і біологічно-активних речовин, збереження водно-сольового обміну, видалення продуктів обміну. Тому, для вирішення цієї проблеми необхідно шукати більш оптимальні синтетичні переносники кисню. Саме тому вивчення властивостей оксигенованих комплексних сполук кобальту з можливим застосуванням як синтетичних носіїв кисню є актуальним.
По-друге з відомих в даний час комплексів, які здатні оборотно зв'язувати молекулярний кисень особливий інтерес представляють саме змішанолігандні кисневі комплекси, що містять у внутрішній координаційній сфері у вигляді ліганда гліцилаланін і дипіридил. Актуальним є також сам підхід дослідження процесу комплексутворення та оксигенації в системі кобальт – гліцилаланін – дипіридил – кисень. Схема рівноваг включає не тільки реакції утворення змішанолігандних комплексів, і процес їх оксигенації, але і реакції утворення і оксигенації однорідних комплексів з кожним із лігандів.
Наукова значущість
Наукова значущість роботи полягає у вивченні процесів комплексоутворення і оборотного зв'язування молекулярного кисню в системі кобальт – дипіридил – гліцилаланін. Даний процес включає реакції утворення не тільки змішанолігандних сполук, але і однорідних комплексів як з гліцилаланіном так і з дипіридилом. В результаті проведених досліджень складені схеми процесів комплексутворення та оксигенації однорідних систем, а також змішанолігандної системи кобальт – дипіридил – гліцилаланін. Складена схема рівноваги процесу а також математична модель процесу комплексоутворення та оксигенації в атмосфері повітря.
Практична цінність результатів роботи
Одержані результати проведеної роботи розширюють існуючі уявлення про процеси комплексоутворення і оборотного звязування молекулярного кисню, в складних системах, що містять сіль кобальту і два різних ліганда (гліцилаланін і дипіридил). А також доповнюють знання про склад оксигенованих комплексів, які утворюються залежно від рН розчину, в змішанолігандних системах.
Одержані константи можуть використовуватися як самостійні довідкові величини, а дані про найбільшу концентрацію комплексу при кожному визначеному рН можуть бути використані для отримання необхідного комплексу – синтетичного переносника кисню.
ОГЛЯД ДОСЛІДЖЕНЬ
Згідно літературним даним координаційні з'єднання перехідних металів в низьких ступенях окислення здатні оборотно зв'язувати молекулу кисню. До цих з’єднань також відносяться комплекси кобальту(ІІ). Реакції оксигенації комплексів перехідних металів дозволяють знайти аналогії з процесами перетворення О2 в живих організмах. Тому комплексні сполуки кобальту відносять до синтетичних переносників кисню. Окислення молекулярним киснем, який транспортують природні переносники кисню, різних субстратів в живих організмах служить основним джерелом енергії в процесах життєдіяльності.
Для вирішення проблеми пошуку комплексних полі функціональних переносників кисню ведуться пошуки в таких напрямках:
Одержання кровозамінників на основі повністю фторованих вуглеводних сполук (фторовуглеводні);
Дослідження різних хелатних сполук;
Вивчення можливості використання штучного гемоглобіну й штучних еритроцитів, розчинів хімічно модифікованого гемоглобіну
У цілому рішення цієї проблеми вимагає пошуку оптимальних синтетичних переносником молекулярного кисню.
Автори наводять дані досліджень, згідно з якими при використанні на до госпітальному етапі синтетичних переносників кисню спостерігається відновлення кисневої ємкості крові за допомогою оксигенованих комплексів кобальту α,α-дипіридилом і дипептидами при терміних травмах.
Вельми незначна інформація про реакційну здатність координованого молекулярного кисню в комплексах перехідних металів. Разом з тим наявні дані дозволяють рахувати, що координований молекулярний кисень в багатьох з'єднаннях знаходиться в активованому стані. Такі оксигеновані комплекси можна розглядати як моделі не тільки природних носіїв О2, але і металоферментів, які каталізують реакції окислення.
Інтерес до активації координованого молекулярного кисню викликаний також можливістю утворення короткоживучих інтермедіатів в гомогенно-каталітичних реакціях автоокислення. Особливе значення для з'ясування механізмів реакцій представляють дослідження реакційної здатності О2 в оксигенованному комплексі. Вивчення реакцій інтермедіату дозволяє представити складний механізм гомогенно-каталітичної реакції у вигляді окремих стадій. Отже, з'єднання перехідних металів з О2 виконують найважливішу роль для моделювання біологічних процесів, а також для з'ясування механізму і пошуку каталізаторів окисно-відновних процесів.
Проте роль комплексів кобальту(II) з О2 не обмежена тільки хімічними, біологічними і медичними аспектами.
Вони можуть служити джерелами чистого кисню для різних технологічних цілей. Основні кількості одержуваного таким шляхом кисню використовуються в металургії. Кисневе, (а не повітряне) дуття в домнах дозволяє істотно підвищити швидкість доменного процесу, економити кокс і одержувати чавун кращої якості. Кисневе дуття застосовують в кисневих конвертерах при переробці чавуну в сталь. Чистий кисень або повітря, що збагачене киснем, використовується при отриманні і багатьох інших металів (міді, нікеля, свинця і ін.).
Аналіз літературних даних [3 – 5] показує, що відомі дикисневі комплекси кобальту можна розділити на дві групи: моноядерні із співвідношенням Со:О2 = 1:1, і біядерні із співвідношенням Со:О2 = 2:1. Біядерні дикисневі комплекси діляться в свою чергу на: мономісткові, в яких молекула кисню виступає як місткова група між двома іонами кобальту(II), і бімісткові, в яких окрім О2-містка є ще один місток, частіше це ОН-- рідше NH2-группа. За міцністю зв'язку молекули кисню з центральним іоном кобальту дикисневі комплекси можна розділити на дві групи: необоротно зв'язуючі молекулярний кисень дикисневі комплекси і оборотно зв'язуючі молекулярний кисень оксигеновані комплекси (переносники молекулярного кисню). Останні при слабкому нагріванні або при зменшенні парціального тиску кисню легко віддають приєднаний кисень.
Механізм утворення дикисневих комплексів. У загальному вигляді утворення дикисневих комплексів кобальту може бути передане наступною схемою [6, 7], (заряди іонів опущені):
| CoL2 + O2 ↔ CoL2O2 | (1) | |
| CoL2O2 + CoL2 ↔ L2CoO2CoL2 | (2) |
Рівняння (1) відповідає утворенню моноядерного дикисневого комплексу. Якщо при цьому не створені сприятливі умови, які стабілізують моноядерний дикисневий комплекс, то він перетворюється на біядерний комплекс (рівняння (2)) [6, 8]. До стабілізуючих чинників, які запобігають утворенню біядерних комплексів, відносяться: застосування донорних розчинників з низькою діелектричною константою [9]; просторові чинники, що затрудняють димеризацію комплексу, низька температура розчину, низька концентрація комплексу [10]; застосування як лігандів макромолекули, які знижують можливість утворення О2-містка між двома центральними іонами кобальту(II) [11]. У водних розчинах утворення дикисневих комплексів практично завжди призводить до утворення біядерних комплексів.
Інша модель процесу утворення бімісткових комплексів виходить з того, що координована іоном металу молекула води володіє значними, в порівнянні з вільною молекулою кислотними властивостями [5]. У зв'язку з цим, незалежно від наявності в системі молекулярного кисню, комплекси – носії молекулярного кисню, що містять у внутрішній сфері дві молекули води, знаходитимуться у водному розчині в складній кислотно-основній рівновазі. У серії робіт [6 – 7], в яких досліджені комплекси кобальту(ІІ), які містять у внутрішній сфері два бідентатних ліганда і дві молекули води загальної формули [CoL2(H2O)2]n+, рН-метричним титруванням лугом в інертній атмосфері встановлено, що на моль початкового комплексу витрачається 0,5 моль лугу, що свідчить про утворення в розчині гідроксодимера за сумарною реакцією:
| 2[CoL2(H2O)2]n+ + OH- ↔ [L2Co(OH)2 – OH – Co(OH)L2](n-1) + 2H2 | (3) |
Приєднання молекулярного кисню комплексами кобальту(II). У [2] приведені результати рН-метричного титрування лугом в інертній атмосфері розчину солі кобальту(II) з десятиразовим надлишком гліцилаланіну. Результати цих експериментів показали, що скачок титрування спостерігається при додаванні одного моля лугу на моль дипептиду, що свідчить про те, що у внутрішній координаційній сфері бісдипептидного комплексу кобальту(II), який утворюється в інертній атмосфері, містяться депротоновані однозарядні аніони дипептиду (DpH-).
У [5] автори пропонують дві оборотні реакції приєднання молекулярного кисню комплексами кобальту з гліцилаланіном (рівняння 4 – 5).
Таким чином, згідно [6] два бісдипептидних комплекси кобальту(II) володіють здатністю приєднувати молекулярний кисень. Перший з них (рівняння 4) це змішанолігандний комплекс кобальту(II), який містить у внутрішній координованій сфері в якості лігандів один однозарядний аніон гліцилаланіну з протонованим пептидним атомом азоту (GlyalaH-) і один двохзарядний аніон дипептиду, в якому пептидний атом азоту депротонований (Glyala2-). При приєднанні молекулярного кисню утворюється біядерний мономістковий (μ-О2) оксигенований комплекс кобальту(II), що містить у внутрішній координаційній сфері тільки двохзарядні аніони гліцилаланіну (Glyala2-), (Co(Glyala)2)2O24-. Інший комплекс, що приєднує молекулярний кисень, – це бісдипептидний комплекс кобальту, який містить у внутрішній координованій сфері два двохзарядні аніони гліцилаланіну Co(Glyala)22-. При його оксигенації (рівняння (5) утворюється той же біядерний мономістковий оксигенований комплекс (Co(Glyala)2)2O24-, що і за реакцією (4).
Кількісно процес приєднання молекулярного кисню автори [4] характеризують трьома константами: КO22, K0O2, КA2, які є константами рівноваги реакцій (4) і (5), а також рівноваги (6):

Анімація. Кількість кадрів 20. Кількість повторів 10.
У [6] досліджений ряд комплексів кобальту(II) з дипептидами, здатними займати чотири координаційні місця металу. В цьому випадку, як і слід було чекати, процес оксигенації призводить до утворення біядерного (μ-О2, μ-ОН) бімісткового оксигенованого комплексу складу [GlyalaCo(O2OH)(Glyala)2]. У [4, 6] підтверджено утворення біядерних бімісткових (μ-О2, μ-ОН) оксигенованих комплексів кобальту(II) з гліцилаланіном. Таким чином, аналіз літературних даних показує, що при взаємодії суміші солі кобальту(II) і дипептиду (Co:DpH2 = 1:2) у присутності кисню може утворитися оксигенований біядерний мономістковий комплекс складу [(Co(Dp)2)2O2]4-.
В цілому, приведений вище короткий аналіз літературних даних показав. Відомі оксигеновані комплекси кобальту(II) діляться на одноядерні (Со:О2 = 1:1) і біядерні (Со:О2 = 2:1). Останні в свою чергу поділяються на мономісткові (μ-О2) і бімісткові (μ-О2, μ-ОН) комплекси. У системах кобальту(II) – дипептид – кисень (Со:DpH2=1:2) утворюється біядерний мономістковий (μ-О2) оксигенований комплекс [(CoDp2)2O2]4-. У змішанолігандних системах з двома бідентатними лігандами (диамін і аніон амінокислоти) при оксигенації утворюються біядерні бімісткові оксигеновані комплекси.
рН-ПОТЕНЦІОМЕТРИЧНЕ ДОСЛІДЖЕННЯ
рН-потенціометрично, методом молярних відносин встановлювався склад комплексів, що утворюються в розчині, в атмосфері повітря. Титрували водні розчини чистих лігандів з концентрацією 5·10-3 при іонній силі 0,1 (KNO3), t=250С, суміші солі кобальту(II) і дипептидів (молярне відношення 1:2) в атмосфері повітря (μ = 0,1(KNO3). Аналогічним чином досліджувалися суміші солі кобальту(II), дипептиду і гліцилаланіну (молярні відносини 1:1:1) в інертній атмосфері і в атмосфері повітря (утворення змішанолігандних комплексів). В цілому проводилося 5 серій дослідів по кожній з даних систем, окремі експериментальні значення відхилялися від середнього значення не більш ніж на 0,04 – 0,07 од. рН, в подальших розрахунках використовувалися усереднені значення. Схема установки для проведення рН-потенціометричних досліджень представлена нижче.
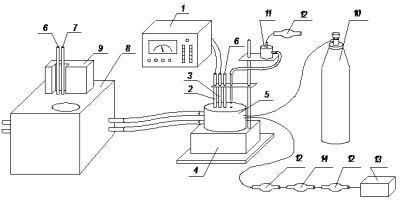
Як реєструючий прилад використовувався мілівольтметр типу рН-121. Наладка рН-метра проводилася з використанням стандартних буферних розчинів із значенням рН 1,68, 4,01, 6,86, 9,18. Основна погрішність вимірювання мілівольтметра типу рН-121 складає ±0,05. Як електрод порівняння використовувався хлоридсрібний електрод типа ЕВЛ-1МЗ. Індикаторним електродом служив скляний електрод типа ЕСЛ-43-07. Реакційний осередок (5) з розчином термостатується водою, яка прямує з термостата (8) насосом, працюючого від двигуна (9) потужністю 80 Вт, гумовими шлангами. Температура в осередку підтримується постійною і рівною 250С і контролюється двома лабораторними термометрами (6) встановленими на термостаті і в осередку. Для підтримки постійної температури на термостат був встановлений контактний термометр (7), нагрівання виробляється двома тенами потужністю 200 і 400 Вт, відведення надлишку тепла виробляється водопровідною водою через вбудований в термостаті трубчастий теплообмінник. Перемішування здійснювалося барботажем газу або магнітною мішалкою (4). При проведенні досліджень рН-потенціометрично в інертній атмосфері в реакційний осередок (5) подається інертний газ з балона (10), який містить аргон ОЧ. При проведенні рН-потенціометричних досліджень в атмосфері повітря, повітря подається компресором (13), проходячи очищення через хлоркальцієву трубку з аскарид (12) і осушувач (14).
РЕЗУЛЬТАТИ ДОСЛІДІВ
Для дослідження процесу оборотного зв’язування молекулярного кисню комплексами кобальту із гліцилаланіном і дипептидами а також для одержання більш повної й достовірної інформації про процес оксигенації й комплексоутворення був проведений аналіз системи в інертній атмосфері й атмосфері повітря. Розглянений процес оксигенації однорідних систем кобальт – гліцилаланин – кисень і кобальт – дипіридил – кисень для більш детального дослідження процесу оксигенації в змішанолігандній системі кобальт – дипіридил – гліцилаланін – кисень. Під час дослідження була складена система рівнянь для змішанолігандної системи Со – Glyala – dipy – O2, проведене рН-потенціометричне дослідження суміші монодипіридилового комплексу кобальту(ІІ) та гліцилаланіну лугом в атмосфері повітря, дані дослідження наведені в таблиці 1, також виконаний розрахунок констант рівноваги процесу комплексоутворення та оксигенації.
Таблиця 1 – Дані рН-потенціометричного титрування лугом розчинів суміші монодипіридилового комплексу кобальту(ІІ) і гліцилаланіну Vвих.= 25 мл; [O2] = 2,5 · 10-4 моль/л; t = 250С; μ = 0,1 (KNO3);
СCo = 0,0021 моль/л; Сдип. = 0,00248 моль/л; СCo = 0,00208 моль/л; Сдип. = 0,00448 моль/л
|
VKOH, мл |
pH |
VКОН, мл |
pH |
|
0,07 |
7,20 |
0,14 |
7,20 |
|
0,10 |
7,3 |
0,20 |
7,35 |
|
0,13 |
7,42 |
0,27 |
7,45 |
|
0,16 |
7,50 |
0,35 |
7,54 |
|
0,20 |
7,55 |
0,41 |
7,60 |
|
0,23 |
7,60 |
0,49 |
7,67 |
|
0,27 |
7,65 |
0,55 |
7,74 |
|
0,33 |
7,75 |
0,62 |
7,80 |
|
0,41 |
7,84 |
0,69 |
7,86 |
|
0,47 |
7,91 |
0,76 |
7,93 |
|
0,53 |
7,97 |
0,84 |
8,00 |
|
0,60 |
8,06 |
0,91 |
8,08 |
|
0,67 |
8,16 |
0,97 |
8,15 |
|
0,74 |
8,28 |
||
|
0,81 |
8,41 |
Примітка: в таблиці наведені середні значення, довірений інтервал не більш ніж ±0,07
За допомогою програми Exel, розраховані концентрації комплексів, які утворюються при різних значеннях рН. При використанні даної методики була побудована крива рН-потенціометричного титрування суміші солі кобальту, гліцилаланіну в атмосфері повітря. Також побудовані криві розподілу для однорідних та змішанолігандних систем: Со – Glyala – О2, Со – dipy – О2, Со – dipy – Glyala, Co – Glyala – dipy – O2. Необхідне подальше вивчення властивостей отриманих у системі Co – Glyala – dipy – O2 оксигенованих біядерних комплексів кобальту, з метою визначення оптимальних умов їхнього утворення для подальшого застосування як синтетичних переносників кисню.
ВИСНОВКИ
Під час проведення роботи був розглянений процес утворення та оксигенації комплексів кобальту в однорідних системах, таких як кобальт(ІІ) – дипіридил, кобальт(ІІ) – гліцилаланін в атмосфері повітря, а також в змішанолігандній системі кобальт(ІІ) – дипіридил – гліциналанін. Для даних систем була розроблена математична модель процесу. Складена схема рівноваги та розрахунку констант рівноваги для змішанолігандної системи кобальт – дипіридил – гліцилаланін – кисень. Також складена математична модель процесу для данної системи. На основі розрахованих констант рівноваги для системи кобальт – гліцилаланін – кисень побудовані криві розподілу для кожного комплексу в залежності від рН, визначені оптимальні умови утворення оксигенових комплеків.
ЛІТЕРАТУРА
кобальта(II)// Коорд. химия. – 1997. – Т.23, – №10. – С.723 – 732.