






ВВЕДЕНИЕ
Целью работы является изучение реакций комплексообразования и обратимого присоединения молекулярного кислорода с образования однородных и смешанолигандных комплексов кобальта(ІІ). Объектом исследования являются оксигенированные комплексы кобальта с дипиридилом и глицилаланином. Предметом исследования является смешанолигандная система кобальт – дипиридил – глицилаланин – кислород. Необходимо отметить актуальность достижения данной цели с экологической точки зрения. Координационные соединения переходных металлов в низких степенях окисления способны обратимо связывать молекулу кислорода. Эти соединения являются моделями активных центров в сложных биологических соединениях (гемоглобине, миоглобине, гемеритрине, гемоцианине, хлорокруорине, гемованадине). Особенно близким к естественным переносчикам кислорода являются комплексные соединения кобальта, которые способны обратимо присоединять молекулу кислорода в водных средах, аналогично естественным активным центрам, и представляют собой модели естественных переносчиков кислорода.
Синтетические переносчики кислорода, такие как комплексные соединения кобальта, могут найти применение при создании новых лекарственных препаратов, применяться в кислородотерапии. Также, они имеют широкое применение в сфере промышленности. Они могут служить источниками чистого кислорода для разных технологических целей. Чистый кислород или воздух, который обогащен кислородом, используется при получении многих других металлов.
АКТУАЛЬНОСТЬ
Актуальность состоит в следующем. Во-первых способность комплексных соединений кобальта обратимо присоединять молекулу кислорода является важной с экологической точки зрения. Так как эти соединения являются моделями активных центров в сложных биологических соединениях (гемоглобине, миоглобине, гемеритрине, гемоцианине). Поэтому могут рассматриваться как природные переносчики кислорода. Уже разработаны такие препараты, такие как перфторан, перфукол на основе перфрорированых углеводородов, однако они не совершенны и обладают рядом недостатков, которые препятствуют их использованию в клинических условиях. В ряде стран ведется поиск комплексных полифункциональных заменителей под названием «искусственная кровь», которые имеют ингредиенты, обеспечивающие стабильное наполнение сосудов, перенос кислорода, питательных и биологически-активных веществ, сохранение водно-солевого обмена, удаление продуктов обмена. Поэтому, для решения этой проблемы необходим поиск более оптимальные синтетических переносчиков кислорода. Именно поэтому изучение свойств оксигенированных комплексных соединений кобальта с возможным использованием в качестве синтетических переносчиков кислорода является актуальным.
Во-вторых из известных в настоящее время комплексов, обратимо связывающих молекулярный кислород особый интерес представляют именно смешанолигандные кислородные комплексы, содержащие во внутринней координационной сфере в виде лиганда глицилаланин и дипиридил. Актуальным является также сам подход к исследованию процесса комплексообразования и оксигенации в системе кобальт – глицилаланин – дипиридил – кислород. Схема равновесий включает не только реакции образования смешаннолигандных комплексов, и процесса их оксигенации, но и процесса образования и оксигенации однородных комплексов с каждым из лигандов.
Научная значимость
Научная значимость работы состоит в изучении процессов комплексообразования и обратимого присоединения молекулярного кислорода в системе кобальт – дипиридил – глицилаланин. Данный процесс включает в себя реакции образования не только смешанолигандны соединений, но и однородных комплексов как с глицилаланином так и с дипиридилом. В результате проведенных исследований составлены схемы процессов комплексообразования и оксигенации однородных систем, а также смешанолигандной системы кобальт – дипиридил – глицилаланин. Составлена схема равновесия процесса а также математическая модель процесса комплексообразования и оксигенации в атмосфере воздуха.
Практическая ценность результатов работы
Полученные результаты проведенной работы расширяют существующие представления о процессах комплексообразования и обратимого присоединения молекулярного кислорода, в сложных системах, содержащих соль кобальта и два различных лиганда (глицилаланин и дипиридил). А также дополняют знания о составе образующихся в зависимости от рН раствора оксигенированных комплексов в смешанолигандных системах.
Полученные константы могут использоваться как самостоятельные справочные величины, а данные о наибольшей концентрации комплекса при каждом определенном рН могут быть использованы для получения необходимого комплекса – синтетического переносчика кислорода.
ОБЗОР ИССЛЕДОВАНИЙ
Согласно литературным данным координационные соединения переходных металлов в низких степенях окисления способны обратимо связывать молекулу кислорода. К этим соединениям также относятся комплексы кобальта(ІІ). Реакции оксигенации комплексов переходных металлов позволяют найти сходство с процессами превращения О2 в живых организмах. Поэтому комплексные соединения кобальта относят к синтетическим переносчикам кислорода. Окисление молекулярным кислородом, который транспортируют естественные переносчики кислорода, разных субстратов в живых организмах служит основным источником энергии в процессах жизнедеятельности.
Для решения проблемы поиска комплексных полефункциональных переносчиков кислорода ведутся поиски в таких направлениях:
Получение кровезаменителей на основе полностью фторируемых углеводных соединений (фтороуглеводы);
Исследование разных хелатних соединений;
Изучение возможности использования искусственного гемоглобина и искусственных эритроцитов, растворов химически модифицированного гемоглобина
В целом решение этой проблемы требует поиска оптимальных синтетических переносчиков молекулярного кислорода.
Авторы приводят данные исследований, согласно которым при использовании на догоспитальном этапе синтетических переносчиков кислорода наблюдается возобновление кислородной емкости крови с помощью оксигенированных комплексов кобальта α,α-дипиридилом и дипептидами при термических травмах.
Весьма незначительная информация о реакционной способности координированного молекулярного кислорода в комплексах переходных металлов. Вместе с тем имеющиеся данные позволяют считать, что координированный молекулярный кислород во многих соединениях находится в активном состоянии. Такие оксигенованные комплексы можно рассматривать как модели не только естественных носителей О2, но и металлоферментов, которые катализируют реакции окисления.
Интерес к активации координированного молекулярного кислорода вызван также возможностью образования короткоживущих интермедиатив в гомогенно-каталитических реакциях автоокисления. Особенное значение для выяснения механизмов реакций представляют исследования реакционной способности О2 в оксигенованном комплексе. Изучение реакций интермедиата позволяет представить сложный механизм гомогенно-каталитической реакции в виде отдельных стадий. Следовательно, соединения переходных металлов с О2 выполняют важную роль для моделирования биологических процессов, а также для выяснения механизма и поиска катализаторов окислительно-восстановительных процессов.
Однако, роль комплексов кобальта(II) с О2 не ограниченна только химическими, биологическими и медицинскими аспектами.
Они могут служить источниками чистого кислорода для разных технологических целей. Основные количества получаемого таким путем кислорода используются в металлургии. Кислородное (а не воздушное), дутье в домнах позволяет существенно повысить скорость доменного процесса, сэкономить кокс и получать чугун лучшего качества. Кислородное дутье применяют в кислородных конвертерах при переработке чугуна в сталь. Чистый кислород или воздух, который обогащен кислородом, используется при получении и многих других металлов (меди, никеля, свинца и др.).
Анализ литературных данных [3 – 5] показывает, что известные дикислородные комплексы кобальта можно разделить на две группы: моноядерные с соотношением Со:О2 = 1:1, и биядерные с соотношением Со:О2 = 2:1. Биядерные дикислородные комплексы делятся в свою очередь на: мономостиковые, в которых молекула кислорода выступает как мостиковая группа между двумя ионами кобальта(II), и бимостиковые, в которых кроме О2-містка есть еще один мостик, чаще это ОН-- реже NH2-группа. По прочности связи молекулы кислорода с центральным ионом кобальта дикислородные комплексы можно разделить на две группы: дикислородные комплексы, которые необратимо присоединяют молекулярный кислород и оксигенованные комплексы, которые обратимо присоединяют молекулярный кислород (переносчики молекулярного кислорода). Последние при слабом нагревании или при уменьшении парциального давления кислорода легко отдают присоединенный кислород.
Механизм образования дикислородных комплексов. В общем виде образования дикислородных комплексов кобальта может быть передан следующей схемой [6, 7], (заряды ионов опущены):
| CoL2 + O2 ↔ CoL2O2 | (1) | |
| CoL2O2 + CoL2 ↔ L2CoO2CoL2 | (2) |
Уравнение (1) отвечает образованию моноядерного дикислородного комплекса. Если при этом не созданные благоприятные условия, которые стабилизируют моноядерный дикислородный комплекс, то он превращается в биядерний комплекс (уравнение (2)) [6, 8]. К стабилизирующим факторам, которые предотвращают образование биядерних комплексов, относятся: применение донорных растворителей с низкой диэлектрической константой [9]; пространственные факторы, которые затрудняют димеризацию комплекса, низкая температура раствора, низкая концентрация комплекса [10]; применение в качестве как лигандов макромолекулы, которые снижают возможность образования О2-мостика между двумя центральными ионами кобальта (II) [11]. В водных растворах образования дикислородных комплексов практически всегда приводит к образованию биядерних комплексов.
Другая модель процесса образования бимосткових комплексов выходит из того, что координированная ионом металла молекула воды обладает значительными, по сравнению со свободной молекулой кислотными свойствами [5]. В связи с этим, независимо от наличия в системе молекулярного кислорода, комплексы – носители молекулярного кислорода, которые содержат во внутренней сфере две молекулы воды, будут находиться в водном растворе в сложном кислотно-основном равновесии. В серии работ [6 – 7], в которых исследовались комплексы кобальта(ІІ), содержащие во внутренней сфере два бидентатных лиганда и две молекулы воды общей формулой [CoL2(H2O)2]n+, рН-метрическим титрованием щелочью в инертной атмосфере установлено, что на моль начального комплекса расходуется 0,5 моль щелочи, что свидетельствует об образовании в растворе гидроксодимера по суммарной реакцией:
| 2[CoL2(H2O)2]n+ + OH- ↔ [L2Co(OH)2 – OH – Co(OH)L2](n-1) + 2H2 | (3) |
Присоединение молекулярного кислорода комплексами кобальта(II). В [2] приведенны результаты рН-метрического титрования щелочью в инертной атмосфере раствора соли кобальта(II) с десятикратным избытком глицилаланина. Результаты этих экспериментов показали, что скачек титрования наблюдается при добавлении одного моля щелочи на моль дипептида, что свидетельствует о том, что во внутренней координационной сфере бисдипептидного комплекса кобальта(II), который образуется в инертной атмосфере, содержатся депротонованные однозарядные анионы дипептида (DpH-).
В [5] авторы предлагают две оборотные реакции присоединения молекулярного кислорода комплексами кобальта с глицилаланином (реакции 4 – 5).
Таким образом, согласно [6] два бисдипептидных комплекса кобальта(II) владеют способностью присоединять молекулярный кислород. Первый из них (уравнение 4) это смешанолигандный комплекс кобальта(II), который содержит во внутренней координированной сфере в качестве лигандов один однозарядный анион глицилаланина с протонированным пептидным атомом азота (GlyalaH-) и один двухзарядный анион дипептида, в котором пептидный атом азота депротонован (Glyala2-). При присоединении молекулярного кислорода образуется биядерный мономистковый (μ-О2) оксигенованный комплекс кобальта(II), который содержит во внутренней координационной сфере только двухзарядные анионы глицилаланина (Glyala2-), (Co(Glyala)2)2O24-. Другой комплекс, который присоединяет молекулярный кислород, – это бисдипептидный комплекс кобальта, который содержит во внутренней координационной сфере два двухзарядных аниона глицилаланина Co(Glyala)22-. При его оксигенации (уравнение (5) образуется тот же биядерный мономистковый оксигенованный комплекс (Co(Glyala)2)2O24-, что и по реакции (4).
Количественно процесс присоединения молекулярного кислорода авторы [4] характеризуют тремя константами: КO22, K0O2, КA2, которые являются константами равновесия реакций (4) и (5), равновесия (6):

Анимация. Количество кадров 20. Количество повторений 10.
В [6] исследованн ряд комплексов кобальта(II) с дипептидами, способными занимать четыре координационных места металла. В этом случае, как и следовало ожидать, процесс оксигенации приводит к образованию биядерного (μ-О2, μ-КОН) бимостикового оксигенованного комплекса состава [GlyalaCo(O2OH)(Glyala)2]. В [4, 6] подтверждено образование биядерных бимостиковых (μ-О2, μ-КОН) оксигенованных комплексов кобальта(II) с глицилаланином. Таким образом, анализ литературных данных показыл, что при взаимодействии смеси соли кобальта(II) и дипептида (Co:DpH2 = 1:2) в присутствии кислорода может образоваться оксигенованный биядерный мономостиковый комплекс состава [(Co(Dp)2)2O2]4-.
В целом, приведенный выше короткий анализ литературных данных показал. Известные оксигенованные комплексы кобальта(II) делятся на одноядерные (Со:О2 = 1:1) и биядерные (Со:О2 = 2:1). Последние в свою очередь разделяются на мономостиковые (μ-О2) и бимостиковые (μ-О2, μ-КОН) комплексы. В системах кобальта(II) – дипептид – кислород (Со:DpH2=1:2) образуется биядерный мономостиковый (μ-О2) оксигенованный комплекс [(CoDp2)2O2]4-. В смешанолигандных системах с двумя бидентатными лигандами (диамин и анион аминокислоты) при оксигенации образуются биядерные бимостиковые оксигенированные комплексы.
рН-ПОТЕНЦИОМЕТРИЧЕСКОЕ ИССЛЕДОВАНИЕ
рН-потенциометрически, методом молярных отношений устанавливался состав комплексов, которые образуются в растворе, в атмосфере воздуха. Титровали водные растворы чистых лигандив с концентрацией 5·10-3 при ионной силе 0,1 (KNO3), t=250С, смеси соли кобальта(II) и дипептидов (молярные отношения 1:2) в атмосфере воздуха (μ = 0,1(KNO3). Аналогичным образом исследовались смеси соли кобальта(II), дипептида и глицилаланина (молярные отношения 1:1:1) в инертной атмосфере и в атмосфере воздуха (образование смешанолигандных комплексов). В целом проводилось 5 серий опытов по каждой из данных систем, отдельные экспериментальные значения отклонялись от среднего значения не более чем на 0,04 – 0,07 ед. рН, в последующих расчетах использовались усредненные значения. Схема установки для проведения рН-потенциометричних исследований представлена ниже.
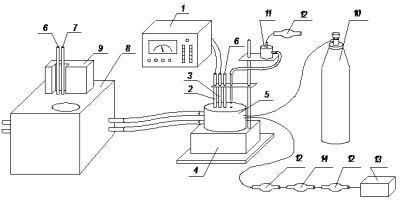
Как регистрирующий прибор использовался миливольтметр типа рН–121. Наладка рН-метра проводилась с использованием стандартных буферных растворов со значением рН 1,68, 4,01, 6,86, 9,18. Основная погрешность измерения миливольтметра типа рН-121 составляет ±0,05. Как электрод сравнения использовался хлоридсеребряный электрод типа ЕВЛ-1МЗ. Индикаторным электродом служил стеклянный электрод типа ЕСЛ-43-07. Реакционная ячейка (5) с раствором термостатируется водой, которая поступает из термостата (8) с помощью насоса, работающего от двигателя (9) мощностью 80 Вт, по резиновым шлангам. Температура в ячейке поддерживается постоянной и равна 250С и контролируется двумя лабораторными термометрами (6) установленными на термостате и в ячейке. Для поддержки постоянной температуры на термостат был установлен контактный термометр (7), нагревание производится двумя тенами мощностью 200 и 400 Вт, отведение избытка тепла производится водопроводной водой через встроенный в термостат трубчатый теплообменник. Перемешивание осуществлялось барботажем газа или магнитной мешалкой (4). При проведении исследований рН-потенциометрически в инертной атмосфере в реакционную ячейку (5) подается инертный газ из баллона (10), который содержит аргон ОЧ. При проведении рН-потенциометрических исследований в атмосфере воздуха, воздух подается компрессором (13), проходя очистку через хлоркальциеву трубку с аскарид (12) и осушитель (14).
РЕЗУЛЬТАТЫ ОПЫТОВ
Для исследования процесса обратимого присоединения молекулярного кислорода комплексами кобальта с глицилаланином и дипептидами а также для получения более полной и достоверной информации о процессе оксигенации и комплексообразования был проведен анализ системы в инертной атмосфере и атмосфере воздуха. Рассмотрен процесс оксигенации однородных систем кобальт – глицилаланин – кислород и кобальт – дипиридил – кислород для более детального исследования процесса оксигенации в смешанолигандной системе кобальт – дипиридил – глицилаланин – кислород. Во время исследования была составлена система уравнений для смешанолигандной системы Со – Glyala – dipy – O2, проведено рН-потенциометрическое исследование смеси монодипиридилового комплекса кобальта(ІІ) и глицилаланина щелочью в атмосфере воздуха, данные исследования приведены в таблице 1, также выполнен расчет констант равновесия процесса комплексообразования и оксигенации.
Таблица 1 – Данные рН-потенциометрического титрования щелочью смеси растворов монодипиридилового комплекса кобальта(ІІ) и глицилаланина Vисх.= 25 мл; [O2] = 2,5 · 10-4 моль/л; t = 250С;
μ = 0,1 (KNO3);СCo = 0,0021 моль/л; Сдип. = 0,00248 моль/л; СCo = 0,00208 моль/л; Сдип. = 0,00448 моль/л
|
VKOH, мл |
pH |
VКОН, мл |
pH |
|
0,07 |
7,20 |
0,14 |
7,20 |
|
0,10 |
7,3 |
0,20 |
7,35 |
|
0,13 |
7,42 |
0,27 |
7,45 |
|
0,16 |
7,50 |
0,35 |
7,54 |
|
0,20 |
7,55 |
0,41 |
7,60 |
|
0,23 |
7,60 |
0,49 |
7,67 |
|
0,27 |
7,65 |
0,55 |
7,74 |
|
0,33 |
7,75 |
0,62 |
7,80 |
|
0,41 |
7,84 |
0,69 |
7,86 |
|
0,47 |
7,91 |
0,76 |
7,93 |
|
0,53 |
7,97 |
0,84 |
8,00 |
|
0,60 |
8,06 |
0,91 |
8,08 |
|
0,67 |
8,16 |
0,97 |
8,15 |
|
0,74 |
8,28 |
||
|
0,81 |
8,41 |
Примечание: в таблице приведены средние значения, доверительный интервал не более чем ±0,07
С помощью программы Exel, рассчитанны концентрации комплексов, которые образуются при различных значениях рН. При использовании данной методики была построена кривая рН-потенциометрического титрования смеси соли кобальта, глицилаланина в атмосфере воздуха. Также построенны кривые распределения для однородных и смешанолигандных систем: Со – Glyala – О2, Со – dipy – О2, Со – dipy – Glyala, Co – Glyala – dipy – O2. Необходимо последующее изучение свойств полученных в системе Co – Glyala – dipy – O2 оксигенованных биядерных комплексов кобальта, с целью определения оптимальных условий их образования для последующего применения в качестве синтетических переносчиков кислорода.
ВЫВОДЫ
Во время проведения работы был рассмотрен процесс образования и оксигенации комплексов кобальта в однородных системах, таких как кобальт(ІІ) – дипиридил, кобальт(ІІ) – глицилаланин в атмосфере воздуха, а также в смешанолигандной системе кобальт(ІІ) – дипиридил – глициналанин. Для данных систем была разработана математическая модель процесса. Составленна схема равновесия и выполнен расчет констант равновесия для смешанолигандной системы кобальт – дипиридил – глицилаланин – кислород. Также составлена математическая модель процесса для данной системы. На основе расчитаных констант равновесия для системы кобальт – глицилаланин – кислород построенны кривые распределения для каждого комплекса в зависимости от рН, определены оптимальные условия образования оксигенированных комплексов.
ЛИТЕРАТУРА
кобальта(II)// Коорд. химия. – 1997. – Т.23, – №10. – С.723 – 732.