Реферат за темою випускної роботи
Зміст
- Вступ
- 1 Огляд існуючих методів знефенолення
- 1.1 Паровий метод
- 1.2 Екстракційні методи очищення
- 1.3 Біохімічні методи очищення
- 2 Синтез сульфохлоридів анілідів сульфокислот з екранованими сульфоніламідними замісниками
- 2.1 Синтез N–бензенсульфоніл–2,4,6–триметиланіліну
- 2.2 Алкілювання N–бензенсульфоніл–2,4,6–триметиланіліну
- 2.3 Сульфохлорування N–метил–N–бензенсульфоніл–2,4,6–триметиланіліну
- 2.4 Очищення сульфохлоридів анілідів сульфокислот
- 2.5 Визначення структури синтезованих сполук
- 3 Вивчення кінетичних особливостей нейтрального гідролізу 3–N(XАrSO2)–NMe]–2,4,6–Me3–C6H2SO2Cl
- 4 Вплив структурних факторів замісників на характер перебігу нейтрального гідролізу в 70% в.д.
- 5 Розробка технологічної схеми хімічного знефенолення стічних вод
- Висновки
- Перелік посилань
Вступ
Актуальність
Робота присвячена хімічному вилученню фенолів із стічних вод промислових підприємств за допомогою похідних аренсульфокислот. Метод є економічнішим порівняно з більшістю існуючих. Хімічне знефенолення із використанням запропонованих субстратів не залежить від концентрації фенолів в стоках, може застосовуватися практично на всіх підприємствах без обмежень, властивих іншим методам. Крім того, вилучені феноли та їх похідні є цінними речовинами для різних галузей народного господарства [1,2].
Мета, задачі дослідження, плановані результати, наукова новизна
Мета: обґрунтування природи позитивного стеричного ефекту в умовах нуклеофільного заміщення у сульфонільного центра в стерично утруднених сульфохлоридах анілідів сульфокислот та розробка технологічної схеми хімічного знефенолення стічних вод.
Основні задачі дослідження:
- Дослідження кінетичних закономірностей гідролізу 3–[N(ХArSO2)–NMe]–2,4,6–Me3–С6НSO2Cl в середовищі 70% водного діоксану (в. д.) в інтервалі температур 303–323 К.
- Розрахунок термодинамічних параметрів перехідного стану для заміщення у просторово утрудненого сульфонільного центра.
- Обґрунтування механізму реакції нуклеофільного заміщення в умовах гідролізу.
- Обґрунтування та розробка технологічної схеми хімічного знефенолення стічних вод на основі досліджуваних субстратів.
Об’єкт дослідження : стерично ускладнені сульфохлориди анілідів сульфокислот
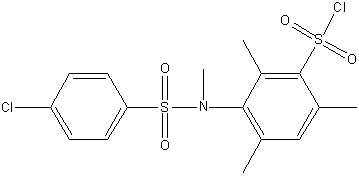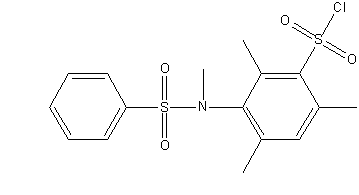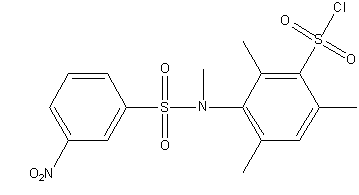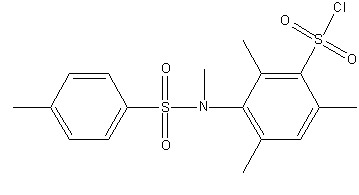
Рисунок 1 – Досліджувані сульфохлориди анілідів сульфокислот
(gif–анімація, 4 кадри, 5 повторів 5.45 кБ)
Плановані наукові результати: Обґрунтування і розробка технології процесу хімічного знефенолення стічних вод.
Наукова новизна:
- Синтез сполук ряду ряду 3–[N(ХArSO2)–NMe]–2,4,6–Me3–С6НSO2Cl, раніше не описаних у літературі.
- Дослідження реакційності синтезованих субстратів в умовах нейтрального гідролізу.
- Виявлення ізопараметричної області за температурою, в якій швидкості всіх субстратів є співставними, що розширює можливості знефенолення.
- Розробка та деталізація технологічної схеми хімічного очищення стічних вод.
1. Огляд існуючих методів знефенолення
1.1 Паровий метод
Паровий метод знефенолення стічних вод у поєднанні з мокрим гасінням коксу і замкнутим циклом фенольних вод, або з біологічним доочищенням набув на вітчизняних коксохімічних заводах досить широкого застосування. Установка знефенолення призначена для видалення основної частини фенолів з надсмольної і сепараторнoї вод смолоперегінного цеху після обробки в аміачній колоні з отриманням фенолятів встановленої якості за технічними умовами. Ступінь знефенолення стічних вод повинна бути не менше 85 %, а залишковий вміст фенолів в обробленій воді — не більше 0,2 г/л. Сутність цього методу полягає в тому, що із стічних вод, нагрітих до 100–102 °С, феноли видуваються великою кількістю гострої водяної пари, а потім суміш пари і фенолів пропускають через насичений при 102–103 °С розчин лугу для утворення фенолятів [3].
Переваги: компактність установки, простота оформлення, можливість автоматизації.
Недоліки методу: великі енерговитрати, неможливість повного видалення фенолів.
1.2 Екстракційні методи очищення
Екстракційні методи придатні для вилучення фенолів з концентрованих вод, що містять більше 2 г/л фенолів. Суть методів полягає в додаванні до фенольних стоків розчинника, що не змішується з водою та в якому феноли розчиняються легше, ніж у воді. Це призводить до утворення двошарової суміші, яка легко декантується. Один шар складається із знефеноленої води, інший являє собою суміш розчинника з поглиненими фенолами, звідки вони вилучаються відгонкою розчинника або у вигляді фенолятів. В обох випадках звільнений від фенолів розчинник знову повертається у цикл. Процес екстрагування стічних вод складається з трьох стадій: приведення суміші, що підлягає екстрагуванню, в тісний контакт з розчинником; розподіл утворених фаз; видалення і регенерація розчинника [3,4].
Переваги методу: висока ступінь знефенолення стічних вод, більш повне вилучення фенолів і практично повне — масел і смол порівняно з пароциркуляційним методом.
Недоліки: висока собівартість розчинників і необхідність їх регенерації, складність технологічної схеми.
1.3 Біохімічні методи очищення
Біохімічні методи засновані на здатності мікроорганізмів до окиснення органічних сполук. Кінцевими продуктами біохімічного розкладання домішок, які містяться у стічних водах, є діоксид вуглецю (СО2) і вода. Ці методи забезпечують глибоке очищення стічних вод в результаті розкладання фенолів. Використовують мікроорганізми двох видів: активний мул (біологічну плівку) і культури спеціальних бактерій, призначених для руйнування компонентів стічних вод. Активний мул являє собою скупчення бактерій — зооглей і найпростіших організмів — нитчастих, жгутикових, корененіжок, інфузорій, коловpaтoк та ін. На установках c активним мулом найкращі результати знефенолення отримують після попереднього розведення фенольних стічних вод технічною водою або промислово–побутовими водами [3,5].
Переваги методу: глибока ступінь очищення стічних вод.
Недоліки: висока вартість експлуатації, громіздкість устаткування, придатність тільки для достатньо розведених стічних вод.
2 Синтез сульфохлоридів анілідів сульфокислот з екранованими сульфоніламідними замісниками
При виконанні синтезу за методикою [6] виникли певні складнощі. Одержання подібних структур ускладнюється тим, що під дією сульфатної, хлорсульфонової і соляної кислот, що знаходяться в реакційній суміші, вихідні субстрати ізомеризуються, розкладаються на декілька груп похідних: солі, похідні бензенсульфохлориду, сульфовані вторинні аміни та ін. Ймовірно, цим пояснюється практично повна відсутність в літературі інформації щодо названих сполук. Всього синтезовано 12 неописаних в літературі речовин.
2.1 Синтез N–бензенсульфоніл–2,4,6–триметиланіліну
Синтез здійснювали за реакциєю:
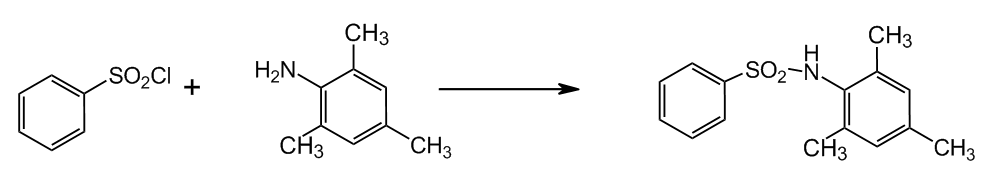
Рисунок 2 — Синтез N–бензенсульфоніл–2,4,6–триметиланіліну
Реактиви:
- бензенсульфохлорид — 4,41 г (0,025 моль).
- 2,4,6–диметиланілін — 4,05 г 0,030 моль).
- натрій карбонат — 2,12 г.
Сульфохлорид і анілін змішували в конічній колбі на 200 мл, додавали води до 50 мл і малими порціями — соду при нагріванні і перемішуванні. Закінчення реакції реєстрували візуально по затвердженню маслоподібної суміші — розчину сульфохлориду в аніліні і зникненню запаху аніліну. Після закінчення реакції розчин підкислювали HCl до випадіння осаду.
Отриманий N–бензенсульфоніл–2,4,6–триметиланілін фільтрували, промивали дистильованою водою, переосаджали з лугу для звільнення від домішки сульфохлориду і знову фільтрували. Залишок на фільтрі сушили на повітрі.
Вихід продукту 5,2 г (0,020 моль) — 80 %.
2.2 Алкілювання N–бензенсульфоніл–2,4,6–триметиланіліну
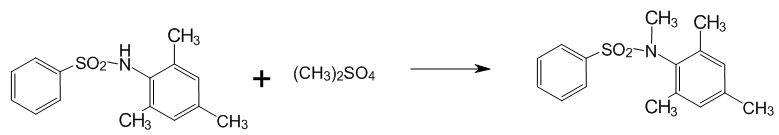
Рисунок 3 — Алкілювання N–бензенсульфоніл–2,4,6–триметиланіліну
Реактиви:
- N–бензенсульфоніл–2,4,6–триметиланілін — 7,225 г (0,025 моль).
- Луг NaOH — 2,1 г (0,025 моль).
- Вода — 50 мл.
- Диметилсульфат — 5,04 г (0,04 моль) 3,8 мл.
На масляній бані збирали установку із тригорлої колби, мішалки і крапельної воронки. У колбу наливали воду, додавали 1 г лугу і сульфамід. Нагрівали реакційну суміш до 60 °С при помішуванні до повної гомогенізації. Через крапельну воронку додавали диметилсульфат (ДМС). Протікання реакції відзначали за виділенням нерозчинного осаду. По ходу реакції контролювали pН, при наявності кислої реакції — додавали луг. По закінченні прикапування ДМС осад фільтрували, фільтрат підкислювали соляною кислотою і залишали відстоюватися. Залишок на фільтрі розчиняли в 15 мл ацетону і виливали в 50 мл 1% лугу. Для вилучення вихідної речовини осад фільтрували і фільтрат підкислювали.
Вихід 3,53 г (0,016 моль) — 63 %, залишок вихідної речовини 1,3 г.
2.3 Сульфохлорування N–метил–N–бензенсульфоніл–2,4,6–триметиланіліну
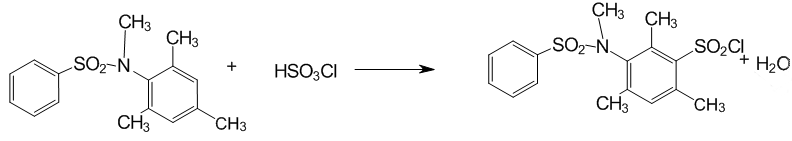
Рисунок 4 — Сульфохлорування N–бензенсульфоніл–2,4,6–триметиланіліну
Реактиви:
- N–метил–N–бензенсульфоніл–2,4,6–триметиланілін — 1,935 г (0,005 моль).
- Хлорсульфонова кислота — 10 мл.
- Хлористий метилен — 30 мл.
- Октан — 15 мл.
- Ізопропанол — 10 мл.
До охолодженої (0 °С) хлорсульфонової кислоти додавали N–метил–N–бензенсульфоніл–2,4,6–триметиланілін, розчиняли при помішуванні і залишали на дві доби за температури близько 0 °С у щільно закупореній колбі, вільній від попадання вологи.
Через дві доби в колбу додавали 20 мл хлористого метилену для екстракції сульфохлориду і виливали по краплях реакційну масу на лід. Коли лід танув, двофазну емульсію розділяли на ділильній воронці, нижній шар збирали і ще двічі промивали дистильованою водою від залишків кислоти. Після цього органічну фазу зливали в конічну колбу і сушили хлористим кальцієм. Далі органічний шар фільтрували для видалення хлористого кальцію і випарювали розчинник при слабкому нагріванні у вакуумі водострумінного насосу. Продукт розтирали з ізопропанолом, фільтрували і двічі промивали 5 мл ізопропанолу.
Осад на фільтрі поміщали в склянку на 100 мл і розчиняли в хлористому метилені. Зверху акуратно доливали 15 мл октану, намагаючись не змішати розчинники. Хлористий метилен надзвичайно леткий (температура кипіння — 42 °С), а сульфохлориди анілідів сульфокислот є практично нерозчинними у насичених вуглеводнях, тому на межі розділу фаз з'являються кристали сульфохлоридів. Цим досягається висока чистота синтезованої сполуки.
Вихід 1,18 г (0,00316 моль) — 63 %.
2.4 Очистка сульфохлоридов анилидов сульфокислот
Отримані субстрати 3–[N(XАrSO2)–NMe]–2,4,6–Me3–C6H2SO2Cl виявилися досить чистими для кінетичних вимірювань, але їх додатково перекристалізовували з діоксану. Для цього наважки масою близько 0,5 г розчиняли при нагріванні в 1 мл гарячого діоксану і фільтрували. Після охолодження фільтрату осаджений продукт промивали 5 мл ізопропанолу і сушили. Вихід становив близько 50–70 %.
2.5 Визначення структури синтезованих сполук
Структура сульфохлоридів анілідів сульфокислот підтверджена декількома способами:
- Методом кислотно-лужного титрування визначали молярну масу сульфохлоридів;
- Елементним аналізом за методикою [7] перевіряли на наявність активного хлору;
- ПМР-спектроскопією підтверджували структуру синтезованих субстратів.
3 Вивчення кінетичних особливостей нейтрального гідролізу 3–[N(XАrSO2)–NMe]–2,4,6–Me3–C6H2SO2Cl
Досліджено кінетику нейтрального гідролізу сполук загальної формули 3–[N(XАrSO2)–NMe]–2,4,6–Me3–C6H2SO2Cl, где Х=4–CH3, H, 4–Cl, 3–NO2 в 70% (об’єм.) водному діоксані в інтервалі температур 303–323 К. Ефективні константи швидкості і розраховані параметри активації перехідного стану, а саме: ентальпія активації перехідного стану, ентропія активації і енергія Гіббса представлені в табл. 1.
Реакція нейтрального гідролізу досліджуваних субстратів відповідає рівнянню:
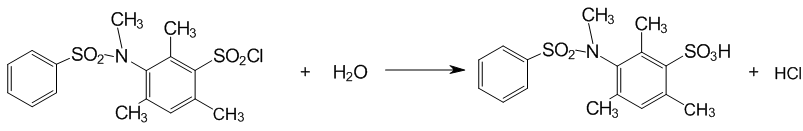
Рисунок 5 — Гидроліз сульфохлоридів анілідів сульфокислот
Таблиця 1 — Ефективні константи швидкості kеф×104(с-1) та активаційні параметри для гідролізу
3–[N(XАrSO2)–NMe]–2,4,6–Me3–C6H2SO2Cl в 70% в.д.
| X | kэфф×104(с-1) | ΔH≠, кДж/моль |
ΔH≠, Дж/моль×К |
ΔG313≠, кДж/моль |
||
| 303 | 323 | 333 | ||||
| H | 2.5 | 4.68 | 9.59 | 52.0±2.5 | 172±10 | 106±6 |
| 4–Me | 2.53 | 5.49 | 10.9 | 56.9±3.0 | 155±8 | 105±5 |
| 4 Cl | 2.4 | 5.02 | 11.2 | 60.0±1.5 | 139±10 | 104±5 |
| 3 NO2 | 2.24 | 5.04 | 11.3 | 63.0±3.8 | 129±11 | 103±7 |
Для серії субстратів спостерігається тенденція збільшення швидкості реакції із зростанням електроноакцепторного характеру замісника Х, тобто процесу заміщення сприяє низька електронна густина на центрі нуклеофільної атаки — атомі Сульфуру сульфогрупи (табл.1). Замісники Х віддалені від реакційного центру, та їх електронні і стеричні властивості лише незначною мірою відображаються на швидкості процесу. При цьому при зростанні температури від 303 до 323 К різниця в реакційності стає все більш очевидною (табл. 1). Наприклад, для незаміщеного похідного співвідношення k313/k303 и k323/k313 становить відповідно 1,872 и 2,231. У цілому, характер впливу замісника Х відповідає загальним закономірностям механізму бімолекулярного нуклеофільного заміщення SN2–типу, який постулювався раніше рядом авторів [8,9,10,11] для заміщення у тетракоординованого атома Сульфуру в похідних аренсульфокислот. Також можна відзначити зближення значень ефективних констант швидкості для всіх субстратів при температурі 303 К. При цьому характер впливу замісника Х змінюється в досліджуваному інтервалі температур. Варіювання замісника істотно не впливає на параметр ентальпії активації перехідного стану ΔH≠, однак значною мірою відображається на величині ентропійного фактора ΔS≠. При цьому збільшення реакційної здатності субстратів не пов'язане з виграшем в ентальпії активації, навпаки — спостерігається її незначне зростання. Абсолютне значення ентропії активації |ΔS≠| знижується при збільшенні електроноакцепторного характеру Х.
Привертає увагу факт незмінності величин енергії Гіббса ΔG313≠ перехідного стану для всіх субстратів на рівні 106 кДж/моль.
4. Вплив структурних факторів замісників на характер перебігу нейтрального гідролізу в 70% в.д.
Нами було зроблено спробу оцінити взаємозв'язок структура субстрату — реакційність за рівнянням Гаммета [12]:
де ρх — коефіцієнт чутливості реакції до електронних ефектів замісників Х в аренсульфамідному фрагменті молекули.
σ — постійні, що характеризують електронні ефекти замісників Х.
Розраховані параметри даного рівняння довели фактичну відсутність кореляції для серії з оцінними значеннями ρх, які наведено в табл. 2.
Таблиця 2 — Параметри корреляції рівняння Гаммета для гідролизу в 70% в.д.
3–[N(ХArSO2)–NMe]–2,4,6-Me3–С6НSO2Cl.
| T, К | 3–[N(ХArSO2)–NMe]–2,4,6-Me3–С6НSO2Cl | ArSO2Cl [13] |
| ρx | ρв | |
| 303 | -0.062 | -0.90 |
| 313 | -0.017 | -0.95 |
| 323 | 0.044 | -0.98 |
Примітка; Статистичні параметри R=0,7÷0,9, S=10-5÷10-2, Δρ=0.04÷0.05
Одночасно, статистичні параметри і похибки у визначенні величини ρх свідчать про можливість використання параметрів рівняння (1) для попереднього аналізу. Швидкість реакції гідролізу сульфохлоридів анілідів сульфокислот порівняна із сполуками модельного ряду — похідними бензенсульфохлориду, а селективність їх до замісника Х значно нижча, ніж у модельних субстратів XArSO2Cl (табл.2) [13].
Ймовірно, це обумовлено ізоляцією містковою групою –SO2–N–Me– реакційного центру — атома Сульфуру сульфогрупи від впливу Х в N–аренсульфонільному фрагменті і особливостями просторової структури перехідного і вихідного станів.
На Арреніусовському графіку для сполук із замісниками X=4–CH3, H, 4–Cl (рис. 6.) простежується чітка тенденція до зближення
температурних залежностей в області, яку умовно можна назвати зоною ізопараметричності
. Дані розрахунку ізокінетичної Тізо
за модифікованим методом Екснера вказують на те, що робоча область температур знаходиться вище ізокінетичної області.
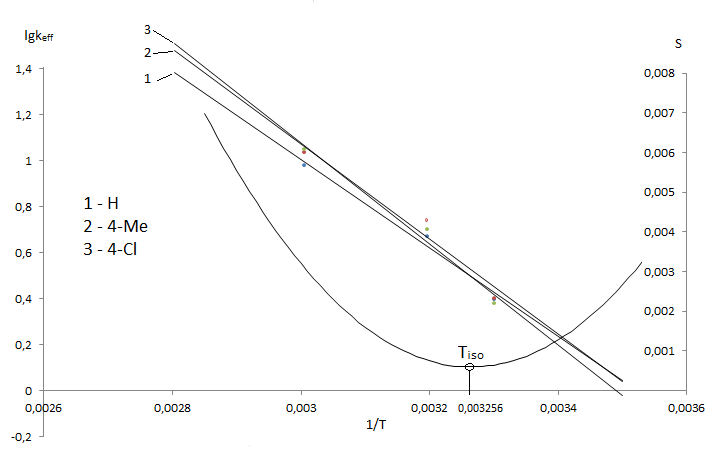
Рисунок 6 — Аррениусовський граффк для гідролизу в 70 % водном діоксані 3–[N(ХArSO2)–NMe]–2,4,6–Me3–С6НSO2Cl
Теоретично розрахована ізокінетична температура склала 306 К.
Таким чином, для гідролізу сульфохлоридів анілідів сульфокислот спостерігається досить рідке явище — ізопараметрична температура знаходиться в реально досяжній області. Цим, можливо, і пояснюється неоднозначність кінетичних даних і значень параметрів активації ПС. Очевидно, що інтерпретація кінетичних закономірностей процесу повинна спиратися на оцінку положення досліджуваного температурного інтервалу щодо Тізо.
Для гідролізу при T<Tізо реалізується ентальпійний контроль, при T>Tізо — ентропійний. Звичайно, пояснення структурних
особливостей ПС має бути різним за температур вищих та нижчих Tізо. За більш низьких температур превалюють електронні взаємодії в ПС, більш
високих — кінетичні закономірності визначаються здебільшого стеричними ефектами в перехідному стані. Величина ΔS≠ являє собою міру
зміни ступенів свободи внутрішнього руху при переході від початкового стану до ПС. При втраті ступенів свободи величина ΔS≠стає більш
негативною і ПС має більш складну конфігурацію. Можливо, накопичення метильних груп в сульфохлоридній частини молекули сприяє незначному полегшенню
стеричних взаємодій при нуклеофільної атаці і утворенню менш щільної «упаковки» перехідного стану, пов'язаної з відхиленням від
тригонально–біпірамідальної структури [14,15], що відбивається на зниженні величин вільної енергії активації ΔG≠ для сполук №
5. Розробка технологічної схеми хімічного знефенолення стічних вод
Запропоновану технологічну схему відділення знефенолення для коксохімічних підприємств наведено на рис. 3.
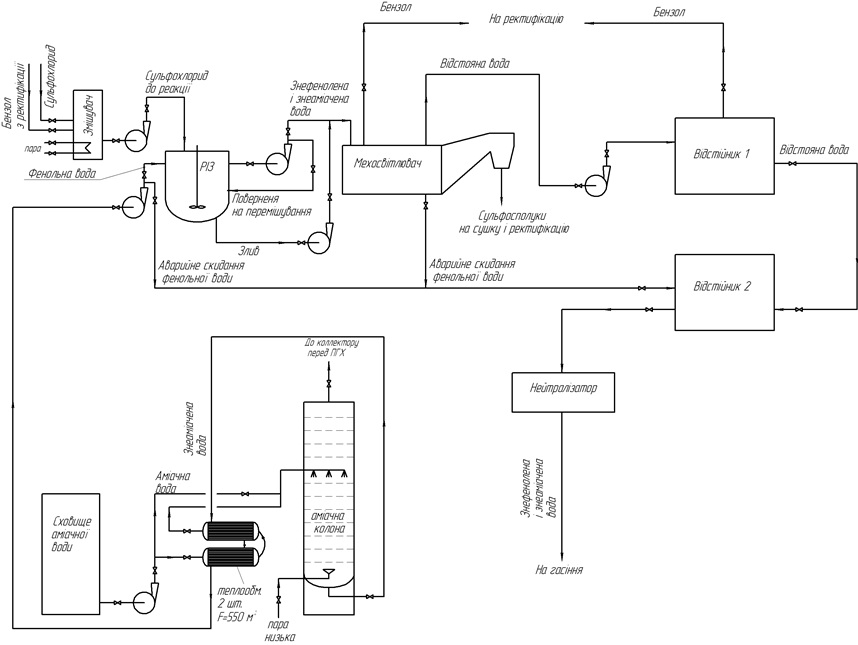
Рисунок 7 — Технологічна схема ділянки знефенолення
Перед знефеноленням планується проводити попередню віддувку летючого аміаку, який міститься в надсмольній воді і конденсаті первинних газових холодильників коксохімічних виробництв, в аміачній колоні для зменшення надлишкових кількостей концентрацій солей амонію.
Для інтенсифікації процесу запропоновано попереднє розчинення сульфохлоридів в бензені, який є одним з продуктів коксохімічних виробництв, і нагрівання суміші до оптимальної ізокінетическої температури (30 °С). Бажано також проведення реакції в умовах, наближених до ідеального змішування, тобто в ємкістному апараті з механічним і гідравлічним перемішуваннями.
Реакція протікатиме в ультрамікрогетерогенному середовищі в реакторі ідеального змішування (РІЗ) (рис. 4) [14,15]. В апараті запропоновано механічне перемішування з використанням пропелерних мішалок та гідравлічне перемішування — шляхом багаторазової прокачки рідини через систему апарат — циркуляційний насос — апарат.
Частина води, що видаляється з апарату через злив і циркуляційний насос повертається в реактор, а інша — відводиться далі за схемою. Оскільки продукти реакції нерозчинні у воді і розчинні в бензені запропоновано після реактора відводити їх далі на мехосвітлювачі для очищення від сульфоестерів, що випадають в осад.
Мехосвітлювачі (мал. 8) широко використовуються на коксохімічних виробництвах для освітлення надсмольної води і видалення смоли. Поділ на фракції в цих апаратах здійснюється за допомогою гравітаційних сил. Суміш подається у корито 2. Осад сульфоестерів видаляється за допомогою скребкових транспортерів 7 через розвантажувальні резервуари 6. Очищена від сульфоестерів вода виводиться через штуцер 4. Завдяки тому, що в'язкість бензену значно менше за в'язкість смоли, яка потребує очищення, не виникає необхідності обігріву глухою парою або надсмольною водою через штуцер 8.
Після мехосвітлювача очищена суміш подається в два послідовно з'єднаних відстійника на додаткове відстоювання. Відстійники також необхідні як запобіжні ємності, в які можуть подаватися стічні води у разі виникнення аварійної ситуації, або за необхідності розвантаження апарату.
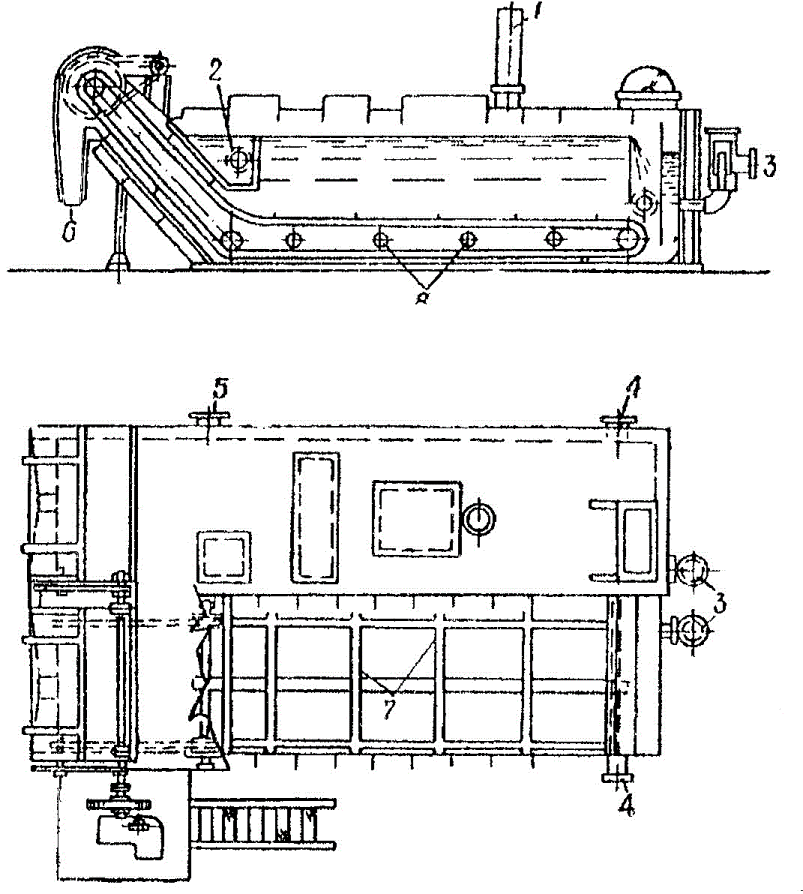
Рисунок 8 — Механічний освітлювач
1 – воздушник; 2 – корито для суміши; 3 – вивід сульфоестерів; 4 – вивід очищеної води; 5 – вивід суміші; 6 – вивід сульфоестерів; 7 – скребковий транспортер; 8 – підвод пари
Відстояна вода може бути відправлена на нейтралізацію для видалення розчинених в ній соляної та сульфокислот, а далі — для очищення на позамайданчикових спорудах, або на мокре тушіння коксу. Суміш сульфоестерів та сульфамідів в бензені після відстоювання йде далі на ректифікацію, в результаті якої бензен повертається в цикл знефенолення, а продукти піддаються подальшому розділенню [16].
Висновки
- Синтезовано 12 нових, що раніше не описаних в літературі сполук.
- Досліджено кінетику нейтрального гідролізу в 70% в.д. в інтервалі температур 303–333 К.
- Розраховано термодинамічні параметри перехідного стану для заміщення у сульфонільного центру. Виявлена ??зона ізопараметричності по температурі для сольволіза досліджуваних субстратів.
- Обгрунтовано загальний механізм заміщення SN2 для досліджуваної та модельної серій субстратів.
- Запропоновано перехідний стан некласичної структури в умовах нуклеофільного заміщення у сульфонільного центру в сульфохлоридів анілідів сульфокислот.
- Наведено та обгрунтовано технологічна схема хімічного знефенолювання стічних вод на основі досліджуваних субстратів.
Перелік посилань
- Волянская Н.П., Гриценко И.С. Противомикробная активность и фармакологические эффекты фенольньых соединений // Annals of Mechnicov’s Institute, N2, 2005, pp. 3 - 7.
- Харламович Г. Д., Чуркин Ю. В. Фенолы // М.,
Химия
, 1974, 376 с. - Лейбович Р.Е. Технология коксохимического производства: Учебник для техникумов / Лейбович Р.Е., Яковлева Е.И., Филатов А.Б.; Под. ред. Рядинова Н.А. - М.: Металлургия, 1982. – 360 с.
- Boyadzhiev L., Alexandrova S. Dephenolation of Phenol-Containing Waters by Rotating Film Pertraction // Separation Science and Technology, 27(l0), pp 1307-1317.
- Kamenev I., Munter R., Pikkov L. Wastewater treatment in oil shale chemical industry // Oil Shale, 2003, Vol. 20, No. 4, pp. 443-457.
- Giece B., Heuck K. Das reaktivitats-selectivitatprinzip. Anwendung des reaktivitats-selectivitatprinzips auf die sulfonsaureamidbildung // Chem.Ber.-1978.- B.111, №4.- S.1384-1394.
- Мысык Д.Д, Рублева Л.И., Крутько И.Н, Левандовский В.Ю.Влияние структуры N-аренсульфонильного фрагмента на реакционность сульфохлоридов анилидов сульфокислот в условиях нейтрального гидролиза// Вопросы химии и химической технологии.-2004.- № 4.- С.39-42.
- Рублева Л.И. Структура, энергии стерического напряжения и реакционная способность замещенных бензолсульфохлоридов / Л.И. Рублева Н.Н. Максименко С.Н. Лящук Р.В. Визгерт // ЖОрХ.- 1994, т.30, вып.2.-С.261-265.
- Визгерт Р.В., Максименко Н.Н., Рублева Л.И. Особенности реакционной способности стерически затрудненных ароматических сульфохлоридов в реакциях нуклеофильного замещения // Укр.хим.журн.- 1993.-Т.59, № 11.- С.1226-1238.
- Rogne О. Rates of Reaction of Benzenesulphonyl Chloride with Some Nucleophiles in Aqueous Solution // Report. Forsvarets Forskninsinstitut. 1973. N 63. P. 7-30.
- Л. И. Рублева, Д. Д. Мысык, В. Ю. Левандовский, Н. А. Языков // Молодежь в науке - 2009: прил. к журн. «Весці Нацыянальнай акадэміі навук Беларусі». В 5 ч. Ч. 1. Серия химических наук. - Минск: Беларус. навука, 2010. – С. 67 – 71 [Електронний ресурс]. – Режим доступа: http://archive.nbuv.gov.ua/..
- Пальм В.А. Основы количесвенной теории органических реакций / Л.: Химия, 1977. – 360с.
- Визгерт Р.В. Реакционная способность пространственно затрудненных ароматических сульфокислот. I. Влияние заместителей на скорость и механизм гидролиза некоторых замещенных бензолсульфохлорида / Р.В.Р.В.Визгерт, Л.И.Р.В.Рублева, Н.Н.Р.В.Максименко // ЖорХ. – 1989.-т.25, вып.4.–С.810–814.
- Мисик Д.Д., Рубльова Л.І., Крутько І.М., Левандовський В.Ю., Язиков М.О. Синтез і реакційна здатність 3–(N–метил–N–аренсульфоніламіно)–4–метоксибензенсульфохлоридів в реакції нейтрального гідролізу // Вопросы химии и хим.технологии.-2008.- №6.- 0,5 у.п.л..
- Rubleva L.I., Levandovsky V.U., Yazikov N.A., Popovich T.S. The application of thermodynamic parameters of transition state for interpretation of mechanism of nucleophilic substitution in sulphochlorides of anilides of sulphoacids // XVIII International Conference on Chemical Thermodynamics in Russia Samara, Russian Federation, October 3–7, 2011 [Електронний ресурс]. – Режим доступа: http://ea.donntu.ru..
- Языков Н.А., Рублева Л.И., Левандовский В.Ю. Конструкция и принцип действия реактора для промышленной очистки фенолсодержащих сточных вод // Охорона навколишнього середовища та раціональне використання природних ресурсів. Збірка доповідей VIII Міжнародної конференції аспірантів і студентів.–Т.2– Донецьк: ДонНТУ, ДонНУ, 2009.– С.– 89–90.
