Реферат по теме выпускной работы
Содержание
- Введение
- 1. Обзор существующих методов обесфеноливания
- 1.1 Паровой метод обесфеноливания
- 1.2 Экстракционные методы очистки
- 1.3 Биохимические методы очистки
- 2. Синтез сульфохлоридов анилидов сульфокислот с экранированными сульфониламидными заместителями
- 2.1 Синтез N–бензенсульфонил–2,4,6–триметиланилина
- 2.2 Алкилирование N–бензенсульфонил–2,4,6–триметиланилина
- 2.3 Сульфохлорирование N–метил–N–бензенсульфонил–2,4,6–триметиланилина
- 2.4 Очистка сульфохлоридов анилидов сульфокислот
- 2.5 Определение структуры синтезированных соединений
- 3 Изучение кинетических особенностей нейтрального гидролиза 3–N(XАrSO2)–NMe]–2,4,6–Me3–C6H2SO2Cl
- 4 Влияние структурных факторов заместителей на характер протекания нейтрального гидролиза в 70% в.д.
- 5 Разработка технологической схемы химического обесфеноливания сточных вод
- Выводы
- Список источников
Введение
Актуальность темы
Работа посвящена химическому извлечению фенолов из сточных вод промышленных предприятий с использованием производных аренсульфокислот. Способ является более экономичным по сравнению с большинством существующих. Метод химического обесфеноливания с использованием предложенных субстратов не зависим от концентрации фенольных стоков, применим практически на всех предприятиях без ограничений, присущих другим технологическим подходам. Кроме того, извлеченные фенолы и их производные могут применяться в различных отраслях народного хозяйства [1,2].
Цель и задачи исследования, планируемые результаты, научная новизна
Цель: обоснование природы положительного стерического эффекта в условиях нуклеофильного замещения у сульфонильного центра в стерически затрудненных сульфохлоридах анилидов сульфокислот и разработка технологической схемы химического обесфеноливания сточных вод.
Основные задачи исследования:
- Исследование кинетических закономерностей 3–[N(ХArSO2)–NMe]–2,4,6–Me3–С6НSO2Cl в среде 70% водного диоксана (в.д.) в интервале температур 303–323 К.
- Расчет термодинамических параметров переходного состояния для замещения у сульфонильного центра.
- Обоснование механизма реакции нуклеофильного замещения в условиях гидролиза.
- Обоснование и разработка технологической схемы химического обесфеноливания сточных вод на основе исследуемых субстратов.
Предмет исследования: стерически затрудненные сульфохлориды анилидов сульфокислот
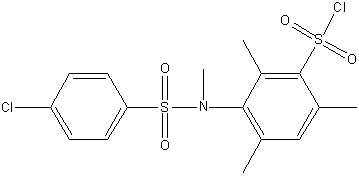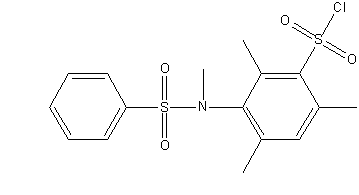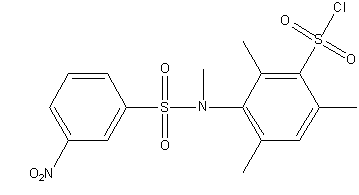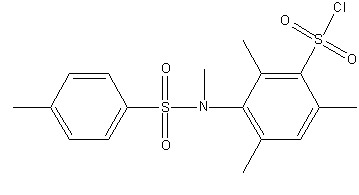
Рисунок 1 – Исследуемые сульфохлориды анилидов сульфокслот
(gif–анимация:4 кадра, 5 повторов, 5.45 кБ)
Планируемые практические результаты: обоснование и разработка технологии процесса химического обесфеноливания сточных вод.
Научная новизна:
- Синтез соединений ряда 3–[N(ХArSO2)–NMe]–2,4,6–Me3–С6НSO2Cl, ранее неописанных в литературе.
- Исследование реакционности данных субстратов в условиях нейтрального гидролиза.
- Выявление изопараметрической области по температуре, в которой скорости всех субстратов сравнимы, что расширяет возможности обесфеноливания.
- Разработка и детализация технологической схемы химической очистки сточных вод.
1 Обзор существующих методов обесфеноливаниия
1.1 Паровой метод обесфеноливания
Паровой метод обесфеноливания сточных вод в сочетании c мокрым тушением кокса и замкнутым циклом фенольных вод, или c биологической доочисткой получил на отечественных коксохимических заводах широкое распространение. Обесфеноливающая установка предназначена для удаления основной части фенолов из надсмольной и сепараторнoй вод смолоперегонного цеха после обработки в аммиачной колонне с получением фенолятов установленного качества по техническим условиям. Степень обесфеноливания сточных вод на установке должна быть не менее 85%, а остаточное содержание фенолов в обработанной воде — не более 0,2 г/л. Сущность этого метода заключается в том, что из сточной воды, нагретой до 100–102 °С, фенолы выдуваются большим количеством острого водяного пaрa, а затем смесь пара и фенолов пропускают через нагретый до 102–103 °С поглотительный раствор щелочи для образования фенолятов [3].
Достоинства: компактность установки, простота оформления, возможность автоматизации
Недостатки метода: большие энергозатраты, невозможность полного удаления фенолов.
1.2 Экстракционные методы очистки
Экстракционные методы пригодны для извлечения фенолов из концентрированных вод, содержащих более 2 г/л фенолов. Суть методов в том, что к фенольным стокам добавляют несмешивающийся с водой растворитель, в котором фенолы растворяются легче, чем в воде. Это приводит к образованию двухслойной смеси, легко разделяющейся декантированием. Один слой состоит из обесфеноленной воды, второй представляет собой смесь растворителя с поглощенными из воды фенолами, откуда они извлекаются отгонкой растворителя или в виде фенолятов. В обоих случаях освобожденный от фенолов растворитель снова поступает в цикл. Процесс экстрагирования сточных вод состоит из трех стадий: приведение смеси, подлежащей экстрагированию, в тесный контакт с растворителем; разделение образовавшихся фаз; удаление и регенерация растворителя [3,4].
Достоинства метода: высокая степень обесфеноливания сточных вод, более полное извлечение фенолов и практически полное — масел и смол по сравнению с пароциркуляционным методом.
Недостатки: высокая себестоимость растворителей и необходимость их регенерации, сложность технологической схемы.
1.3 Биохимические методы очистки
Биохимические методы основаны на способности микроорганизмов к окислению органических соединений. Конечными продуктами биохимического разложения примесей, содержащихся в сточных водах, являются диоксид углерода (СО2) и вода. Эти методы обеспечивают глубокую очистку сточных вод в результате разложения фенолов. Используют микроорганизмы двух видов: активный ил (биологическую пленку) и культуры специальных бактерий, предназначенных для разрушения компонентов сточных вод. Активный ил представляет собой скопление бактерий — зооглей и простейших организмов — нитчатых, жгутиковых, корненожек, инфузорий, коловpaтoк и др. На установках c активным илом лучшие результаты обесфеноливания получаются после предварительного разбавления фенольных сточных вод технической водой или промышленно–бытовыми водами [3,5].
Достоинства метода: глубокая степень очистки сточных вод.
Недостатки: высокая стоимость эксплуатации и громоздкость оборудования, применимость только для достаточно разбавленных сточных вод, чувствительность биологических систем к токсическим компонентам сточных вод, ограниченный рабочий температурный интервал.
2 Синтез сульфохлоридов анилидов сульфокислот с экранированными сульфониламидными заместителями
При выполнении синтеза по методике [6] возникли определенные трудности. Синтез подобных структур усложняется тем, что под действием сульфатной, хлорсульфоновой и соляной кислот, находящихся в реакционной смеси, искомые субстраты изомеризуются, разлагаются на несколько групп производных: соли, производные бензенсульфохлорида, сульфированные вторичные амины и др. Вероятно, этим объясняется практически полное отсутствие в литературе информации о получении названных соединений. Всего синтезировано 12 неописанных в литературе веществ.
2.1 Синтез N–бензенсульфонил–2,4,6–триметиланилина
Синтез осуществлялся по реакции:
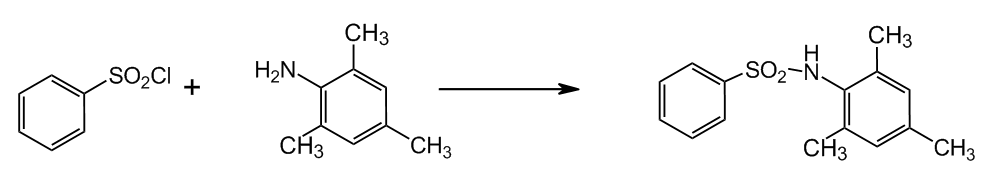
Рисунок 2 — Синтез N–бензенсульфонил–2,4,6–триметиланилина
Реактивы:
- бензенсульфохлорид — 4,41 г (0,025 моль).
- 2,4,6–диметиланилин — 4,05 г 0,030 моль).
- карбонат натрия — 2,12 г.
Сульфохлорид и анилин смешивали в конической колбе на 200 мл, добавляли воды до 50 мл и малыми порциями — соду при нагревании и перемешивании. Окончание реакции регистрировали визуально по отверждению маслоподобной смеси — раствора сульфохлорида в анилине и по исчезновению запаха анилина. По окончании реакции раствор подкисляли HCl до выпадения осадка.
Полученный N–бензенсульфонил–2,4,6–триметиланилин отфильтровывали, промывали дистиллированной водой, переосаждали из щелочи для освобождения от примеси сульфохлорида и снова фильтровали Остаток на фильтре сушили на воздухе.
Выход продукта 5,2 г (0,02 моль) — 80%.
2.2 Алкилирование N–бензенсульфонил–2,4,6–триметиланилина
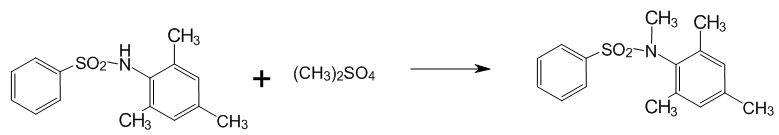
Рисунок 3 — Алкилирование N–бензенсульфонил–2,4,6–триметиланилина
Реактивы:
- N–бензенсульфонил–2,4,6–триметиланилин — 7,225 г (0,025 моль).
- Щелочь NaOH — 2,1 г (0,025 моль).
- Вода — 50 мл.
- Диметилсульфат — 5,04 г (0,04 моль) 3,8 мл.
На масляной бане собирали установку, состоящую из трехгорлой колбы, мешалки и капельной воронки. В колбу наливали воду, помещали 1 г щелочи и сульфамид. Нагревали реакционную смесь до 60 °С при помешивании до полной гомогенизации. Через капельную воронку прибавляли диметилсульфат (ДМС). Протекание реакции отмечали по выделению нерастворимого осадка. По ходу реакции контролировали pН , при наличии кислой реакции — добавляли щелочь. По окончании прикапывания ДМС осадок отфильтровывали, фильтрат подкисляли соляной кислотой и оставляли отстаиваться. Остаток на фильтре растворяли в 15 мл ацетона и выливали в 50 мл 1% щелочи. Для извлечения исходного вещества выпавший осадок фильтровали и фильтрат подкисляли.
Выход 3,53 г (0,016 моль) – 63 %, остаток исходного вещества 1,3 г.
2.3 Сульфохлорирование N–метил–N–бензенсульфонил–2,4,6–триметиланилина
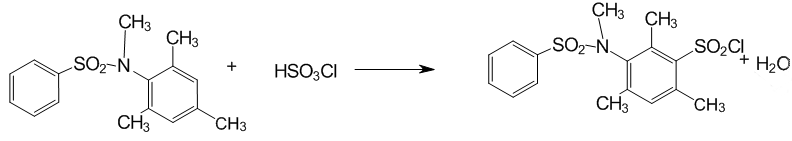
Рисунок 4 — Сульфохлорирование N–бензенсульфонил–2,4,6–триметиланилина
Реактивы:
- N–метил–N–бензенсульфонил–2,4,6–триметиланилин — 1,935 г (0,005 моль).
- Хлорсульфоновая кислота — 10 мл.
- Хлористий метилен — 30 мл.
- Октан — 15 мл.
- Изопропанол — 10 мл.
К охлажденной до 0 °С хлорсульфоновой кислоте добавляли N–метил–N–бензенсульфонил–2,4,6–триметиланилин, растворяли при помешивании и оставляли на двое суток при температуре близкой к 0 °С в плотно закупоренной колбе, свободной от попадания влаги.
Через двое суток в колбу добавляли 20 мл хлористого метилена для экстракции сульфохлорида и выливали по каплям реакционную массу на лед. Когда лед таял, двухфазную эмульсию делили на делительной воронке, нижний слой собирали и еще дважды промывали дистиллированной водой от остатков кислоты. После этого органическую фазу сливали в коническую колбу и сушили хлористым кальцием. Далее органический слой фильтровали для удаления хлористого кальция и выпаривали растворитель при слабом нагревании в вакууме водоструйного насоса. Продукт растирали с изопропанолом, фильтровали и дважды промывали 5 мл изопропанола.
Осадок на фильтре помещали в стакан на 100 мл и растворяли в хлористом метилене. Сверху аккуратно приливали 15 мл октана, стараясь не смешать растворители. Т.к. хлористий метилен чрезвычайно летуч (температура кипения — 42 °С), а сульфохлориды анилидов сульфокислот практически нерастворимы в предельных углеводородах, на границе раздела фаз появляются кристаллы сульфохлорида. Этим достигается высокая чистота искомого соединения.
Выход 1,18 г (0,00316 моль) — 63 %.
2.4 Очистка сульфохлоридов анилидов сульфокислот
Полученные субстраты 3–[N(XАrSO2)–NMe]–2,4,6–Me3–C6H2SO2Cl оказались достаточно чисты для кинетических измерений, но тем не менее их дополнительно перекристаллизовывали из диоксана. Для этого навески массой около 0,5 г растворяли при нагревании в 1 мл горячего диоксана и фильтровали. После охлаждения фильтрата, выкристаллизовавшийся продукт промывали 5 мл изопропанола и сушили. Выход составлял около 50–70%.
2.5 Определение структуры синтезированных соединений
Структура сульфохлоридов анилидов сульфокислот подтверждена несколькими способами:
- методом кислотно-основного титрования определяли молярную массу сульфохлоридов.
- проведен элементный анализ по методике [7] на наличие активного хлора;
- сняты спектры ПМР синтезированных субстратов.
3 Изучение кинетических особенностей нейтрального гидролиза
3–[N(XАrSO2)–NMe]–2,4,6–Me3–C6H2SO2Cl
Исследована кинетика нейтрального гидролиза соединений общей формулы 3–[N(XАrSO2)–NMe]–2,4,6–Me3–C6H2SO2Cl, где Х=4–CH3, H, 4–Cl, 3–NO2 в 70 % (объём.) водном диоксане и интервале температур 303–323 К. Эффективные константы скорости и рассчитанные параметры активации переходного состояния, а именно: энтальпия активации переходного состояния, энтропия активации и энергия Гиббса представлены в табл. 1.
Реакция нейтрального гидролиза исследуемых субстратов имеет вид:
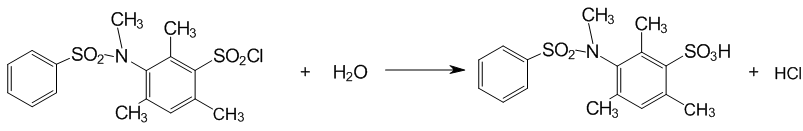
Рисунок 5 — Гидролиз сульфохлоридов анилидов сульфокислот
Таблица 1 — Эффективные константы скорости kеф×104(с-1) и активационные параметры для гидролиза
3–[N(XАrSO2)–NMe]–2,4,6–Me3–C6H2SO2Cl в 70% в.д.
| X | kэфф×104(с-1) | ΔH≠, кДж/моль |
ΔH≠, Дж/моль×К |
ΔG313≠, кДж/моль |
||
| 303 | 323 | 333 | ||||
| H | 2.5 | 4.68 | 9.59 | 52.0±2.5 | 172±10 | 106±6 |
| 4–Me | 2.53 | 5.49 | 10.9 | 56.9±3.0 | 155±8 | 105±5 |
| 4 Cl | 2.4 | 5.02 | 11.2 | 60.0±1.5 | 139±10 | 104±5 |
| 3 NO2 | 2.24 | 5.04 | 11.3 | 63.0±3.8 | 129±11 | 103±7 |
Для серии субстратов наблюдается тенденция увеличения скорости реакции с ростом электроноакцепторного характера заместителя Х, т.е. процессу замещения способствует низкая электронная плотность на центре нуклеофильной атаки — атоме Сульфура сульфогруппы (табл.1).
Заместители Х удалены от реакционного центра, и их электронные и стерические свойства лишь в незначительной степени отображаются на скорости процесса. При этом при возрастании температуры от 303 до 323 К разница в реакционности становится все более очевидной (табл. 1). Например, для незамещенного производного отношение k313/k303 и k323/k313 составляет соответственно 1,872 и 2,231. В целом, характер влияния заместителя Х соответствует общим закономерностям механизма бимолекулярного нуклеофильного замещения SN2–типа, который постулирован ранее рядом авторов [8,9,10,11] для замещения у тетракоординированного атома Сульфура в производных аренсульфокислот. Также можно отметить сближение значений эффективных констант для всех субстратов серии при температуре 303 К. При этом характер влияния заместителя Х меняется в исследуемом интервале температур. Варьирование заместителя существенно не влияет на параметр энтальпии активации переходного состояния ΔH≠, однако в значительной степени сказывается на величине энтропийного фактора ΔS≠. При этом увеличение реакционной способности субстратов не связано с выигрышем в энтальпии активации, напротив — наблюдается ее незначительный рост. Абсолютное значение энтропии активации |ΔS≠| понижается при увеличении электроноакцепторного характера Х.
Привлекает внимание факт постоянства величин энергии Гиббса ΔG313≠ переходного состояния для всех субстратов на уровне 106 кДж/моль.
4 Влияние структурных факторов заместителей на характер протекания нейтрального гидролиза в 70 % в.д.
Нами была предпринята попытка оценить взаимосвязь структура субстрата — реакционность по уравнению Гаммета [12]:
где ρх — коэффициент чувствительности реакции к электронным эффектам заместителей Х в аренсульфамидном фрагменте молекулы
σ — постоянные, которые характеризуют электронные эффекты заместителей Х.
Рассчитанные параметры данного уравнения доказали фактическое отсутствие корреляции для серии с оценочными значениями ρх, которые приведены в табл. 2.
Таблица 2 — Параметры корреляции уравнения Гаммета для гидролиза в 70% в.д.
3–[N(ХArSO2)–NMe]–2,4,6-Me3–С6НSO2Cl.
| T, К | 3–[N(ХArSO2)–NMe]–2,4,6-Me3–С6НSO2Cl | ArSO2Cl [13] |
| ρx | ρв | |
| 303 | -0.062 | -0.90 |
| 313 | -0.017 | -0.95 |
| 323 | 0.044 | -0.98 |
Примечание; Статистические параметры R=0,7÷0,9, S=10-5÷10-2, Δρ=0,04÷0,05
Одновременно, статистические параметры и ошибки величины ρх свидетельствуют о возможности использования параметров уравнения (1) для предварительного анализа. Скорость реакции гидролиза сульфохлоридов анилидов сульфокислот сравнима с соединениями модельного ряда — производными бензенсульфохлорида, а селективность их к заместителю Х значительно ниже, чем у модельных субстратов XArSO2Cl (табл.2) [13].
Вероятно, это обусловлено изоляцией мостиковой группой –SO2–N–Me– реакционного центра — атома Сульфура сульфогруппы от влиния Х в N–аренсульфонильном фрагменте и особенностями пространственной структуры переходного и исходного состояний.
Из Аррениусовского графика для соединений с замещающими группами X=4–CH3, H, 4–Cl (рис. 2.) обнаруживается четкая тенденция к
сближению данных зависимостей в области, которую можно условно назвать зоной изопараметричности
. Данные расчета изокинетической температуры Тизо
по модифицированному методу Екснера указывают на то, что рабочая область температур находится выше изокинетической области.
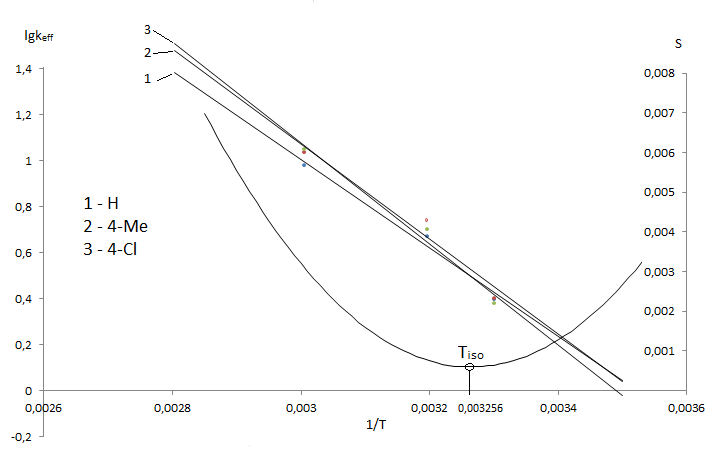
Рисунок 6 — Аррениусовский график для гидролиза в 70% водном диоксане 3–[N(ХArSO2)–NMe]–2,4,6–Me3–С6НSO2Cl
Теоретически рассчитанная изокинетическая температура составила 306 К.
Таким образом для гидролиза сульфохлоридов анилидов сульфокислот наблюдается достаточно редкое явление — изопараметрическая температура находится в реально достижимой области. Этим, возможно, и объясняется неоднозначность кинетических данных и значений параметров активации ПС. Очевидно, что интерпретация кинетических закономерностей процесса должна опираться на оценку положения исследуемого температурного интервала относительно Тизо.
Для гидролиза при T<Tизо реализуется энтальпийный контроль, при T>Tизо — энтропийный. Конечно, объяснение структурных особенностей ПС должно быть разным при температурах выше и ниже Tизо. При более низких температурах превалируют электронные взаимодействия в ПС, при более высоких — кинетические закономерности определяются в большей степени стерическими эффектами в переходном состоянии. Величина ΔS≠ представляет собой меру изменения степеней свободы внутреннего движения при переходе от начального состояния к ПС. При потере степеней свободы величина ΔS≠ становится более отрицательной и ПС имеет более сложную конфигурацию. Возможно, накопление метильных групп в сульфохлоридной части молекулы способствует незначительному облегчению стерических взаимодействий при нуклеофильной атаке и менее плотной «упаковке» переходного состояния, связанной с отклонением от тригонально–бипирамидальной структуры [14,15], что отражается на снижении величин свободной энергии активации ΔG≠ для соединений.
5 Разработка технологической схемы химического обесфеноливания сточных вод
Предложенная технологическая схема отделения обесфеноливания для коксохимических предприятий приведена на рис.7.
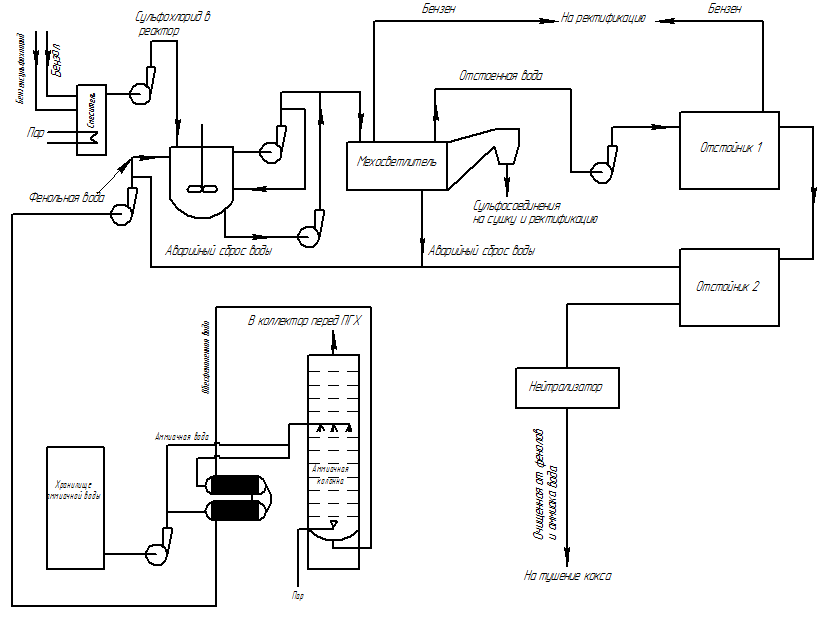
Рисунок 7 — Технологическая схема отделения обесфеноливания
Перед обесфеноливанием планируется проводить предварительную отдувку летучего аммиака в аммиачной колонне, который содержится в надсмольной воде и конденсате первичных газовых холодильников коксохимических производств для уменьшения избыточных количеств концентраций солей аммония.
Для интенсификации процесса предложено предварительное растворение сульфохлорида в бензене, который является одним из продуктов коксохимических производств, подогревание смеси до оптимальной изокинетической температуры (30 °С), а также проведение реакции в условиях, приближенных к идеальному смешению, т.е. в емкостном аппарате с механическим и гидравлическим перемешиванием.
Реакция будет протекать в ультрамикрогетерогенной среде в реакторе идеального смешения (РИС) (рис. 7) [14,15]. В аппарате предложено механическое перемешивание с использованием пропеллерных мешалок и гидравлическое перемешивание — многократной прокачкой жидкости через систему апарат — циркуляционный насос — аппарат.
Часть воды, удаляемой из аппарата через слив, возвращается в реактор циркуляционным насосом, а другая часть отводится далее по схеме. Так как продукты реакции нерастворимы в воде и растворимы в бензене предложено после реактора отводить их далее на мехосветлители для очистки от сульфоэфира, выпадающего в осадок.
Мехосветлители (рис.8) широко используются на коксохимических производствах для осветления надсмольной воды и удаления смолы. Разделение на фракции в этих аппаратах осуществляется при помощи гравитационных сил. Смесь подается через корыто 2. Выпавший в осадок сульфоэфир удаляется при помощи скребкових транспортеров 7 через разгрузочные резервуары 6. Очищенная от сульфоэфиров вода выводится через штуцер 4. Так как вязкость бензена значительно меньше вязкости смолы, для очистки которой разработан данный аппарат, необходимости обогрева глухим паром либо надсмольной водой через штуцер 8 не возникает.
После мехосветлителя очищенная смесь будет подаваться в два последовательно соединенных отстойника на дополнительное отстаивание. Отстойники также неообходимы и как предохранительные емкости, в которые могут подаваться сточные воды в случае аварийной ситуации, или при необходимости разгрузки аппарата.
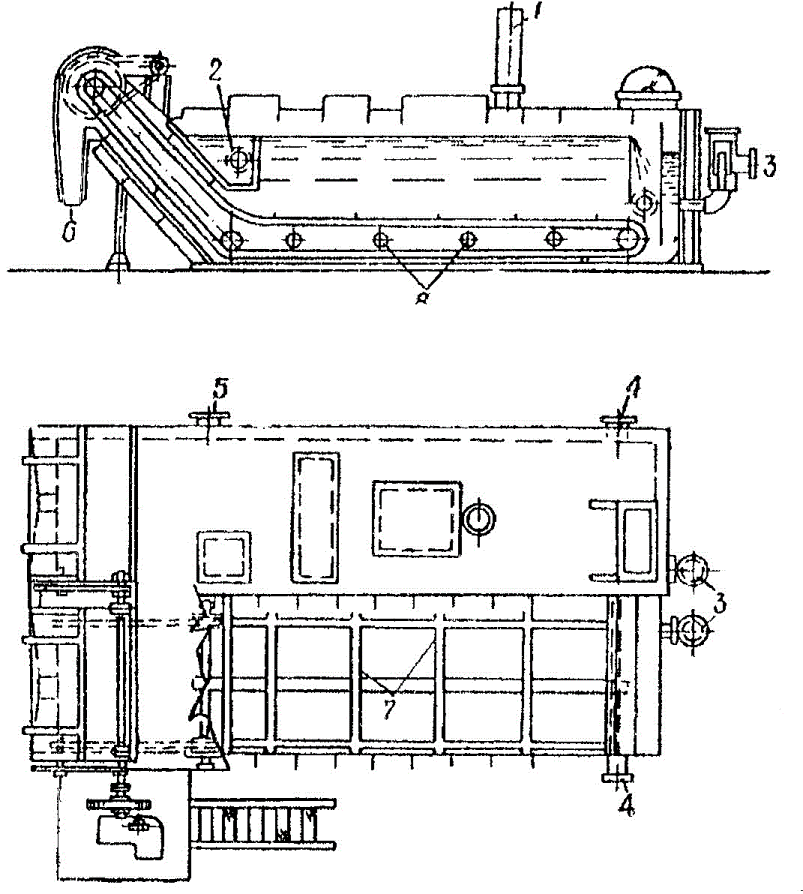
Рисунок 8 — Механический осветлитель
1 – воздушник; 2 – корыто для приема смеси; 3 – вывод сульфоэфиров; 4 – выход очищенной воды; 5 – выход смеси; 6 – выход сульфоэфиров; 7 – скребковый транспортер; 8 – подвод пара
Отстоянная вода может быть направлена на нейтрализацию для удаления растворенных в ней соляной и сульфокислот, а далее — для очистки на внеплощадных очистных сооружениях, либо на мокрое тушение кокса. Смесь сульфоэфиров и сульфамидов в бензене после отстаивания идет на ректификацию, в результате которой бензен возвращается в цикл обесфеноливания, а продукты поддаются дальнейшему разделению [16].
Выводы
- Синтезировано 12 новых, ранее не описанных в литературе соединений.
- Исследована кинетика нейтрального гидролиза 3–[N(ХArSO2)–NMe]–2,4,6-Me3–С6НSO2Cl в 70% в.д. в интервале температур 303–333 К.
- Рассчитаны термодинамические параметры переходного состояния для замещения у сульфонильного центра. Обнаружена зона изопараметричности по температуре для сольволиза исследуемых субстратов.
- Обоснован общий механизм замещения SN2 для исследуемой и модельной серий субстратов.
- Предложено переходное состояние неклассической структуры в условиях нуклеофильного замещения у сульфонильного центра в сульфохлоридах анилидов сульфокислот.
- Приведена и обоснована технологическая схема химического обесфеноливания сточных вод на основе исследуемых субстратов.
Список источников
- Волянская Н.П., Гриценко И.С. Противомикробная активность и фармакологические эффекты фенольньых соединений // Annals of Mechnicov’s Institute, N2, 2005, pp. 3 - 7.
- Харламович Г. Д., Чуркин Ю. В. Фенолы // М.,
Химия
, 1974, 376 с. - Лейбович Р.Е. Технология коксохимического производства: Учебник для техникумов / Лейбович Р.Е., Яковлева Е.И., Филатов А.Б.; Под. ред. Рядинова Н.А. - М.: Металлургия, 1982. – 360 с.
- Boyadzhiev L., Alexandrova S. Dephenolation of Phenol-Containing Waters by Rotating Film Pertraction // Separation Science and Technology, 27(l0), pp 1307-1317.
- Kamenev I., Munter R., Pikkov L. Wastewater treatment in oil shale chemical industry // Oil Shale, 2003, Vol. 20, No. 4, pp. 443-457.
- Giece B., Heuck K. Das reaktivitats-selectivitatprinzip. Anwendung des reaktivitats-selectivitatprinzips auf die sulfonsaureamidbildung // Chem.Ber.-1978.- B.111, №4.- S.1384-1394.
- Мысык Д.Д, Рублева Л.И., Крутько И.Н, Левандовский В.Ю.Влияние структуры N-аренсульфонильного фрагмента на реакционность сульфохлоридов анилидов сульфокислот в условиях нейтрального гидролиза// Вопросы химии и химической технологии.-2004.- № 4.- С.39-42.
- Рублева Л.И. Структура, энергии стерического напряжения и реакционная способность замещенных бензолсульфохлоридов / Л.И. Рублева Н.Н. Максименко С.Н. Лящук Р.В. Визгерт // ЖОрХ.- 1994, т.30, вып.2.-С.261-265.
- Визгерт Р.В., Максименко Н.Н., Рублева Л.И. Особенности реакционной способности стерически затрудненных ароматических сульфохлоридов в реакциях нуклеофильного замещения // Укр.хим.журн.- 1993.-Т.59, № 11.- С.1226-1238.
- Rogne О. Rates of Reaction of Benzenesulphonyl Chloride with Some Nucleophiles in Aqueous Solution // Report. Forsvarets Forskninsinstitut. 1973. N 63. P. 7-30.
- Л. И. Рублева, Д. Д. Мысык, В. Ю. Левандовский, Н. А. Языков // Молодежь в науке - 2009: прил. к журн. «Весці Нацыянальнай акадэміі навук Беларусі». В 5 ч. Ч. 1. Серия химических наук. - Минск: Беларус. навука, 2010. – С. 67 – 71 [Электронный ресурс]. – Режим доступа: http://archive.nbuv.gov.ua/..
- Пальм В.А. Основы количесвенной теории органических реакций / Л.: Химия, 1977. – 360с.
- Визгерт Р.В. Реакционная способность пространственно затрудненных ароматических сульфокислот. I. Влияние заместителей на скорость и механизм гидролиза некоторых замещенных бензолсульфохлорида / Р.В.Р.В.Визгерт, Л.И.Р.В.Рублева, Н.Н.Р.В.Максименко // ЖорХ. – 1989.-т.25, вып.4.–С.810–814.
- Мисик Д.Д., Рубльова Л.І., Крутько І.М., Левандовський В.Ю., Язиков М.О. Синтез і реакційна здатність 3–(N–метил–N–аренсульфоніламіно)–4–метоксибензенсульфохлоридів в реакції нейтрального гідролізу // Вопросы химии и хим.технологии.-2008.- №6.- 0,5 у.п.л..
- Rubleva L.I., Levandovsky V.U., Yazikov N.A., Popovich T.S. The application of thermodynamic parameters of transition state for interpretation of mechanism of nucleophilic substitution in sulphochlorides of anilides of sulphoacids // XVIII International Conference on Chemical Thermodynamics in Russia Samara, Russian Federation, October 3–7, 2011 [Электронный ресурс]. – Режим доступа: http://ea.donntu.ru..
- Языков Н.А., Рублева Л.И., Левандовский В.Ю. Конструкция и принцип действия реактора для промышленной очистки фенолсодержащих сточных вод // Охорона навколишнього середовища та раціональне використання природних ресурсів. Збірка доповідей VIII Міжнародної конференції аспірантів і студентів.–Т.2– Донецьк: ДонНТУ, ДонНУ, 2009.– С.– 89–90.
