|
|
|
|
| Русский язык | Українська мова | English language |
| ДонНТУ |
|
Портал магистров ДонНТУ |
| Автобиография |
| Библиотека |
| Ссылки |
| Отчёт о поиске |
| Мои кактусы |
|
ОГЛАВЛЕНИЕ
Цели и задачи Актуальность работы Научная новизна Планируемые практические результаты Обзор исследований и разработок по теме Химический метод обесфеноливания Синтез и реакционность сульфохлоридов анилидов сульфокислот ВЫВОДЫ ЛИТЕРАТУРА Ссылки на интернет источники | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Автореферат |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Цели и задачи | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Цели и задачи, которые решаются в данной работе - выявление кинетических закономерностей реакции нейтрального гидролиза ряда сульфохлоридов анилидов сульфокислот в водно-органической среде в зависимости от температуры и структурных особенностей субстрата, для обоснования предложенной технологии химической очистки сточных вод коксохимичесих предприятий химическим методом. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Актуальность работы | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Проблема утилизации промышленных сточных вод и их очистки от имеющихся в них токсикантов является одной из важнейших проблем экологии. Фенолы, будучи одним из наиболее распространенных токсичных загрязнителей, являются в то же время важными и дефицитными компонентами органического синтеза. Поэтому из концентрированных фенольных сточных вод более выгодно извлекать фенолы или переводить их в малотоксичные продукты, которые могут найти дальнейшее применение, а не просто уничтожать их, подвергая деструкции путем биохимического окисления, термического разложения и др. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Научная новизна | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Научная новизна работы состоит в синтезе новых производных ароматических сульфохлоридов, исследовании их реакционности при нуклеофильном замещении, обнаружении наличия зоны изокинетической температуры в рабочем диапазоне,а также предложенном варианте практической реализации метода химической очистки сточных вод. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Планируемые практические результаты | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
В результате работы, выполняемой по данной теме, планируется разработать и обосновать технику и технологию для проведения процесса очистки сточных вод коксохимических предприятий химическим методом. В дальнейшем планируется патентование схемы и аппаратов, промышленные испытания и внедрение в производство. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Обзор исследований и разработок по теме | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Одним из распространенных токсичных загрязнителей сточных вод химических производств являются фенолы. Основные источники фенольного загрязнения природных вод - коксохимические, сланцеперерабатывающие, лесохимические предприятия, производства фенолфталеина, фенолформальдегидных смол, салициловой кислоты и салола, шпалопропиточные заводы, предприятия нефтехимии. Для обесфеноливания промышленных стоков чаще всего применяются пароциркуляционный, экстракционный, адсорбционный, биохимический методы. Следует отметить, что фенолы являются в то же время важным и дефицитным сырьем органического синтеза и утилизировать их путем деструкции не всегда экономически целесообразно [1,2]. Паровой метод обесфеноливания сточных вод в сочетании с мокрым тушением кокса и замкнутым циклом фенольных вод или с биологической доочисткой получил на отечественных коксохимических заводах широкое распространение. Обесфеноливающая установка предназначена для удаления основной части фенолов из надсмольной воды и сепараторной воды смолоперегонного цеха (при наличии этого цеха на заводе), прошедшей обработку в аммиачной колонне, с получением фенолятов установленного качества в соответствии с требованиями технических условий. Степень обесфеноливания сточных вод на установке должна быть не менее 85% , остаточное содержание фенолов в обработанной воде должно составлять не более 0,2 г/л. Сущность этого метода заключается в том, что из сточной воды, нагретой до 100—102° С, фенолы выдуваются большим количеством острого водяного пара, а затем смесь пара и фенолов пропускают через нагретый до 102—103° С поглотительный раствор щелочи, который взаимодействует с фенолами с образованием фенолятов. Основным аппаратом паровой установки является обесфеноливающий скруббер, состоящий из верхней испарительной части с деревянной хордовой насадкой, в которой из воды выдуваются фенолы, и нижней поглотительной части, имеющей металлическую спиральную насадку, в которой из пара раствором едкого натра фенолы и крезолы связываются в феноляты и крезоляты натрия по уравнениям:
C6H6OH + NaOH → C6H6ONa +Н2О; (в малом количестве образуются крезолиты и другие соли натрия). Эта смесь фенолятов и крезолятов называется фенолятами.
Очищенный водяной пар снова используется для обесфеноливания воды в верхней части скруббера, т. е. находится в замкнутом цикле. Экстракционный метод обесфеноливания
Экстракционные методы обесфеноливания сточных вод пригодны для извлечения фенолов из довольно концентрированных вод, содержащих более 2 г/л фенолов. Суть методов состоит в том, что фенолсодержащая вода смешивается с каким-нибудь жидким растворителем, в котором фенолы растворяются легче, чем в воде, сам же растворитель в воде не растворяется, в результате чего после обработки жидкости распадаются на два слоя, легко разделяющихся декантацией. Один слой состоит из обесфеноленной воды, второй представляет собой растворитель с поглощенными из воды фенолами, откуда они извлекаются либо отгонкой растворителя, либо переводом фенолов в феноляты путем обработки раствора едкой щелочью. В обоих случаях освобожденный от фенолов растворитель снова идет на промывку—экстракцию воды от фенолов.
Биохимические методы обесфеноливания
Биохимические методы основаны на способности микроорганизмов окислять фенолы. Конечными продуктами биохимического разложения примесей, содержащихся в сточных водах, являются соединения высшей степени окисления — диоксид углерода (СО2) и вода. Эти методы обеспечивают глубокую очистку сточных вод в результате разложения фенолов. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Химический метод обесфеноливания | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Существующие методы обесфеноливания имеют ряд ограничений в своем применении и не всегда обеспечивают необходимую степень очистки, а также являются высокозатратными [3]. В связи с этим перспективным представляется химический метод очистки фенольных стоков путем сульфохлорирования.
ArSO2Cl + РhOH → ArSO2OPh +HCl (1)
Безусловно, от степени вероятности протекания процесса (2) зависит глубина и эффективность обесфеноливания, сама возможность применения этого метода. Усложняющим фактором является повышение растворимости субстрата при увеличении доли органической составляющей стоков, что обеспечивает возрастание скорости обеих реакций не в одинаковой степени.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Синтез и реакционность сульфохлоридов анилидов сульфокислот | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Сделан синтез и проведено исследование особенностей скорости и механизма гидролиза (2) ряда вновь полученных сульфохлоридов. Всего получено 7 неописанных в литературе соединений по методике [5]. Синтез N–бензолсульфонил–2,6-диметиланилина
Реагенты: Алкилирование N–бензолсульфонил–2,6-диметиланилина
Реагенты: Сульфохлорирование N–метил–N–бензолсульфонил–2,6-диметиланилина
Реагенты:
Очистка сульфохлоридов анилидов сульфокислот
Субстраты, полученные по вышеуказанной методике достаточно чисты (см. ниже) для кинетических измерений, но соединения серии 5-[N(XАrSO2)–N-Me]-2,4-Me2-C6H2SO2Cl дополнительно очищают перекристаллизацией из диоксана.
Подтверждение структуры полученных соединений
Структура полученных соединений подтверждена методом определения молярной массы субстрата с помощью кислотно-основного титрования, проверкой наличия свободного хлора по методике [6], а также анализом спектров ПМР.
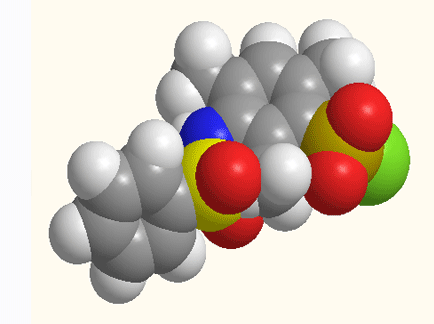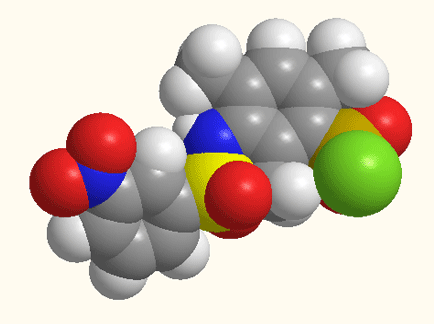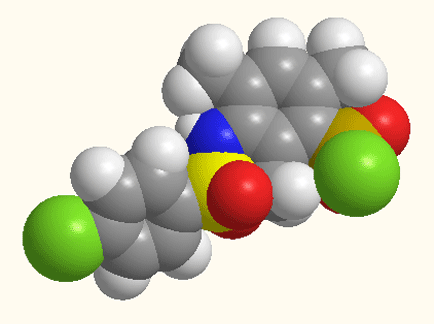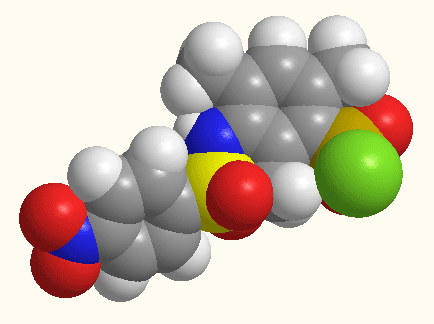
Рисунок 1 - Структурное строение 5-[N(ХArSO2)-NMe]–2,4,6-(CH3)3ArSO2Cl,
Кинетика нейтрального гидролиза синтезированных субстратов
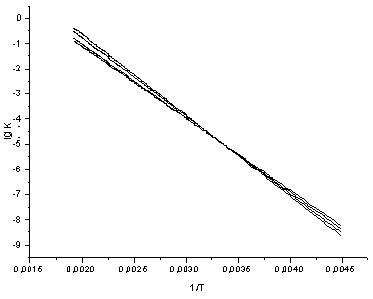
Объекты исследования: N-аренсульфонил-N-метиламинобензолсульфохлориды общей формулы 5-[N(ХArSO2)-NMe]–YArSO2Cl, где Х= 4-Ме, Н, 4-Сl,4-F, 3-NO2, 4-NO2; Y = 2,4-Ме2, 2,6-Ме2, 2,4,6-Ме3. Среда: 70% водный диоксан (в.д.). Интервал температур 303-323К. Выбор условий эксперимента определялся возможностями проведения аналогии с составом и температурными характеристиками сточных вод коксохимических производств ( табл.1-3).
Таблица 1. - Эффективные константы скорости kaэфф • 104 (с-1) и параметры активации ПС для гидролиза 5-[N(ХArSO2)-NMe]–2,4-Me2С6 Н2SO2Cl в 70% в.д. (серия I)
а. Примечание. Погрешность в определении kэфф не превышает 3%
Таблица 2. - Эффективные константы скорости kaэфф • 104 (с-1) и параметры активации ПС для гидролиза 5-[N(ХArSO2)-NMe]–2,6-Me2С6 Н2SO2Cl в 70% в.д. (серия II)
Таблица 3. - Эффективные константы скорости kaэфф • 104 (с-1) и параметры активации ПС для гидролиза 5-[N(ХArSO2)-NMe]–2,4,6-Me3С6 Н2SO2Cl в 70% в.д. (серия III)
Во всех сериях скорость реакции возрастает при увеличении температуры и нарастании электроноакцепторных свойств заместителя Х, т.е. процессу благоприятствует низкая электронная плотность у сульфонильного центра. Замещающие группы Х расположены достаточно далеко от атома серы сульфогруппы, и их электронные и стерические свойства отражаются лишь в незначительной степени на скорости процесса (табл. 1-3).
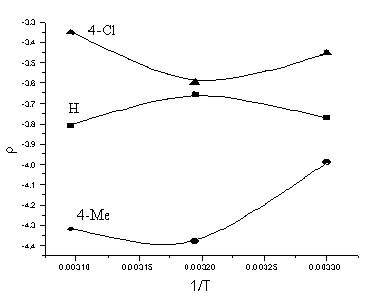
Изменение положения и количества метильных групп Y в амидной части субстрата вызывает значительные колебания его реакционности. Так, если при переходе от Y=2,4-Me2 (серия I) к Y=2,6-Me2 (серия II) отношение kII/kI составляет 1,1 ÷ 1,7, то для субстратов III значение kIII/kII достигает 2,7 ÷ 3,5. Селективность субстрата по заместителям Y характеризуется очень высокими значениями (табл. 4).
Таблица 4. - Параметры коррелляции по уравнению Гаммета для 5-[N(ХArSO2)-NMe]–YArSO2Cl в 70% в.д. при варьировании Y
Из величины ρ <0 следует, что реакция ингибируется акцепторными заместителями, и означает, что действие групп Y противоположно влиянию заместителей Х в аренсульфонильном фрагменте молекулы. Компенсационный эффект не достигается вследствие удаленности Х от реакционного центра. Накопление метильных групп вблизи сульфонильной серы, и связанное с этим ускорение реакции отмечалось ранее [8,9] для аренсульфогалогенидов и объяснено формированием «рыхлого» переходного состояния (ПС) SN2 – типа.
Таблица 5. – Теоретическое значение Тизо для серий I-III, полученное по методу Экснера [5] для гидролиза 5-[N(XArSO2)-NMe]-YArSO2Cl в 70% в.д.
Таким образом, при гидролизе сульфохлоридов анилидов сульфокислот наблюдается довольно редкое явление – изокинетическая температура находится в реально достижимой области. Низкое значение Тизо указывает на то, что ПС определяется в основном стерическими факторами, а не электронной природой заместителей X и Y. И следовательно, интерпретация структурных эффектов как критерия механизма данного процесса должна учитывать наличие энтропийного контроля в ходе реакции.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ВЫВОДЫ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
1 Проведен синтез ряда новых производных сульфохлоридов анилидов сульфокислот. 2 Впервые исследована кинетика нейтрального гидролиза ряда полученных субстратов в водно-органическом растворителе в зависимости от температуры и структурных особенностей фрагментов молекулы. 3 Показано, что относительно низкая реакционность в условиях нейтрального гидролиза дает возможность использования сульфохлоридов анилидов сульфокислот для обесфеноливания сточных вод. 4 Подтвержден эффект ускоряющего действия орто-алкильных групп на процесс нуклеофильного замещения у атома сульфонильной серы. 5 Показано, что для интерпретации влияния структурных эффектов субстрата на реакционную способность целесообразно проводить исследования при нескольких температурах с целью оценки местоположения рабочей области относительно значения Тизо и, соответственно, однородности экспериментальных данных в реакционной серии. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ЛИТЕРАТУРА | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
1. Рублева Л.И., Попова Л.А. Фениларенсульфонаты - продукты химической очистки фенолсодержащих промстоков: реакционность и применение// Збірка доповідей II Міжнародної наукової конференції аспірантів та студентів "Охорона навколишнього середовища та раціональне використання природних ресурсів", том 1, Донецк: 2003 - С. 35-36. 2. Языков Н.А., Рублева Л.И., Левандовский В.Ю. Эффекты структуры субстрата при гидролизе сульфохлоридов анилидов сульфокислот – химических агентов дефеноляции в водноорганических средах // Збірка доповідей VI Міжнародної наукової конференції аспірантів та студентів "Охорона навколишнього середовища та раціональне використання природних ресурсів", том 1, Донецк: 2005 - С. 126-127. 3. Лейбович Р.Е. Технология коксохимического производства. М.: Металлургия, 1982. - 360с. 4. Языков Н.А., Рублева Л.И., Левандовский В.Ю. Установка промышленной очистки фенолсодержащих сточных вод// Збірка доповідей VII Міжнародної наукової конференції аспірантів та студентів "Охорона навколишнього середовища та раціональне використання природних ресурсів", том 1, Донецк: 2006 - С. 126-127. 5.Мысык Д.Д., Бурмистров С.И.// Журн. орган. химии. – 1967.-Т.3. – С.1667–1669. 6.Алексеев В. Н. Количественный анализ. – М.: Просвещение, 1974.- 505 с. 7. Мысык Д.Д., Рублева Л.И., Крутько И.Н., Левандовский В.Ю. Влияние структуры N-аренсульфонильного фрагмента на реакционность сульфохлоридов анилидов сульфокислот в условиях нейтрального гидролиза//Вопросы химии и химической технологии.-2004.- № 4.- С.39-42 8. Рублева Л.И., Максименко Н.Н. VII. Общая математическая модель каталитического сульфонилирования фенола// Журнал органической химии. – 2000. – т.36, вып.9.- С. 1338 – 1340. 9. Визгерт Р.В., Максименко Н.Н., Рублева Л.И. Особенности реакционной способности стерически затрудненных ароматических сульфохлоридов в реакциях нуклеофильного замещения// Укр. хим. журнал, 1993. – Т.59, №11.- С. 1219 – 1230. 10. Шмид Р., Сапунов В.Н. Неформальная кинетика. В поисках путей химических реакций. – М.: Мир, 1985. – 264 с. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ссылки на интернет источники | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
© ДонНТУ 2009 Языков Н.А. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||